药物转运体是一类位于细胞膜、能将药物摄取或排出细胞的蛋白或多肽,广泛分布于体内多种器官和组织,如肝、肠、肾、脑等,能够通过影响药物的吸收、分布和排泄进而影响药物的疗效或安全性,并导致药−药相互作用[1, 2]。转运体通过调控药物在肠上皮细胞、肝细胞或肾小管上皮细胞的进出而影响药物在小肠的吸收以及在肝和肾的消除。此外,转运体也能限制或促进药物在脑、胎盘、肿瘤等生理屏障或细胞的通透[3, 4]。转运体功能的抑制或缺失将改变药物在组织中的暴露,导致药效降低或毒性增加。为此,在新药研发以及药物的临床应用中,研究药物转运体在候选药物或临床药物跨膜转运、组织分布、排泄清除和药−药相互作用中的作用,对于药物有 效安全使用,具有重要的意义[5]。
在新药的体外转运性质研究中,主要采用化学抑制剂或诱导剂进行。但化学抑制剂和诱导剂多存 在非特异性和底物交叉性。文献[6, 7, 8, 9]报道CYP酶,特别是CYP3A和P-gp之间也存在着广泛的底物交叉性。利托那韦、酮康唑和维拉帕米等能够同时抑制CYP3A和P-gp发挥调节作用[10]。因此,使用这些具有交叉性的底物或抑制剂并不能准确反映转运体的作用[11, 12],寻找高效特异的转运体功能研究方法已经成为研究热点。
RNA干扰 (RNA interference,RNAi) 是一种序列特异的基因沉默过程,具有高效性和特异性,广泛用于基因功能和基因治疗的研究[13, 14, 15]。目前,RNA干扰已经用于转运体介导的药物处置过程的研究[16, 17]。本研究通过对化学合成的siRNA进行筛选和评价,构建了P-gp和MRP2的体外细胞干扰模型并用此模型考察了罗丹明和甲氨蝶呤的细胞转运性质。
材料与方法 细胞株HepG2细胞 (人肝癌细胞) 购自北京协和细胞资源中心。
药品和试剂甲氨蝶呤,罗丹明,普萘洛尔 (美国Sigma公司); Trizol RNA提取试剂,Lipofectamine 2000,高糖DMEM培养基,胎牛血清,Opti-MEM培养基 (美国Invitrogen公司); P-gp,MRP2,BCRP抗体(美国Abcam公司); 牛血清白蛋白 (BSA),β-actin抗体,HRP-羊抗兔IgG ,HRP-羊抗小鼠IgG (北京中杉金桥生物技术有限公司); 青链霉素合剂,BCA蛋白定量试剂盒,ECL超敏发光液 (北京普利莱基因技术有限公司); 蛋白分子量预染Marker (美国Fermentas公司); 三磷酸脱氧核苷 (dNTP) 混合液,RNase抑制剂,寡核苷酸引物Oligo(dT)16,逆转录酶 (M-MLV) (大连宝生物工程有限公司); P-gp引物,MRP2引物 (北京奥科鼎盛生物公司合成); SYBR Green PCR试剂 (美国ABI公司); PVDF膜 (孔径0.22 μm,美国Millipore公司)。其余试剂均为进口或国产分析纯试剂,实验用水均为双蒸水。
仪器设备安捷伦6410B三重四级杆液质联用仪配有1290超高压液相色谱仪 (美国安捷伦公司); ABI PRISM 7300 PCR仪 (美国Applied Biosystems公司); SpectraMax-190型全自动酶标仪 (美国Molecular Device公司); 凝胶成像分析系统 (日本富士公司)。
细胞培养HepG2细胞接种于DMEM高糖培养基中,内含10% 胎牛血清、100 u·mL−1青霉素、100 u·mL−1链霉素,在37 ℃下持续通入5% CO2和95% 空气培养。
细胞RNA干扰实验 siRNA的设计合成根据人源P-gp基因序列(Accession No. 000927.4),人源MRP2基因序列 (Acc No. 000392.4),设计如下siRNA序列 (表 1),由广州锐博生物有限公司合成。
|
|
Table 1 The sequences of MRP2 siRNA and P-gp siRNA |
转染前一天,将细胞接种于24孔板中,每孔加入不含抗生素的培养液500 μL; 第二天,细胞密度为50% 左右,开始进行siRNA转染; 取siRNA (10 μmol·L−1) 4 μL稀释到50 μL Opti-MEM培养液中,轻轻混匀; 取Lipofectamine 2000试剂1 μL稀释到50 μL Opti-MEM培养液中,轻轻混匀,室温孵育5 min; 将稀释好的siRNA与Lipofectamine 2000混合,室温孵育20 min; 孵育期间,将细胞培养液换成每孔400 μL Opti-MEM培养液; siRNA与Lipofectamine 2000混合物均匀慢慢滴加到每孔细胞中; 将细胞放置于37 ℃孵育箱4~6 h后换成含有抗生素及血清的DMEM培养液,24~72 h后鉴定干扰效果。
定量PCR转染不同时间后,收集细胞,用Trizol试剂盒提取总RNA,按M-MLV说明书进行逆转录。用SYBR Green PCR法进行P-gp和MRP2基因的 实时定量相对检测,引物序列见表 2。实时PCR反 应条件为95 ℃ 10 min后95 ℃ 15 s、60 ℃ 1 min,40个循环。由计算机记录荧光反应曲线及熔解曲线,并输出目的基因与内参基因的Ct值,以 (Ct目的基因 − Ctβ-actin)实验组 − (Ct目的基因 − Ctβ-actin)对照组 计算ΔΔCt,按照2−ΔΔCt法计算各HEK293T细胞转染组mRNA的相对表达量。
|
|
Table 2 Real-time PCR primers |
转染不同时间后,弃去培养基,PBS洗涤细胞3次,按细胞量每孔加入细胞裂解液30~50 μL,收集于1.5 mL EP管内,冰上继续孵 育30 min并且每隔5 min振荡30 s,后于4 ℃、12 000 r·min−1离心20 min,轻轻吸取含蛋白的上清液,采 用BCA蛋白定量试剂盒进行蛋白定量。取各组样品50 µg上样,用10% SDS-PAGE进行电泳。电泳结束后将蛋白转移至PVDF膜上,用3% BSA常温封闭 2 h,一抗(1∶500) 过夜,TBST洗膜3次,二抗 (1∶1 000) 孵育2 h,TBST洗膜后,采用ECL化学发光法进行观察,图像采用Image J软件进行灰度扫描。
甲氨蝶呤和罗丹明的转运性质评价细胞接种于24孔板中,每孔加入不含抗生素的培养液500 μL; 第二天,细胞密度为50% 左右,进行siRNA转染,同时设阴性对照组; 转染48 h后,各孔加入MRP2底 物甲氨蝶呤 (10 µmol·L−1) 或P-gp底物罗丹明 (10 µmol·L−1) 后,分别孵育5、15、30和60 min,弃去上清液,PBS冲洗细胞3次,加入0.5% Triton-100溶液100 μL裂解细胞,收集裂解液离心 (12 000 r·min−1),取上清液50 μL,加入沉淀剂 (甲醇−乙腈,1∶1) 100 μL,离心 (12 000 r·min−1),取上清液100 µL,LC-MS/MS检测。
LC-MS/MS检测甲氨蝶呤检测色谱条件: Thermo Fisher C18色谱柱 (2.1 mm × 50 mm,5 μm,Thermo Fisher USA); 流动相A为含有0.1% 甲酸和 5 mmol·L−1甲酸铵水溶液,B为含有0.1% 甲酸的乙腈。洗脱梯度程序为15% B (0 min),95% B (1.8 min),95% B (2 min),15% B (2.1 min),运行时间3.2 min,流速0.35 mL·min−1。内标为普萘洛尔 (100 ng·mL−1),质谱条件: 以ESI源正离子MRM方式检测,毛细 管温度300 ℃,毛细管电压 +4 000 V; 甲氨蝶呤离子对m/z 455.46/308.2,碰撞能40 V; 普萘洛尔离子对 m/z 260/116.2,碰撞能量40 V。罗丹明检测色谱条件: Thermo Fisher C18色谱柱 (2.1 mm × 50 mm,5 μm,Thermo Fisher USA); 流动相A为含有0.1% 甲酸和 5 mmol·L−1甲酸铵水溶液,B为含有0.1% 甲酸的乙腈。洗脱梯度程序为30% B (0 min),30% B (0.5 min),95% B (2.0 min),95% B (2.2 min),30% B (2.5 min),运行时间3.5 min,流速0.35 mL·min−1。内标为普萘洛尔(100 ng·mL−1); 质谱条件: 以ESI源正离子MRM方式检测,毛细管温度350 ℃,毛细管电压 +4 000 V; 罗丹明离子对m/z 345.2/285.1,碰撞能70 V; 普萘洛尔离子对m/z 260/116.2,碰撞能量14 V。
统计学处理实验结果计量资料以x± s表示,各不同时间点组间的差异比较采用SPSS软件进行单因素方差分析 (One-Way ANOVA) 方法,组间进行t检验,P < 0.05认为差异有显著性。
结果 1 siRNA有效片段的筛选
分别针对人源MRP2和P-gp基因序列各设计合成了3条siRNA,80 nmol·L−1 siRNA转染48 h后应 用实时定量PCR检测MRP2和P-gp的mRNA表达变化 (图 1),对其在HepG2细胞上的沉默效率进行了评价。MRP2 3条siRNA均对MRP2 mRNA有明显的抑制作用,抑制率分别为32%、53% 和68%; P-gp 3条siRNA中siRNA-2具有明显的抑制作用,抑制率为84%。因此,在下面的实验中,对MRP2 siRNA-3
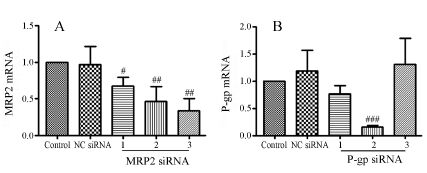
|
Figure 1 MRP2 (A) or P-gp (B) mRNA expression in HepG-2 cells treated with MRP2 or P-gp siRNA oligos. siRNA (80 nmol·L−1) was transferred into HepG-2 cells by using Lipofectamine 2000. The mRNA expression of MRP2 or P-gp was measured at 48 h after transfection by qRT-PCR. n = 3,x± s. #P < 0.05,##P < 0.01,###P < 0.001 vs NC-siRNA group和P-gp siRNA-2进行了进一步的评价。 |
选择不同浓度 (40、80和120 nmol·L−1) 的siRNA进行细胞转染48 h,用定量PCR检测MRP2和P-gp mRNA的表达变化 (图 2)。MRP2 siRNA-3和P-gp siRNA-2均能够浓度依赖性地抑制MRP2和P-gp mRNA的表达。MRP2 siRNA-3不同浓度对MRP2 mRNA的抑制率分别达到67%、69% 和72%; P-gp siRNA-2不同浓度对P-gp mRNA的抑制率分别为86%、88% 和89%。结合siRNA的有效性和毒性,选择80 nmol·L−1进行有效时间的筛选。
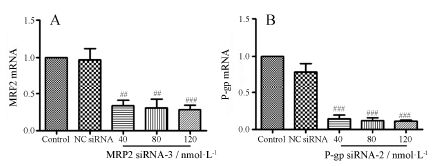
|
Figure 2 MRP2 (A) or P-gp (B) mRNA expression in HepG-2 cells treated with different concentration of MRP2 or P-gp siRNA oligos. siRNA (40,80 and 120 nmol·L−1) was transferred into HepG-2 cells by using Lipofectamine 2000. The mRNA expression of MRP2 or P-gp was measured at 48 h after transfection by RT- PCR. n = 3,x± s.& nbsp; ##P < 0.01,###P < 0.001 vs NC-siRNA group |
将80 nmol·L−1 siRNA转染细胞后分别在24、48和72 h应用定量PCR检测MRP2和P-gp mRNA的表达变化 (图 3)。MRP2 siRNA-3和P-gp siRNA-2均能时间依赖性地抑制MRP2和P-gp mRNA的表达。MRP2 siRNA-3作用不同时间对MRP2 mRNA的抑 制率分别达到32%、74% 和75%; P-gp siRNA-2作用不同时间对P-gp mRNA的抑制率分别为73%、89%和91%。2条siRNA在作用48和72 h后对mRNA的抑制效率相当。因此,选择48 h作为有效干扰时间。

|
Figure 3 MRP2 (A) or P-gp (B) mRNA expression in HepG-2 cells treated with MRP2 or P-gp siRNA oligos at different time points. siRNA (80 nmol·L−1) was transferred into HepG-2 cells by using Lipofectamine 2000. The mRNA expression of MRP2 or P-gp was measured at 24,48 or 72 h after transfection by RT- PCR. n = 3,x± s. ##P < 0.01,###P < 0.001 vs NC-siRNA group |
分别将80 nmol·L−1 MRP2 siRNA-3和P-gp siRNA-2转染48和72 h后,采用Western blot检测 蛋白表达变化 (图 4)。转染MRP2 siRNA后,MRP2蛋白表达明显减少,48和72 h的抑制率分别为62% 和80%,与RNA水平变化一致; 同时,MRP2 siRNA对BCRP和P-gp的蛋白表达没有明显的影响; 转染P-gp siRNA后,P-gp蛋白表达也明显降低,48和72 h的抑制率分别为70% 和72%,同时,P-gp siRNA对BCRP和MRP2的蛋白表达没有明显的影响。以上结果说明筛选出来的MRP2 siRNA-3和P-gp siRNA-2能够在mRNA和蛋白水平抑制MRP2和P-gp的表达,同时不影响其他转运蛋白的表达,具有较高的特异性,未发生脱靶效应。

|
Figure 4 MRP2 (A) or P-gp (B) protein expression in HepG-2 cells treated with MRP2 or P-gp siRNA oligos. siRNA (80 nmol·L−1) was transferred into HepG-2 cells by using Lipofectamine 2000. The protein expression of MRP2 or P-gp was measured at 48 h or 72 h after transfection by Western blot. n = 3,x± s. ##P < 0.01 vs NC-siRNA group |
建立RNA干扰的体外模型后,用此模型评价甲氨蝶呤和罗丹明在细胞中的转运性质 (图 5)。siRNA转染细胞48 h后,甲氨蝶呤 (10 µmol·L−1) 和罗丹明 (10 µmol·L−1) 分别孵育5、15、30和60 min,各组细胞内的药物含量均随孵育时间延长而增加; 与阴性对照组相比,MRP2 siRNA-3转染组细胞内的甲氨蝶呤浓度分别增加2.5、2.3、1.8和2.2倍; P-gp siRNA-2转染组细胞内的罗丹明浓度分别增加1.5、1.6、1.9和2.0倍。结果表明,应用序列特异的siRNA抑制MRP2或P-gp的表达后,能够减少相应底物甲氨蝶呤和罗丹明的外排,从细胞功能上证明了RNA干扰模型建立成功,可用于相关实验研究。

|
Figure 5 The functional evaluation of siRNA in HepG-2 cells treated with MRP2 (A) or P-gp (B) siRNA oligos. siRNA (80 nmol·L−1) was transferred into HepG-2 cells by using lipofectamine 2000. After 48 h,Rhodamine (10 µmol·L−1) or methotrexate (10 µmol·L−1) was incubated in different time points and the intracellular concentration was measured by LC-MS/MS. n = 3,x± s. #P < 0.05,##P < 0.01,###P < 0.001 vs NC-siRNA group |
目前,RNA干扰技术已经成为基因功能研究的首选方法。与传统的基因敲除方法相比,RNAi能通过可逆性抑制作用研究转运体的体内功能,或用于促进有利于药物临床应用的体内处置过程[18]; 再者,RNAi能特异性地抑制靶基因的表达,避免化学抑制剂因转运蛋白基因之间具有高度的同源性而导致的非特异性。因此,RNAi在药物体内处置和药物相互作用研究中具有良好的应用前景[19, 20]。在药物转运体的研究中,RNAi也已经用于逆转肿瘤耐药性方面的研究,但在转运体介导的药物体内处置过程中的作用研究较少[21, 22]。
本实验用体外合成的针对P-gp和MRP2的siRNA,并通过转染HepG2细胞进行了筛选评价。体外转染方法较多,但目前最常使用的是脂质体介导的转染。本实验使用Lipofectamine 2000转染试剂能够达到95% 以上的转染效率。由于不同siRNA的沉默效率不同,作者选择了沉默效率最高的MRP2 siRNA-3和P-gp siRNA-2分别在mRNA水平上进行了有效浓度和有效时间的筛选。根据筛选结果及siRNA的毒性,最终确定80 nmol·L−1 siRNA作用48 h。而对蛋白表达水平检测的结果表明siRNA对P-gp和MRP2蛋白的沉默效率分别达到62% 和70%。同时,发现P-gp siRNA对MRP2和BCRP的蛋白表达没有影响,MRP2 siRNA对P-gp和BCRP的蛋白表达也没有影响,说明siRNA产生的RNAi是特异的,没有产生脱靶效应。但是由于蛋白表达与基因功能存在不平行性,蛋白表达的改变不一定能引起功能的变化。因此,用RNA干扰的体外模型考察了罗丹明和甲氨蝶呤的细胞转运性质。罗丹明和甲氨蝶呤分别是P-gp和MRP2的底物,应用siRNA抑制P-gp或MRP2后,能够使罗丹明或甲氨蝶呤的细胞内浓度增加2倍左右,表明siRNA对转运体功能和蛋白表达的改变一致,可以用于转运体功能的研究。
目前,原代人肝细胞是评价药物转运体功能最好的体外模型,但是由于其成本较高并不能用于大规模的筛选评价。本研究应用人肝癌HepG2细胞系构建了针对人源P-gp和MRP2基因的RNA干扰模型,能够直接反映药物在人源细胞中的转运性质。同时,结合体外重组的表达系统,如MDCK-MDR1和MDCK- MRP2等稳定转染的细胞系,能够分别从转运体抑制和过表达两方面对药物的转运性质进行评价,更加准确地反映转运体在药物处置中的作用。
本研究表明,应用化学合成的siRNA成功地建立了RNA干扰的体外模型。此模型能够避免化学抑制剂的非特异性,应用简单方便,能够用于相关转运体底物和功能的研究。
| [1] | Kusuhara H, Sugiyama Y. Role of transporters in the tis-sue- selective distribution and elimination of drugs: transporters in the liver, small intestine, brain and kidney [J]. J Control Release, 2002, 78: 43-54. |
| [2] | Zhang J, Liu KX. Intestinal absorption and renal excretion mediated by transporters and the relationship with drug-drug interaction [J]. Acta Pharm Sin (药学学报), 2010, 45: 1089- 1094. |
| [3] | Giacomini KM, Huang SM, Tweedie DJ, et al. Membrane transporters in drug development [J]. Nat Rev Drug Discov, 2010, 9: 215-236. |
| [4] | Liu ZH, Liu KX. The transporters of intestinal tract and their study methods [J]. Acta Pharm Sin (药学学报), 2011, 46: 370-376. |
| [5] | Yu AM. Small interfering RNA in drug metabolism and transport [J]. Curr Drug Metab, 2007, 8: 700-708. |
| [6] | Hendrikx JJ, Lagas JS, Rosing H, et al. P-glycoprotein and cytochrome P450 3A act together in restricting the oral bioavailability of paclitaxel [J]. Int J Cancer, 2013, 132: 2439-2447. |
| [7] | Zhang L, Zhang Y, Huang SM. Scientific and regulatory perspectives on metabolizing enzyme-transporter interplay and its role in drug interactions: challenges in predicting drug interactions [J]. Mol Pharm, 2009, 6: 1766-1774. |
| [8] | Pal D, Mitra AK. MDR- and CYP3A4-mediated drug-herbal interactions [J]. Life Sci, 2006, 78: 2131-2145. |
| [9] | Pal D, Mitra AK. MDR- and CYP3A4-mediated drug-drug interactions [J]. J Neuroimmune Pharmacol, 2006, 1: 323- 339. |
| [10] | US FDA. Drug interaction studies - study design, data analysis, implications for dosing, and labeling recommendations [EB/OL]. [2015-06-02]. http://www.fda.gov/downloads/ drugs/guidancecomplianceregulatoryinformation/guidances/ ucm292362.pdf.2012. |
| [11] | Hoffmaster KA, Zamek-Gliszczynski MJ, Pollack GM, et al. Hepatobiliary disposition of the metabolically stable opioid peptide [D-Pen2, D-Pen5]-enkephalin (DPDPE): pharmacokinetic consequences of the interplay between multiple transport systems [J]. J Pharmacol Exp Ther, 2004, 311: 1203-1210. |
| [12] | Wu CY, Benet LZ. Disposition of tacrolimus in isolated perfused rat liver: influence of troleandomycin, cyclosporine, and GG918 [J]. Drug Metab Dispos, 2003, 31: 1292-1295. |
| [13] | Lares MR, Rossi JJ, Ouellet DL. RNAi and small interfer-ing RNAs in human disease therapeutic applications [J]. Trends Biotechnol, 2010, 28: 570-579. |
| [14] | Gatti L, Cossa G, Beretta GL, et al. Novel insights into targeting ATP-binding cassette transporters for antitumor therapy [J]. Curr Med Chem, 2011, 18: 4237-4249. |
| [15] | Fei LN, Wang QZ, Xu RA. Combinatorial RNAi and its application in cancer gene therapy [J]. Acta Pharm Sin (药学学报), 2012, 47: 573-579 |
| [16] | Abbasi M, Lavasanifar A, Uludag H. Recent attempts at RNAi-mediated P-glycoprotein downregulation for reversal of multidrug resistance in cancer [J]. Med Res Rev, 2013, 33: 33-53. |
| [17] | Kong LL, Li H. RNA interference technique and its application in drug transporter research [J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2014, 28: 939-946. |
| [18] | Chang HS, Lin CH, Chen YC, et al. Using siRNA tech-nique to generate transgenic animals with spatiotemporal and conditional gene knockdown [J]. Am J Pathol, 2004, 165: 1535-1541. |
| [19] | Aoki Y, Cioca DP, Oidaira H, et al. RNA interference may be more potent than antisense RNA in human cancer cell lines [J]. Clin Exp Pharmacol Physiol, 2003, 30: 96-102. |
| [20] | Hough SR, Wiederholt KA, Burrier AC, et al. Why RNAi makes sense [J]. Nat Biotechnol, 2003, 21: 731-732. |
| [21] | Huang C, Li M, Chen C, et al. Small interfering RNA ther-apy in cancer: mechanism, potential targets, and clinical applications [J]. Expert Opin Ther Targets, 2008, 12: 637-645. |
| [22] | Lee SH, Sinko PJ. siRNA-getting the message out [J]. Eur J Pharm Sci, 2006, 27: 401-410. |
 2015, Vol. 50
2015, Vol. 50


