世界卫生组织发布的统计资料显示,截止到2012年全世界约有抑郁症患者3.5亿人,接受有效治疗的患者比例不足50% (有些国家不足10%)。预计到2020年抑郁症发病率将仅次于心血管系统疾病,列居第二位[1]。为解决抑郁症治疗中存在的问题,仍需在抗抑郁新药发现、新机制探讨方面进行深入研究。
现有临床一线抗抑郁药物均是选择性5-羟色胺 (5-hydroxytryptamine,5-HT) 再摄取抑制剂 (selective serotonin reuptake inhibitor,SSRI) 类药物,属于第二代抗抑郁药物,作用机制单一。其通过阻断5-HT突触前膜再摄取,使神经细胞突触间隙的5-HT浓度增加,提高5-HT能神经传递而发挥药理作用,安全性高,副作用小。为了寻找更为高效的SSRI,本研究建立了SSRI高通量筛选模型。
首先对表达5-羟色胺转运体 (serotonin transporter,SERT) 的细胞(株) (如中枢神经系统的5-HT能神经元、血液循环系统中的血小板以及HeLa细 胞和Caco-2细胞等细胞株) 进行分析,其中HeLa和Caco-2细胞均不分泌5-HT。细胞株RBL-2H3 (大鼠嗜碱性白血病细胞株) 是1978年美国国立牙科研究所的免疫学实验室从Wistar大鼠发生癌变的嗜碱性细胞中分离和克隆出来的。1991年Hoffman等[2]从RBL-2H3中克隆了SERT,并证明细胞膜上的SERT可重摄取5-HT。文献[3]报道该细胞不仅可以分泌5-HT,细胞内含有5-HT囊泡,还能表达囊泡和细胞膜融合、释放的相关蛋白质[4, 5]。细胞株包含色氨酸羟化酶 (tryptophan hydroxylase,TPH) 及相关信使核糖核酸 (messenger RNA,mRNA),TPH可以将色氨酸转化 为5-羟色胺酸进一步转化成5-HT; 细胞内有5-HT代谢产物5-羟吲哚乙酸 (5-hydroxy indole acetic acid,5-HIAA)[6]。研究证实中枢神经系统5-HT能细胞表达腺苷受体A3 (A3AR),而RBL-2H3细胞不仅表达A3AR,与中枢神经系统的SERT神经元信号转导调节通路也相似[7]。有研究证明A3AR活化可以增加SERT的表达量,在抑郁症的治疗中起调节作用[8]。临床研究表明可以通过外周的淋巴细胞状态评价抗抑郁药物的治疗效果[9],故本研究中选用来源于外周淋巴细胞的RBL-2H3细胞进行实验。
现有SERT抑制剂的筛选方法主要是放射性同位素标记的检测方法,需要专门的实验室进行实验操作和样品检测,且操作人员需经过培训持证上岗; 试剂为放射性同位素,容易造成环境危害,使开展有关实验受到一定限制。文献[10]报道具有荧光特性的中枢神经系统毒剂DASPMI (4-Di-1-ASP),简称ASP+,可以与5-HT转运体结合进入细胞内,并发出红色荧光; 研究发现,当存在其他可与转运体结合的化合物同ASP+竞争时,进入细胞内的ASP+数量减少,红色荧光减弱,通过比较ASP+荧光强度的变化筛选作用于转运体的重摄取抑制剂。很多文献[10, 11]报道ASP+荧光测定转运体活性的方法与采用放射性配受体结合实验取得的结果相一致,而本研究以RBL-2H3细胞和该荧光物质为材料,建立一种用于筛选SERT抑制剂的非放射性高通量筛选体系,并在此基础上进行高通量筛选工作。
虚拟筛选的应用可以富集活性化合物,降低筛选成本,提高药物筛选的可行性,因此已成为新药发现的重要方法[12]。计算机辅助虚拟筛选模型分为基于受体的研究方法和基于配体的研究方法两种类型,基于受体的研究方法必须了解筛选受体的三维晶体结构,通过分子同源建模、分子对接研究筛选化合物[13]。根据文献[14]分析结果,本研究优先选择了基于配体的虚拟筛选方法,包括贝叶斯分类方法和分子指纹相似度筛选[15]。本研究建立基于配体的虚拟筛选模型,并对虚拟筛选的结果进行生物筛选验证和药效验证,比较两种方法的效率,为SERT抑制剂筛选提出了新的策略。
材料与方法 细胞株RBL-2H3购自武汉大学菌种保藏中心。以含15% 胎牛血清的MEMα完全培养基进行细胞培养,以生长状态良好的细胞进行各项实验。
试剂和仪器高效液相检测标准储备溶液: 精密称取5-HT和5-HIAA等各2 mg,分别用0.05 mol∙L−1高氯酸溶于10 mL量瓶中,得0.2 mg∙mL−1标准储备溶液; 内标溶液异丙肾上腺素 (IP) 用0.05 mol∙L−1高氯酸配置0.4 mg∙mL−1标准储备液,分装后置−80 ℃冰箱冻存。高效液相检测匀浆液的配制: 0.2 mmol∙L−1高氯酸液 (含IP 0.4 μg∙mL−1和EDTA 0.05 mmol∙L−1)。ASP+ (#D288) 和MEMα无核苷酸培养基购自Invitrogen公司。标准胎牛血清 (FBS) 购自Hyclone。二甲基亚砜 (DMSO),北京益利精细化工有限公司产品; 四甲基偶氮唑盐 (MTT) 购自Sigma公司。超净水仪和离心机 (美国Beckman Couler Inc.); OLYMPUS IX71倒置显微镜; Spectra Max M5酶标仪 (美国Molecular Devices公司)。
药物对RBL-2H3细胞上清液及细胞内5-HT水平的影响检测方法分别设置空白对照组、盐酸氟西汀组,时间从加药后0.5~4 h共6个时间点,各设3个复孔,取细胞上清液并收集细胞。
高效液相样品处理方法上述细胞上清液: 冰上收集以0.22 μm的微孔滤膜过滤上样; 细胞: 以细胞刮收集细胞,置于冰浴中于0.2 mL匀浆液中匀浆40 s,80% 超声能量,循环的参数设定为0.7,4 ℃、12 000 r∙min−1、30 min离心,取上清液检测,进样20 μL (可冷藏于 −20 ℃冰箱,7天内进样)。高效液相检测流动相的配制: 0.1 mol∙L−1 NaH2PO4水溶液含0.85 mmolͨ 9;L−1辛烯基琥珀酸酐 (OSA)、0.05 mmol∙L−1 EDTA·Na2和11% 甲醇,用浓磷酸调pH至3.25,再用0.22 μm微孔滤膜抽滤脱气。细管径柱: cell pake C18 (150 mm × 2 mm ID,3 μm) 色谱柱。工作电压 +0.4 V,柱温35 ℃,流速0.6 mL∙min−1。
药物处理和荧光负载方法密度为每毫升3×105个细胞悬液按照每孔0.1 mL,加入96孔板,待细胞贴壁生长良好时撤去血清,以D-hanks液洗两遍,每孔加入无血清培养基0.1 mL,经4 h后每孔加入供试品10 μL,37 ℃孵育1.5~3 h后,于激发波长475 nm和发射波长605 nm处读数,作为基础值; 然后避光每孔加ASP+ 染料10 μL (终浓度100 μmol∙L−1),震荡混匀后,在37 ℃孵育1 h,洗板前在激发波长475 nm,发射波长605 nm处读数,作为参考值,以D-hanks液洗两遍,每孔加入D-hanks液0.1 mL,在激发波长475 nm,发射波长605 nm处读数,对测定的ASP+ 染料的荧光强度结果进行统计。
高通量筛选模型评价方法按照如下公式计算:
S/B (信号本底比) (>10可用):
| \[\text{S/B}={{M}_{信号}}/{{M}_{本底}}\] | (1) |
S/N (信噪比):
| \[\text{S/N}=({{M}_{信号}}-{{M}_{本底}})/{{(\text{SD}_{信号}^{2}+\text{SD}_{本底}^{2})}^{1/2}}\] | (2) |
Z'因子 (>0.4可用):
| \[Z\prime =1-3\times (\text{S}{{\text{D}}_{信号}}+\text{S}{{\text{D}}_{本底}})/|{{M}_{信号}}-{{M}_{本底}}|\] | (3) |
M: 检测荧光强度; SD: 数据标准差。
SERT抑制剂筛选抑制率计算方法样品抑制率在40%~70% 之间为阳性。
| \[荧光强度抑制率=(模型对照组荧光强度平均值-样品组荧光强度平均值) \\ /(模型对照组荧光强度平均值-空白对照组荧光强度平均值)\] | (4) |
首先构建训练集与测试集数据库以及进行虚筛的样品库,将生物筛选中活性化合物的化学结构纳入建立的虚拟筛选模型的训练 集,前期筛选阴性结果化合物纳入绝对无效训练集,剔除包含错误化学键的分子、去除抗衡离子和溶剂 分子以及对两数据库进行数据库内和数据库间去重等; 对Binding DB数据库上已知的SERT抑制剂和本筛选中心运用高通量筛选确认的Decoy数据库 (非SERT抑制剂) 进行训练,从而使计算机能够自动识别并区分SERT抑制剂和非SERT抑制剂。第二步,采用贝叶斯分类方法,构建基于分子参数、分子指纹以及分子参数和分子指纹相结合的分类模型。本研究中所选用的分子性质参数 (MP) 均为二维描述符,描述符的选择为Discovery Studio中贝叶斯模型构建模块默认描述符,采用16个不同的分子指纹。利用分子性质描述符与不同分子指纹描述符组合构建多个不同组合贝叶斯模型,综合考虑训练集与测试集ROC打分以及测试集II中真阳性化合物的数量来评价模型的优劣。评价模型主要通过参数包括真阳性 (TP)、真阴性 (TN)、假阳性 (FP)、假阴性 (FN)、灵敏性 (SE)、特异性 (SP)、SERT抑制剂的预测精度 (Q+)、SERT非抑制剂的预测精度 (Q−) 和马修斯相关系数 (C) 进行衡量。
分子指纹相似度筛选结合Discovery Studio软件包中运用分子指纹寻找相似分子的方法与Tanimoto系数定义的相似度度量方法,使用不同的分子指纹描述符 (FCFP_2、FCFP_4、FCFP_6、ECFP_2、ECFP_4、ECFP_6、MDLpublickeys、FCFC_2、FCFC_4、FCFC_6、ECFC_2),依次对样品库中21 735个化合物 (其中包括7 547个已进行过高通量初筛的化合物) 进行虚拟筛选,然后评价不同分子指纹描述符筛选结果的优劣。
统计学分析采用Graphpad Prism软件,结果进行t检验,P < 0.05具有显著性差异。
结果 1 RBL-2H3细胞表达SERT和分泌5-HT的验证由图 1A可见,Western blotting检测到在RBL-2H3细胞膜和细胞浆中均有SERT表达。由图 1B和C可见,高效液相色谱分析进一步确证该细胞可分泌5-HT,且还检测到微量的代谢产物5-HIAA。

|
Figure 1 5-HT secretion and serotonin transporter (SERT) expression in RBL-2H3 cells. A: SERT expression of RBL-2H3 cell in cytoplasm and membrane; B: 5-HT secretion in supernatant; C: 5-HT secretion in cytoplasm. 5-HT: 5-Hydroxytryptamine; 5-HIAA: 5-Hydroxy indole acetic acid; HVA: Homovanillic acid (internal standard) |
盐酸氟西汀是第一个SSRI类药物,临床应用抗抑郁作用明确,作为本实验阳性对照药物。由图 2A结果可见,在4 h内空白对照组细胞上清中5-HT的水平 (ng∙mL−1) 维持不变,而加入盐酸氟西汀处理,可见随着时间的延长细胞上清中5-HT水平不断升高,其中1.5~4 h细胞上清中5-HT的升高水平与空白对照组比较具有统计学差异。盐酸氟西汀引起细胞上清5-HT水平升高的同时,细胞内5-HT水平降低,其中4 h时与空白对照组比较差异具有显著性 (图 2B)。将细胞上清和细胞内产生的5-HT合并计算,其总水平基本保持一致 (图 2C)。说明在短时间内盐酸氟西汀并不影响5-HT产生总量,可能通过对SERT抑制或者促进5-HT释放产生影响。
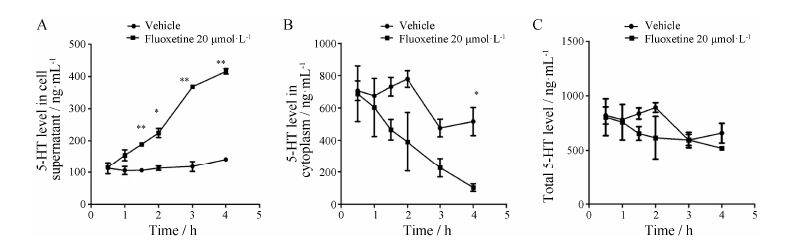
|
Figure 2 The effect of fluoxetine on 5-HT level. 5-HT level assay of fluoxetine hydrochloride at different time points in RBL-2H3 cells. Cells (1.0 × 106/24 well) were treated with fluoxetine at the indicated concentrations for 0−4 h before 5-HT level assay. P < 0.05,**P < 0.01 compared with vehicle. A: In cell supernatant; B: In the cytoplasm; C: In total cells |
预实验分别采用了多种孵育时间进行研究,最终确定孵育时间1 h可以达到最佳的抑制效果,此时阳性药物盐酸氟西汀的抑制率最高。
为了考察RBL-2H3细胞对ASP+的结合和摄取能力,采用12.5、25、50、100、200、400和800 μmol∙L−1 ASP+孵育浓度,分别记录加入和不加入盐酸氟西汀 (20 μmol∙L−1) 组孵育1 h后,RBL-2H3细胞内ASP+的荧光强度 (FI) 值,做出特异性结合 (SB) 和非特异性结合 (NSB) 曲线。由图 3A可见,该化合物存在明显的非特异性结合。
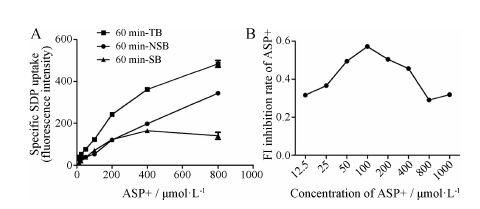
|
Figure 3 Inhibitory effect of fluoxetine hydrochloride at different concentrations on ASP+ in RBL-2H3 cells. Cells (3.5 × 105/96 well) were treated with fluoxetine at the indicated concentrations for 1 h before transport assay. A: Saturation curve of ASP+ uptake in RBL-2H3 cells; B: The inhibition rate of different concentration of ASP+ on fluoxetine. TB = NSB + SB; TB: Total banding; NSB: Nonspecific banding; SB: Specific banding |
在不同浓度ASP+ 作用1 h,观察盐酸氟西汀20 μmol∙L−1对ASP+ 的最大荧光抑制率。由图 3B结果可见,盐酸氟西汀在ASP+ 浓度100 μmol∙L−1时达到最大的抑制率。随着ASP+ 浓度的增加,盐酸氟西汀对ASP+ 的抑制率降低,而前期通过高效液相电化学检测得知,盐酸氟西汀确实可以抑制转运体的重摄取,使细胞上清5-HT含量增加。本实验中盐酸氟西汀对浓度超过200 μmol∙L−1的ASP+ 抑制率降低,分析原因是由于RBL-2H3与ASP+ 存在非特异性结合,当ASP+ 的特异性结合达到饱和后,非特异性结合的ASP+ 越 多,直接影响了SSRIs对ASP+ 抑制的效果。结合图 3A结果,证明ASP+ 剂量达到100 μmol∙L−1时,盐酸氟西汀对其抑制率达到最大,在开展筛选研究时选择这一剂量。
4 SERT抑制剂的初筛及复筛结果按照上述筛选条件,经过计算得到的筛选参数为: 信号本底比 (S/B): 10.13; 信噪比 (S/N): 6.37; Z'因子: 0.52,满足高通量筛选的实验要求。
随机选择了筛选中心样品库的10 802个样品 (J21508~J21532、J24925~J24966、J25201~J35360、J36609~J36636、J38500~J38932、J39143~39150、WS070508~WS070523、WS070134~WS070137、070139、070141、070142) 进行筛选,由图 4A可见,在筛选的10 802个化合物中,平均抑制率在0~5% 附近,抑制率在40%~70% 之间的样品比例较低,初筛时约占总数的2%~3%。在频数分布图 (图 4B) 上可见部分样品抑制率为100%,在筛选过程中发现样品表现为毒性反应,细胞数减少或者完全死亡。
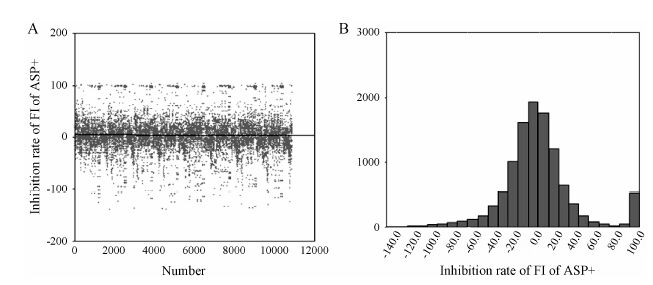
|
Figure 4 A: Scatter diagram showing frequency of screening sample inhibition rate; B: A histogram showing a normal distribution on screening sample inhibition rate |
由于存在ASP+ 与RBL-2H3细胞的非特异性结合,实验中阳性药盐酸氟西汀最大给药剂量抑制率一般在60% 左右,实验中抑制率过高甚至达到100% 样品,多是由于细胞毒性引起的假阳性结果,抑制率达到40% 左右时与空白对照组比较具有统计学差异,所以实验制定抑制率在40%~70% 的样品为阳性。由筛选实验的散点图和频数分布图可见,筛选结果分布符合高通量筛选实验结果分布规律。
5 计算机辅助高通量筛选 (HTVS)贝叶斯分类模型预测样品库: 运用基于MP和EPFP_4所构建的贝叶斯模型 (C值为0.859) 预测样品库中14 188个化合物,设置EstPgood值为0.85,得到469个化合物。分子指纹相似度筛选预测样品库: 最终采用分子指纹描述符ECFC_2、选取相似度阀值为0.9,得到161个化合物。将以上两部分筛选结果汇集,共得到616个化合物。
6 虚拟筛选结果结合生物学筛选方法结果通过将生物样品初筛阳性结果的化合物结构纳入到虚拟筛选实验的训练集,研究建立了虚拟筛选的模型,并通过新一轮的筛选在更大样品库中找到了较少的目标样品,对经过以上计算机辅助虚拟筛选得到的全部616个样品进行取样,采用已经建立的RBL-2H3细胞筛选模型进行活性筛选,经过初筛和复筛,最终找到了约30个具有SERT抑制作用的化合物。
单纯采用生物筛选的方法得到阳性样品的比例约为2%~3%,而先通过虚拟高通量筛选的方法找到目标化合物,之后将目标化合物采用生物筛选的方法进行验证,筛选阳性率明显提高到5%,同时大量节约了开展生物筛选实验所需的经济成本。
讨论传统的5-HT筛选方法包括制备悬浮的富含血小板血浆,进行机制研究实验; 通过分子生物学方法转染表达SERT的细胞株开展大规模的药物筛选,主要研究手段都是使用放射性同位素检测的方法,生物污染现象严重,并且对检测环境要求高。本次研究引入的RBL-2H3细胞在表达和分泌特性非常接近中枢神经系统的5-HT能神经元,其细胞可分泌5-HT,细胞膜表达SERT和A3AR,细胞内的信号转导通路也接近5-HT能神经元,细胞贴壁生长,检测方便。检测方法引入了荧光底物检测,使用酶标仪等即可检测,方便快捷,通过文献检索和前期验证,其准确有效性与放射性检测方法一致,同时杜绝了放射性实验的环境生物危害。
随着化合物库规模的不断扩大,简单的生物筛选模式耗资巨大,效率降低,为了能够建立与超大样本库相匹配的活性化合物筛选模式,本研究探讨了生物筛选结合虚拟筛选的模式,并初步证明通过计算机辅助筛选后,筛选得到阳性化合物的比例提高,有利于在超大量样本的高通量筛选时,优先去除绝对无效样品,减少筛选工作量,降低筛选成本,提高筛选阳性率,成为一种可靠的高通量筛选辅助模式。
总之,本文对于抗抑郁药物的筛选模式进行了有益的探讨,建立了快速筛选抗抑郁药物的模型,提出了建立生物和虚拟筛选相结合的筛选模式,为找到起效快、效果好、作用持久的抗抑郁药物提供了新策略。抗抑郁药物的快速筛选工作将随着化合物的 不断增加继续下去,力争找到更多、更好、具有抗抑郁作用的药物。
| [1] | Gao S, Li R. Research progress of depression animal model and the evaluation standard[J]. J Tianjin Univ Tradit Chin Med (天津中医药大学学报), 2012, 31:57-60. |
| [2] | Hoffman BJ, Mezey E, Brownstein MJ. Cloning of a serotonin transporter affected by antidepressants[J]. Science, 1991, 254:579-580. |
| [3] | Passante E, Frankish N. The RBL-2H3 cell line:its provenance and suitability as a model for the mast cell[J]. Inflamm Res, 2009, 58:737-745. |
| [4] | Harville BA, Dreyfus LA. Release of serotonin from RBL-2H3 cells by the Escherichia coli peptide toxin STb[J]. Peptides, 1996, 17:363-366. |
| [5] | Williams RM, Shear JB, Zipfel WR, et al. Mucosal mast cell secretion processes imaged using three-photon microscopy of 5-hydroxytryptamine autofluorescence[J]. Biophys J, 1999, 76:1835-1846. |
| [6] | Baik SY, Jung KH, Choi MR, et al. Fluoxetine-induced upregulation of 14-3-3zeta and tryptophan hydroxylase levels in RBL-2H3 cells[J]. Neurosci Lett, 2005, 374:53-57. |
| [7] | Zhu CB, Steiner JA, Munn JL, et al. Rapid stimulation of presynaptic serotonin transport by A3 adenosine receptors[J]. J Pharmacol Exp Ther, 2007, 322:332-340. |
| [8] | Zhu CB, Lindler KM, Campbell NG, et al. Colocalization and regulated physical association of presynaptic serotonin transporters with A3 adenosine receptors[J]. Mol Pharmacol, 2011, 80:458-465. |
| [9] | Rivera-Baltanas T, Olivares JM, Calado-Otero M, et al. Serotonin transporter clustering in blood lymphocytes as a putative biomarker of therapeutic efficacy in major depressive disorder[J]. J Affect Disord, 2012, 137:46-55. |
| [10] | Jørgensen S, Nielsen EØ, Peters D, et al. Validation of a fluorescence-based high-throughput assay for the measurement of neurotransmitter transporter uptake activity[J]. J Neurosci Methods, 2008, 169:168-176. |
| [11] | Oz M, Libby T, Kivell B, et al. Real-time, spatially resolved analysis of serotonin transporter activity and regulation using the fluorescent substrate, ASP+[J]. J Neurochem, 2010, 114:1019-1029. |
| [12] | Liu AL, Du GH. Research progress of virtual screening aided drug discovery[J]. Acta Pharm Sin (药学学报), 2009, 44:566-570. |
| [13] | Cao R, Li W, Sun HZ, et al. Computational chemistry in structure-based drug design[J]. Acta Pharm Sin (药学学报), 2013, 48:1041-1052. |
| [14] | Li HL, Shen JH, Luo XM, et al. Virtual screening and new drug discovery[J]. Chin Bull Life Sci (生命科学), 2005, 17:125-131. |
| [15] | Tang YH, Lin KJ, You QD. Application of 2D molecular fingerprints based on molecular similarity in visual screening[J]. J China Pharm Univ (中国药科大学学报), 2009, 40:178-184. |
 2015, Vol. 50
2015, Vol. 50


