2. 中国药科大学药学院, 江苏 南京 210009
2. China Pharmaceutical University, Nanjing 210009, China
血栓性疾病的致残率和病死率居所有疾病之首,给社会和人民生活带来极大的危害。在众多抗血栓药物中,蛇毒提取物是重要的一类药物。蛇毒作为天然的药用资源,其主要成分为多种活性蛋白类或多肽类的酶,蛇毒中毒性物质的研究为治疗性药物的发现提供了新的思路。目前,从蛇毒的有效成分中已经开发出多种治疗心脑血管疾病的药物,它们的主要药理作用包括抗凝血作用、溶栓和抑制血栓形成等。蛇毒三肽 (pENW,焦谷氨酸−天冬酰胺−色氨酸,图 1) 最初是从尖吻蝮蛇的蛇毒中提取发现,目前已能够采用化学方法进行人工合成。在前期研究[1, 2, 3, 4]中,作者通过对多个结构类似的化合物进行盲法筛选,实验结果显示,pENW能够有效抑制多种动物血栓模型的形成,同时pENW可减轻血栓形成部位的血管内皮细胞的损伤。作者也对pENW抑制血栓形成的机制进行了深入研究[5],结果显示pENW有效抑制多种诱导剂诱导的血小板聚集,因此pENW抑制血栓形成的靶点可能为血小板。本文继续研究pENW对血小板黏附的抑制作用。

|
Figure 1 The chemical structure of pENW (pGlu-Asn-Trp). There are three chiral centers (*),all of which are left-handed |
血小板与非血小板表面的黏着称为血小板黏附作用。生理情况下它是血管受损后参与正常止血反 应的第一步,病理状况下则是动脉血栓形成的起始因素之一,在动脉血栓形成过程中起重要作用。当血管受损或受刺激时,血小板膜糖蛋白Ib-IX-V复合体 (GPIb-IX-V) 与血小板膜糖蛋白IIb/IIIa (GPIIb/IIIa) 是介导血小板黏附的主要受体。GPIb-IX-V经配体血管性血友病因子(von Willebrand factor,vWF) 的介导与血管内皮暴露的胶原结合,而GPIIb/IIIa与配体纤维蛋白原 (fibrinogen,Fg) 结合是血小板血栓形成的最终通路。血小板血栓形成后,血小板收缩蛋白即肌动蛋白和肌球蛋白等的“抛锚”作用,使血小板伸出伪足,可使凝血块中的纤维蛋白网发生收缩,网眼中的血清外溢,使凝血块更为坚固,止血更加完善即血小板血块收缩功能 (platelet clot retraction function)。血小板参与血液凝固的过程并在血栓形成的启动和扩大中起着十分重要的作用。本文将探讨pENW对凝血酶诱导血小板黏附的影响及其对血小板内信号通路的调节。验证pENW抑制血小板黏附过程中信号分子和机制,以揭示pENW作为新型抗血小板药的可能性。
材料与方法 实验动物健康12~14周龄SD大鼠,250~ 280 g; 浙江省实验动物中心提供,许可证号: SCXK (浙) 2008-0033。
实验仪器DYY-7C型电泳仪电源、DYCZ-24系列双垂直蛋白电泳仪 (北京六一仪器厂); Model 680型酶标仪 (BIO-RAD公司); CKX31型倒置相差显微镜 (奥林巴斯); RF-5000型双波长紫外荧光分光光度计 (日本岛津公司)。
主要试剂和药品pENW (纯度: 99.95%,中国药科大学生命科学院与技术学院); 凝血酶 (thrombin)、纤维蛋白原、对硝基苯磷酸二钠 (pNPP)、3-异丁基-1-甲基黄嘌呤 (IBMX)、吲哚美辛 (Sigma公司); Fura-2/ AM (Dojindo Laboratories); 牛血清蛋白 (BSA)、乙二醇-双-(2-氨基乙醚)四乙酸 (EGTA)、DCFH-DA、TritonX-100、硝普钠 (SNP) (碧云天生物技术研究所); 溴化-(4,5-二甲-2-噻唑基-)-2,5-二苯基四氮唑 (MTT) (Fluka试剂公司); LY294002 (Invivogen公司); cAMP、cGMP、TXB2酶联免疫检测试剂盒 (R&D公司); 一抗p-Akt (Ser473)、Akt (Cell Signaling Technology公司); 一抗p-ERK1/2、ERK1/2、p-p38、p38、β-actin、GAPDH、辣根过氧化物酶标记山羊抗兔IgG(H+L)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L) (MultiSciences Biotech 公司)。Hepes-Tyrode’s缓冲液 (mmol·L−1): HEPES 10、NaCl 137、KCl 2.68、NaH2PO4 0.42、MgCl2 1.7、NaHCO3 11.9和葡萄糖5,pH 7.4。其他常用试剂均为市售分析纯。
大鼠血小板分离方法及血小板悬液的制备[6]SD大鼠,雌雄不限,麻醉分离右侧颈动脉插管取血 (3.8% 枸橼酸钠,1∶9抗凝)。800 r·min−1离心10 min,取上层乳白色混悬液即为富血小板血浆 (platelet-rich plasma,PRP),剩余部分以3 000 r·min−1离心10 min,取血细胞上层部分即为贫血小板血浆 (platelet-poor plasma,PPP)。PRP以3 000 r·min−1离心5 min,弃上清液,得血小板沉淀,用无Ca2+的Hepes-Tyrode’s缓冲液清洗1次后,3 000 r·min−1离心5 min,弃上清液,用无Ca2+ 的Hepes-Tyrode’s缓冲液重悬血小板,得血小板悬液。
MTT法测定pENW对大鼠血小板活力的影响[7]在96孔板内加入50 μL血小板悬液 (细胞数2×108个) 与不同浓度的pENW (116.5~466.2 μmol·L−1) 于37 ℃共孵育1 h,空白对照组给予等体积的Hepes- Tyrode’s缓冲液。然后每孔加入5 mg·mL−1 MTT 10 μL于37 ℃共孵育3 h。最后每孔加入终止液 100 μL (10% SDS,HCl 10 mmol·L−1) 于37 ℃共孵 育1 h后,使用酶标仪于540 nm读取各测试孔的吸 光度值,以此作为血小板的活力。
pENW对血小板与纤维蛋白原黏附的抑制作 用[8, 9]在96孔细胞培养板内加入纤维蛋白原溶液 (2 mg·mL−1) 100 μL于4 ℃包被过夜。在黏附实验开始前,仔细吸出纤维蛋白原溶液,每孔使用Hepes- Tyrode’s缓冲液清洗两遍,然后每孔加入含1% BSA的缓冲液100 μL于37 ℃孵育1 h,以消除非特异性 黏附配体。血小板悬液与不同浓度的pENW (116.5~466.2 μmol·L−1) 于37 ℃孵育5、15和60 min,各对照组加入等体积的Hepes-Tyrode’s缓冲液孵育至相应时间; 孵育结束后,在已包被好的96孔细胞培养板中分别加入50 μL(细胞数2×108个) 血小板悬液,于37 ℃黏附反应15 min; 凝血酶诱导黏附实验的终浓度为0.2 U·mL−1。黏附反应结束后,每孔加入Hepes- Tyrode’s缓冲液200 μL清洗未黏附的血小板。黏附血小板的定量法为酸性磷酸酶法。在实验中,空白 血小板悬液50 μL与酸性磷酸酶底物溶液140 μL反应显色后作为总血小板计数,Hepes-Tyrode’s缓冲液50 μL与酸性磷酸酶底物溶液140 μL反应显色后作为空白值。反应产物使用酶标仪于405 nm读取吸光度。血小板黏附率计算公式为 (给药组 − 空白值) / (总血小板 − 空白值) × 100%。所用实验重复3次。
双波长荧光分光光度计法测定pENW对凝血酶诱导大鼠血小板胞浆[Ca2+]i作用[10]血小板悬液与Fura-2/AM混匀,使Fura-2/AM在血小板悬液中的终浓度为5 μmol·L−1,37 ℃避光孵育1 h,立即离心,弃上清液,沉淀用含0.2% BSA的Hepes-Tyrode’s缓冲液清洗1次后,再用无Ca2+-Hepes-Tyrode’s缓冲液重新悬浮,以充分去除未进入细胞内的Fura-2/AM,调整血小板为300~400个/mL待测。取负载后的血小板悬液各1 mL,分别加入生理盐水、不同浓度的pENW (116.5~466.2 μmol·L−1),37 ℃温育5 min。首先测定未加诱导剂时的荧光强度即静息荧光强度; 然后向各管中加入诱导剂凝血酶 (终浓度0.2 U·mL−1) 和CaCl2 (终浓度1 mmol·L−1),37 ℃温育3 min后,分别测定 各管的诱导荧光强度。各管中再加入1% TritonX-100,分别测定各管最大荧光强度 (Rmax)。最后在各管中加入EGTA (5 mmol·L−1),分别测定各管最小荧光强度 (Rmin)。根据Grykiewicz等比值法公式计算出血小板内[Ca2+]i浓度。
pENW对纤维蛋白凝块收缩影响的测定[11]血小板悬液各1 mL,分别加入生理盐水、阳性药SNP (50 μmol·L−1)、pENW (116.5~466.2 μmol·L−1),37 ℃温育5 min。各组与等体积的纤维蛋白原溶液 (250 μg·mL−1) 混合后加入到玻璃试管中静置,各组加入凝血酶 (0.2 U·mL−1) 诱导生成纤维蛋白凝块。纤维蛋白凝块收缩实验在37 ℃静置4 h,并分别在0、0.5、1、2、3和4 h拍摄照片记录。结果使用图像软件处理,纤维蛋白凝块收缩率=[1−(纤维蛋白凝块面积/总面积)]×100%。
流式细胞术测定血小板内活性氧族 (ROS) 的含量血小板悬液与DCFH-DA混匀,使DCFH-DA 在血小板悬液中的终浓度为10 μmol·L−1,37 ℃避光孵育20 min,每隔3~5 min颠倒混匀,使探针和血 小板充分接触。立即离心,弃上清液,沉淀用含0.2% BSA的Hepes-Tyrode’s缓冲液清洗2次后,再用无Ca2+-Hepes-Tyrode’s缓冲液重新悬浮,以充分去除 未进入细胞内的DCFH-DA。负载后的血小板悬液分别与Hepes-Tyrode’s缓冲液、pENW (116.5~466.2 μmol·L−1)、阳性对照H2O2 (8 mmol·L−1) 于37 ℃孵育1 h后,流式细胞仪检测血小板内活性氧族ROS的含量,结果以平均荧光强度表示。
pENW对血小板内环磷酸鸟苷 (cGMP)、环磷酸腺苷 (cAMP) 含量的影响[12]血小板悬液在37 ℃预温3 min后,与cAMP和cGMP磷酸二酯酶的非特异性抑制剂3-异丁基-1-甲基黄嘌呤IBMX (1 mmol·L−1) 37 ℃孵育15 min。之后血小板与不同浓度的pENW (233.1~466.2 μmol·L−1) 孵育5 min,空白对照组加入等体积的Hepes-Tyrode’s缓冲液。凝血酶 (0.2 U·mL−1) 诱导刺激血小板10 min。各组加入EDTA (10 mmol·L−1) 终止反应后,在沸水中煮3 min。样品使用冷冻离心机12 000 r·min−1于4 ℃离心10 min。样品上清液用cGMP、cAMP的ELISA试剂盒检测。试剂盒检测方法参考试剂盒说明书。
pENW对凝血酶诱导的血小板内血栓烷A2 (TXA2) 含量的影响[13]血小板悬液与不同浓度的pENW (116.5~466.2 μmol·L−1) 37 ℃孵育5 min,空白对照组加入等体积的Hepes-Tyrode’s缓冲液。凝血酶 (0.2 U·mL−1) 诱导刺激血小板10 min。各组加入EDTA (2 mmol·L−1) 和吲哚美辛 (50 mmol·L−1) 终止反应。样品使用冷冻离心机12 000 r·min−1于4 ℃离心10 min,上清液用TXB2 ELISA试剂盒检测。试剂盒检测方法参考试剂盒说明书。
pENW抑制血小板黏附的信号通路研究血小板悬液分别与生理盐水、阳性药或不同浓度的pENW于37 ℃孵育5 min,加入激活剂凝血酶,5 min后每 管加入RIPA裂解液100 μL; 将EP管置于冰上裂解 30 min,每10 min吹打或震荡一次; 样品使用冷冻离心机12 000 r·min−1于4 ℃离心20 min; 吸取上清液,加入2×上样缓冲液,样品在沸水中变性5 min,冷却后于 −70 ℃保存。取等量蛋白上样,分离后进行湿法转膜。 PVDF膜使用封闭液 (5% 脱脂奶粉TBST溶液) 室温下封闭1 h,一抗、4 ℃孵育过夜。二抗室温下孵育1 h。用凝胶成像系统进行分析,以光密度值代表相应蛋白质的表达量,将待测蛋白质表达量与内参照表达量进行对比,表示蛋白质的相对表达水平。
数据处理及统计分析 数据以Mean ± SEM表示,进行单因素方差分析 (One way-ANOVA)。若组间有差异,则各组与对照组之间用双尾的Dunnett t检验进行比较,P < 0.05认为差异具有显著性。
结果 1 pENW对血小板内活力的影响MTT法检测pENW与血小板共孵育1 h后,与空白对照组相比,结果无显著性差异,说明pENW对血小板无细胞毒作用 (表 1)。
|
|
Table 1 Effect of snake venom tripeptide (pENW) on platelets viability by MTT assay. Results represent as the mean ± SEM (n = 5) |
实验结果显示,静息血小板与纤维蛋白原孵育15 min后,可检测到血小板与纤维蛋白原的自发黏附作用,黏附率为 (6.83 ± 0.81) %。当凝血酶诱导刺激后,血小板与纤维蛋白原的黏附作用增加,黏附率为 (17.27 ± 1.75) %,与静息血小板相比有显著性差异 (P < 0.01)。
pENW与血小板孵育5 min后,pENW高剂量 (466.2 μmol·L−1) 与中剂量 (233.1 μmol·L−1) 能够有效抑制血小板与纤维蛋白原的自发性黏附作用,其黏附率分别为 (3.50 ± 0.73) % 和(3.24 ± 0.27) %,与静息血小板对照组相比,黏附抑制率分别为52.58% 和48.76%,具有显著性差异 (P < 0.05)。凝血酶诱导刺激后,pENW的高、中、低剂量 (116.5μmol·L−1) 均能极显著地抑制血小板与纤维蛋白原的黏附 (P < 0.01),与诱导对照组相比,pENW (116.5、233.1、466.2 μmol·L−1) 孵育后血小板的黏附率分别下降至 (3.66 ± 0.82) %、(4.51 ± 0.66) % 和(5.30 ± 0.67) %,黏附抑制率分别为78.82%、73.89% 和69.28% (图 2A)。

|
Figure 2 Inhibitory effects of pENW on platelet adhesion to fibrinogen. Platelets in the absence or presence of thrombin,were incubated with pENW (116.5−466.2 μmol·L−1) for 5 min (A),15 min (B) or 60 min (C) before platelet adhesion measurement. Results represent the mean ± SEM of three separate experiments,each performed in triplicate. P < 0.05,**P < 0.01 vs control group with thrombin; #P < 0.05 vs control group without thrombin |
pENW与血小板孵育15 min后,pENW高剂量 (466.2 μmol·L−1) 能显著抑制血小板与纤维蛋白原的自发性黏附作用,其黏附率为 (3.40 ± 0.47) %,与静息血小板对照组相比,黏附抑制率为50.25%,具有显著性差异 (P < 0.05)。当凝血酶诱导刺激后,pENW的高、中、低剂量均能显著抑制血小板与纤维蛋白原的黏附 (P < 0.05,P < 0.01),与诱导对照组相比,pENW (116.5、233.1、466.2 μmol·L−1) 孵育后血小板的黏附率分别为 (4.44 ± 0.60) %、(6.82 ± 2.47) % 和 (7.45 ± 1.68) %,黏附抑制率分别为74.26%、60.49% 和56.84% (图 2B)。
pENW与血小板孵育60 min后,与静息对照组相比,pENW能够抑制血小板与纤维蛋白原的黏附作用,但无统计学差异。当凝血酶诱导刺激后,pENW的高、中、低剂量均能显著抑制血小板与纤维蛋白原的黏附 (P < 0.05),与诱导对照组相比pENW (116.5、233.1、466.2 μmol·L−1) 孵育后血小板的黏附率分别为 (10.16 ± 1.71) %、(10.45 ± 1.61) % 和 (10.92 ± 2.13) %,黏附抑制率分别为41.18%、39.47% 和36.76% (图 2C)。
黏附实验结果表明,pENW有效抑制血小板的自发性黏附作用及凝血酶诱导的黏附作用,pENW抑制血小板的黏附作用呈现剂量依赖性,但并没有时间依赖性,且pENW对凝血酶诱导血小板与纤维蛋白原黏附的抑制作用更为显著。
3 pENW对血小板内反应氧族 (ROS) 的作用pENW (116.5~466.2 μmol·L−1) 与血小板孵育60 min后,与空白对照组相比,并没有ROS生成; 阳性对照组H2O2显著增加了ROS的含量。因此pENW抑制血小板与纤维蛋白原的黏附不依赖ROS的产生 (图 3)。
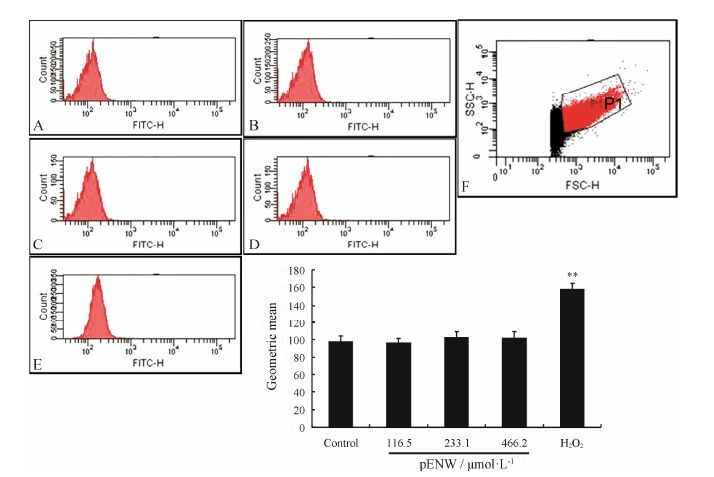
|
Figure 3 Effect of pENW on reactive-oxygen species (ROS) levels. A: Hepes-Tyrode’s buffer control group; B−D: pENW (116.5,223.1,466.2 μmol·L−1) groups; E: Positive control group H2O2 (8 mmol·L−1); F: Cells in the square showed as platelets by flow cytometer. Results represent the mean fluorescence ± SEM (n = 3). **P < 0.01 vs control group |
在静息状态下,血小板内cAMP的含量为 (12.56 ± 2.69) pmol·L−1,cGMP的含量为 (8.48 ± 1.96) pmol·L−1。在凝血酶的诱导下,cAMP含量下降至 (7.67 ± 2.0) pmol·L−1,抑制率为38.97%; cGMP含量下降至 (4.93 ± 1.31) pmol·L−1,抑制率为41.90%,具有显著性差异 (P < 0.05)。血小板与pENW孵育5 min后,能升高静息血小板cAMP、cGMP的含量,但无统计学差异。pENW高剂量 (466.2 μmol·L−1) 与中剂量 (233.1 μmol·L−1) 可升高血小板内cAMP、cGMP的含量。与诱导模型对照组相比,pENW 466.2 μmol·L−1组cAMP含量为 (13.12 ± 1.99) pmol·L−1,cGMP含量为 (9.70 ± 1.47) pmol·L−1; pENW 233.1 μmol·L−1组cAMP含量为 (11.16 ± 1.49) pmol·L−1,cGMP含量为 (8.96 ± 1.76) pmol·L−1,具有显著性差异 (P < 0.01,P < 0.05) (图 4)。
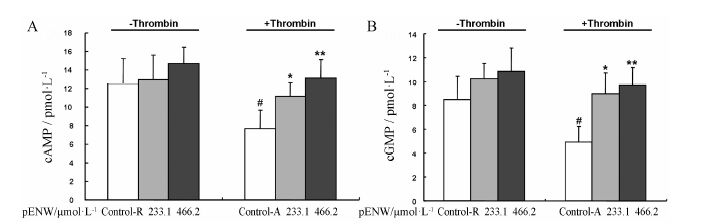
|
Figure 4 Effects of pENW on cAMP (A) and cGMP (B) productions in washed platelets. Data are expressed as mean ± SEM (n = 4). P < 0.05,**P < 0.01 vs control A (activated control group). #P < 0.05 vs control R (resting control group) |
TXA2 (通常测定其稳定代谢型TXB2) 在静息血小板内的含量为 (84.01 ± 11.75) pg·mL−1,凝血酶诱导后,血小板内的TXA2浓度上升至 (135.2 ± 12.61) pg·mL−1,具有极显著性差异 (P < 0.01); pENW可剂量相关性地抑制凝血酶诱导的TXA2合成,与模型对照组相比,pENW高剂量组 (466.2 μmol·L−1) 浓度为 (95.08 ± 14.23) pg·mL−1,抑制率为29.7%; pENW中剂量组 (233.1 μmol·L−1) 浓度为 (100.79 ± 9.29) pg·mL−1,抑制率为25.5%; pENW低剂量组 (116.5 μmol·L−1) 浓度为 (114.18 ± 11.11) pg·mL−1,抑制率为15.5%,均具有显著性差异 (P < 0.05或P < 0.01) (图 5)。

|
Figure 5 Effects of pENW on thrombin-stimulated TXB2 production. Data are expressed as mean ± SEM (n = 4). P < 0.05,**P < 0.01 vs thrombin group |
在静息状态下,血小板胞浆中[Ca2+]i为(75.6 ± 21.34) nmol·L−1; 在凝血酶的诱导下,血小板胞浆中[Ca2+]i显著升高至 (223.59 ± 27.88) nmol·L−1; pENW孵育5 min后,pENW的高剂量组 (466.2 μmol·L−1) 和中剂量组 (233.1 μmol·L−1) 能显著抑制凝血酶诱导的胞浆中Ca2+浓度升高,其胞浆中[Ca2+]i分别为 (131.06 ± 20.05) 和 (152.22 ± 23.64) nmol·L−1; 与模型组相比,其抑制率分别为41.38%和31.92%,均具有显著性差异 (P < 0.05或P < 0.01) (图 6)。

|
Figure 6 Effects of pENW on thrombin-stimulated [Ca2+]i mobilization. Data are expressed as mean ± SEM (n = 3). P < 0.05,**P < 0.01 vs model group |
与对照组相比,SNP有效减缓纤维蛋白凝块回 缩的速率,抑制纤维蛋白凝块的固化。 在0~4 h内,pENW (116.5~466.2 μmol·L−1) 可以降低纤维蛋白凝块的回缩速率。4 h时,pENW的最终回缩率小于对照组,因此pENW可有效抑制纤维蛋白凝块的回缩 (图 7)。
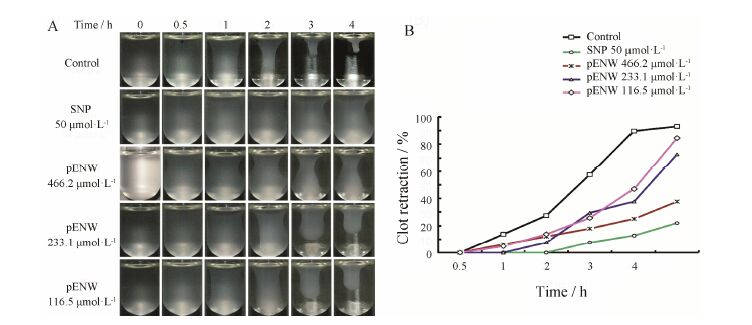
|
Figure 7 Effect of pENW on fibrin clot retraction. A: Time frames of a retracting clot at the indicated time points; B: Kinetic curves of retraction in the presence of different concentrations of pENW were generated by plotting clot areas versus time |
凝血酶激活血小板内信号通路,显著增加Akt磷酸化水平,该过程可被pENW抑制。与生理盐水组相比,pENW (466.2 μmol·L−1) 及PI3K的特异性抑制剂LY294002 (25 μmol·L−1) 与血小板悬液预孵育后,Akt磷酸化水平分别降低了 (66.4 ± 4.5) % 和(65.7 ± 4.7) % (P < 0.01)。pENW与LY294002合用孵育血小板后,协同抑制Akt磷酸化,其抑制率为 (74.4 ± 2.6) % (P < 0.01)。pENW呈剂量依赖性地抑制Akt磷酸化,而各组间血小板内总Akt没有明显的变化 (图 8)。
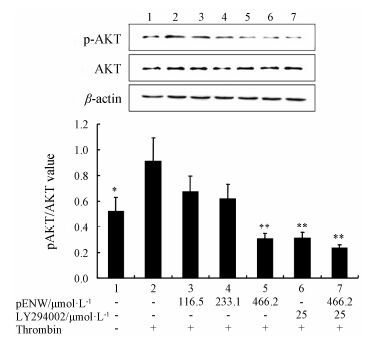
|
Figure 8 pENW significantly inhibited Akt phosphorylation induced by thrombin. Lane 1−2,platelets pretreated with saline. Lane 3−5,platelets pretreated with various concentrations of pENW respectively: 466.2,233.1,116.5 μmol·L−1 before the stimulation by thromnin. Lane 6,platelets pretreated with PI3K antagonist LY294002 (25 μmol·L−1). Lane 7,platelets pretreated with pENW (466.2 μmol·L−1) and LY294002 (25 μmol·L−1). Fold decreases are expressed as mean ± SEM (n = 3). P < 0.05,**P < 0.01 vs thromnin group |
凝血酶激活血小板内信号通路,显著性增加ERK1/2和p38磷酸化水平。阳性对照组SNP (50 μmol·L−1) 有效抑制凝血酶诱导的ERK1/2和p38磷酸化; 与生理盐水组相比,SNP对ERK1/2和p38磷酸化抑制率分别为 (84.0 ± 2.9) % 和(77.5 ± 3.4) % (P < 0.01)。pENW同样能够抑制ERK1/2和p38磷酸化; pENW (466.2,233.1 μmol·L−1) 与血小板悬液预孵育后,ERK1/2磷酸化水平分别降低了 (52.8 ± 6.0) % 和(28.6 ± 12.3) % (P < 0.05,P < 0.01)。pENW (466.2 μmol·L−1) 对p38磷酸化抑制率为 (56.5 ± 8.7) % (P < 0.01)。pENW呈剂量依赖性地抑制了ERK1/2和p38磷酸化,而各组间血小板内总ERK1/2和p38没有明显的变化 (图 9)。

|
Figure 9 pENW significantly inhibited (A) ERK1/2 phosphorylation and (B) p38 phosphorylation induced by thrombin. Lane 1−2,platelets pretreated with saline. Lane 3−5,platelets pretreated with various concentrations of pENW respectively: 116.5,233.1,466.2 μmol·L−1 before the stimulation by thromnin. Lane 6,platelets pretreated with SNP (50 μmol·L−1). Fold decreases are expressed as mean ± SEM (n = 3). P < 0.05,**P < 0.01 vs thromnin group |
本文考察了pENW对血小板与纤维蛋白原黏附的抑制作用,并探讨了pENW抑制血小板黏附作用的可能机制。与血小板聚集不同,在无激动剂诱导下,血小板可发生自发性的黏附。因此在实验中作者设 立了无凝血酶诱导组,考察pENW对血小板自发黏附的抑制作用。结果显示,pENW可有效抑制血小板的自发性黏附作用及凝血酶诱导的黏附作用,并且pENW更有效抑制凝血酶诱导的血小板与纤维蛋白原的黏附作用。pENW抑制凝血酶诱导的血小板的黏 附作用呈剂量依赖性,但并没有时间依赖性。pENW与血小板孵育5 min后,对血小板的抑制率达到最大值,因此推测pENW抑制凝血酶诱导的血小板黏附作用是快速调节机制。
活性氧ROS对血小板的活化状态有重要调节作用,研究表明,H2O2 (ROS的一种) 能够抑制胶原诱导的血小板聚集[14]。因此,作者采用流式法验证pENW是否通过诱导ROS途径来抑制黏附作用。结果显 示,pENW与血小板孵育1 h,没有ROS生成; 因此pENW不是通过活性氧机制抑制血小板的黏附,MTT实验也同样验证了pENW对血小板没有细胞毒性。
凝血酶与血小板上相关受体结合,通过G蛋白偶联受体 (Gq)-PLC-IP3信号通路激活血小板[15]; 血小板活化后伴随TXA2升高,细胞内[Ca2+]i增加。cGMP/ cAMP是血小板内重要的第二信使,cGMP/cAMP分别激活下游的蛋白激酶G (PKG) 与蛋白激酶A (PKA),磷酸化下游底物,从而对血小板的黏附产生负性调控,这是一种快速调节作用。因此作者检测了pENW对cGMP/cAMP、TXA2以及血小板内[Ca2+]i的调节作用。结果显示,pENW逆转凝血酶诱导的cGMP/cAMP含量的下降,抑制TXA2的生成; 血小板胞浆内钙离子浓度的降低与pENW升高cGMP/cAMP有关,cGMP/ cAMP升高后,可以通过激活下游蛋白激酶,磷酸化ATP-依赖的钙离子泵,抑制胞浆内Ca2+浓度的增加。
近年来,人们研究了凝血酶诱导的血小板内的信号通路。磷酸肌醇3激酶 (PI3K) 对血小板反应过程中的多个环节均有调节作用,诸如血小板黏附、细胞骨架重构和血小板聚集[16]。Akt是细胞内丝苏氨酸蛋白激酶家族成员,即PKB,是PI3K下游主要的效应分子。Akt的3个亚型 (Akt-1,Akt-2和Akt-3) 中,Akt-1和Akt-2均表达于血小板。它们对调节低浓度激活剂诱导的血小板活化和血小板依赖的体内血栓形成具有重要的调节作用。因此,Akt的磷酸化可用于评价血小板活化时PI3K通路的活化状态[17]。Western blot结果表明,pENW能够抑制凝血酶诱导的磷酸化Akt的表达,提示pENW能够抑制PI3K/Akt信号通路抑制血小板与纤维蛋白原的黏附。另外,纤维蛋白凝块回缩对于血栓的固化和稳定有重要作用。纤维蛋白凝块回缩依赖血小板上GPIIb/IIIa与细胞骨架蛋白的锚定结合,继而启动由整合素介导的“outside-in”信号转导。血小板GPIIb/IIIa与纤维蛋白原结合后,通过“outside-in”信号途径稳固已形成的栓子,PI3K/ Akt信号通路也参与“outside-in”信号途径。因此,pENW可能通过PI3K/Akt信号通路来抑制蛋白纤维凝块的回缩。
在血小板中,MAPKs家族ERK和p38对血小 板的活化状态有重要意义[18]。凝血酶诱导血小板内ERK和p38的快速磷酸化导致GPIIb/IIIa构型变化,使之与纤维蛋白原结合形成栓子。实验中,凝血酶与血小板孵育5 min就可以诱导磷酸化ERK和磷酸化p38的表达[19],阳性对照SNP能够有效抑制ERK和p38的磷酸化[20]。有研究显示,凝血酶诱导的血小板活化后,ERK的活化依赖于Ca2+和PKC的活化,而cGMP/PKG能够抑制p38磷酸化,可以推测,pENW抑制细胞内钙升高及增加cGMP的水平可以抑制ERK和p38的磷酸化,Western blot结果与推测一致,pENW能有效抑制磷酸化ERK与p38的表达。
Western blot实验结果显示,pENW可以有效抑制凝血酶诱导的Akt磷酸化及磷酸化ERK与p38的表达。然而,Akt活化的信号转导机制及MAPK信号途径对血小板活化的作用仍存在不少争议。有研究表明,PI3K和Akt磷酸化是PAR和P2Y12介导的血小板聚集和血小板活化所必需的,另一些研究证实血小板激活时Akt的活化促进血小板NO的合成和cGMP水平的升高,通过激活NO/cGMP信号通路刺激血小板颗粒内容物释放和血小板聚集。但是这些结果与NO/cGMP对血小板活化的抑制作用相矛盾。结合作者前期的研究[1, 5],pENW可以有效调节内皮细胞中一氧化氮合酶及NO的水平,在血小板中pENW是否具有同样的作用,其作用对抑制血小板的聚集和黏附的影响有待进一步研究。这些问题的解决对认识血小板生理和血栓风险的逆转具有十分重要的意义。
综上所述,pENW能剂量依赖性地抑制血小板与纤维蛋白原的黏附,减缓纤维蛋白凝块的回缩。pENW对血小板黏附的抑制作用是一种快速调节机制,其作用机制与升高血小板内cGMP/cAMP含量、抑制TXA2的生成及抑制血小板胞浆内钙离子浓度 升高有关。此外,pENW也可抑制凝血酶诱导的PI3K/Akt信号通路与MAPK信号通路的活化。因此pENW抑制血小板黏附及纤维蛋白凝块回缩,既能够阻止血栓形成的始动环节,又能减缓已形成血栓的固化过程。
| [1] | Xiong J, Fang W, Bai L, et al. Anticoagulant and antithrombotic activity of a new peptide pENW (pGlu-Asn-Trp)[J]. J Pharm Pharmacol, 2009, 61:89-94. |
| [2] | Bai L, Fang WR, Kong Y, et al. Protective effect of snake venom tripeptide pENW on the injury of human umbilical vein endothelial cells induced by hydrogen peroxide[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2014, 30:43-46. |
| [3] | Bai L, Niu XS, Xiong J, et al. Inhibition of pENW on arterial thrombosis induced by FeCl3 in rat[J]. J China Pharm Univ (中国药科大学学报), 2012, 43:75-78. |
| [4] | Xiong J, Bai L, Fang WR, et al. The protective effect of snake venom tripeptide pENW on endothelial cells and its mechanisms[J]. Prog Pharm Sci (药学进展), 2011, 35:367- 372. |
| [5] | Xiong J, Bai L, Fang W, et al. New peptide pENW (pGlu-Asn-Trp) inhibits platelet activation by attenuating Akt phosphorylation[J]. Eur J Pharm Sci, 2012, 45:552-558. |
| [6] | Rocha VZ, Libby P. Obesity, inflammation, and atherosclerosis[J]. Nat Rev Cardiol, 2009, 6:399-409. |
| [7] | Manabe I. Obesity and atherosclerosis-two faces of chronic inflammation[J]. Nihon Rinsho, 2009, 67:417-425. |
| [8] | Lakoski SG, Cushman M, Siscovick DS, et al. The relationship between inflammation, obesity and risk for hypertension in the multi-ethnic study of atherosclerosis (MESA)[J]. J Hum Hypertens, 2011, 25:73-79. |
| [9] | Corrado E, Rizzo M, Coppola G, et al. An update on the role of markers of inflammation in atherosclerosis[J]. J Atheroscler Thromb, 2010, 17:1-11. |
| [10] | Esper RJ, Vilarino JO, Machado RA, et al. Endothelial dysfunction in normal and abnormal glucose metabolism[J]. Adv Cardiol, 2008, 45:17-43. |
| [11] | Iughetti L, Bruzzi P, Predieri B. Evaluation and management of hyperlipidemia in children and adolescents[J]. Curr Opin Pediatr, 2010, 22:485-493. |
| [12] | Te Boekhorst BC, van Tilborg GA, Strijkers GJ, et al. Molecular MRI of inflammation in atherosclerosis[J]. Curr Cardiovasc Imaging Rep, 2012, 5:60-68. |
| [13] | Manduteanu I, Simionescu M. Inflammation in atherosclerosis:a cause or a result of vascular disorders?[J]. J Cell Mol Med, 2012, 16:1978-1990. |
| [14] | Naseem KM, Chirico S, Mohammadi B, et al. The synergism of hydrogen peroxide with plasma S-nitrosothiols in the inhibition of platelet activation[J]. Biochem J, 1996, 318:759-766. |
| [15] | Lee H, Sturgeon SA, Jackson SP, et al. The contribution of thrombin-induced platelet activation to thrombus growth is diminished under pathological blood shear conditions[J]. Thromb Haemost, 2012, 107:328-337. |
| [16] | Yin H, Stojanovic A, Hay N, et al. The role of Akt in the signaling pathway of the glycoprotein Ib -IX induced platelet activation[J]. Blood, 2008, 111:658-665. |
| [17] | Huang ZS, Zeng CL, Zhu LJ, et al. Salvianolic acid A inhibits platelet activation and arterial thrombosis via inhibition of phosphoinositide 3-kinase[J]. J Thromb Haemost, 2010, 8:1383-1393. |
| [18] | Nadal-Wollbold F, Pawlowski M, Levy-Toledano S, et al. Platelet ERK2 activation by thrombin is dependent on calcium and conventional protein kinases C but not Raf-1 or B-Raf[J]. FEBS Lett, 2002, 531:475-482. |
| [19] | Rex S, Beaulieu LM, Perlman DH, et al. Immune versus thrombotic stimulation of platelets differentially regulates signaling pathways, intracellular protein-protein interactions, and alpha-granule release[J]. Thromb Haemost, 2009, 102:97-110. |
| [20] | Begonja AJ, Geiger J, Rukoyatkina N, et al. Thrombin stimulation of p38 MAP kinase in human platelets is mediated by ADP and thromboxane A2 and inhibited by cGMP/cGMPdependent protein kinase[J]. Blood, 2007, 109:616-618. |
 2015, Vol. 50
2015, Vol. 50


