核因子NF-E2相关因子 (nuclear factor erythroid 2-related factor 2,Nrf2) 于1996年由Kan等[1]首次克隆,酵母互补分析研究显示,Nrf2为66~68 kDa的蛋白,属cap'n'collar (CNC) 转录因子家族成员,含有一个高度保守的碱性亮氨酸拉链 (basic region leucine zipper,bZIP) 结构[2]。氧化应激是体内许多疾病始发的关键因素,核转录因子Nrf2是氧化应激通路中最重要的调节因子之一,通过与抗氧化物反应元件ARE相互作用调节编码抗氧化蛋白表达,发挥抗炎及损 伤、抑制氧化应激反应与调节细胞凋亡等功能[3]。大量研究表明,Nrf2与呼吸系统、肝脏、泌尿系统、神经系统、皮肤、氧化应激性纤维化和代谢性疾病,以及肿瘤与耐药等均密切相关[4]。
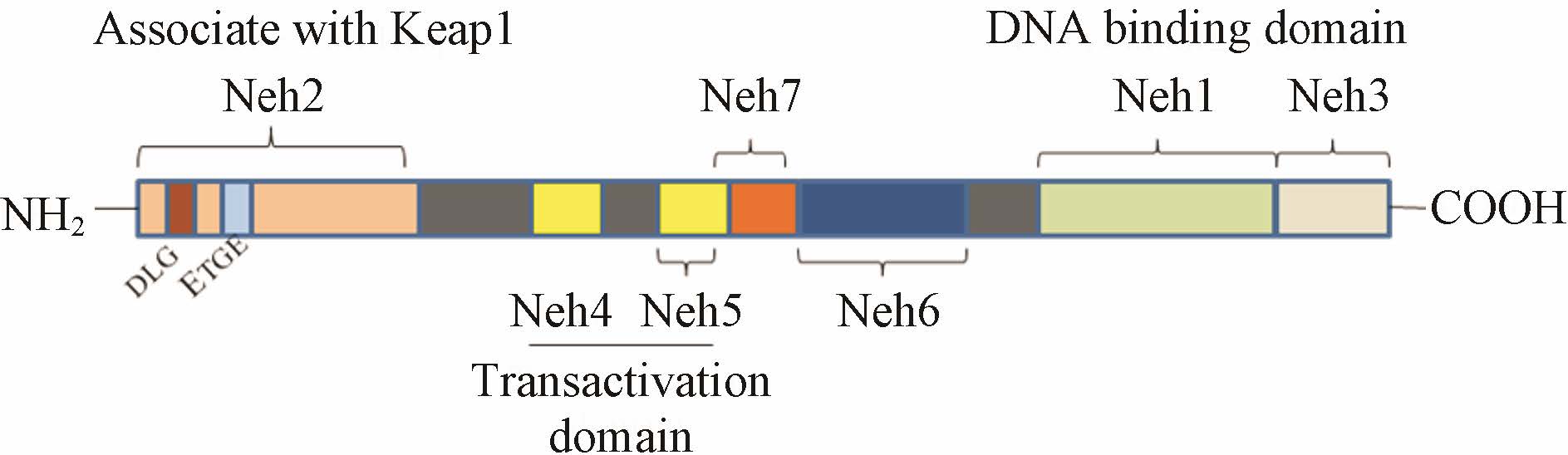
1 Nrf2-Keap1-ARE信号通路 1.1 Nrf2分子结构和功能Nrf2是该转录因子家族成员中活性最强的转录调节因子,可在多种细胞,如肝脏、肾脏等代谢和解毒组织表达。Nrf2包含7个功能域,分别被命名为Neh1-7,见图 1。其中,Neh2是主要的调节功能域,N末端区域包含7个与泛素结合的赖氨酸残基以及调节Nrf2活性的两个序列,分别是DLG序列和ETGE序列[4]。在生理状态下,Keapl双甘氨酸序列 (double glycine repeat,DGR) 与Nrf2的Neh2部位相互作用,促进泛素蛋白酶体中的E3泛素连接酶对Nrf2的降解,从而使Nrf2的表达量维持在一个较低的水平[5]。Nehl区含1个CNC类型的碱性亮氨酸拉链结构必须与其他转录因子形成异二聚体才能识别并结合ARE,启动目标基因转录。另外,此区域与泛素连接酶UbcM2作用,调节Nrf2活性[6]。Neh3结构域位于羧基端,具有高度保守性,共激动剂染色质解螺旋酶DNA结合蛋白6 (chromodomain helicase DNA binding protein 6,CHD6) 与其结合,可上调Nrf2靶基因表达。Neh4和Neh5结构域参与 启动下游基因转录,进入细胞核的Nrf2以Nrf2-Maf的形式与ARE结合后并不能立即启动转录,尚需要其他辅助蛋白例如cAMP应答元件结合蛋白 (cAMP responsive element binding protein,CREB)、结合蛋白 (CREB binding protein,CBP) 等转录激活剂与Nrf2的Neh4、Neh5两个结构域结合后,才能启动转录过程[7]。Neh6区: 富含丝氨酸残基,与Nrf2氧化还原非依赖的负性调节有关[8]。最近研究显示,第7个功能域Neh7被识别且可以和视黄酸X受体α(retinoid X receptor α,RXRα) 结合,抑制Nrf2的基因转录。RNAi介导抑制RXRα可提高ARE驱动基因基础 表达,并促进NRF2激活剂叔丁基对苯二酚 (tert- butylhydroquinone,tBHQ) 诱导的ARE驱动基因表达。相反,过表达RXRα则可抑制ARE驱动基因表达[9]。
|
图 1 Nrf2结构示意图 |
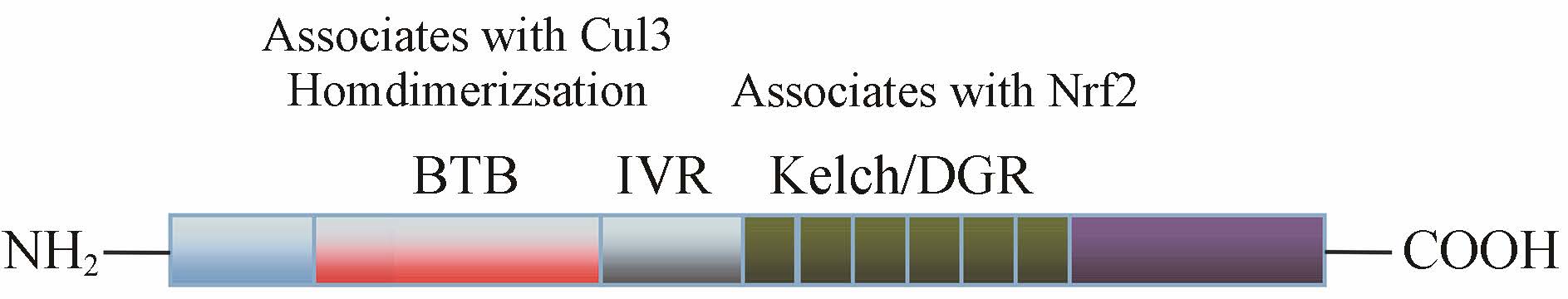
Keapl作为Nrf2信号通路最主要的调节蛋白之一,是Kelch家族多区域阻遏蛋白,分子质量为69 kDa,是Nrf2负性调节蛋白。生理状态下,Keap1连接Cul3复合物及Nrf2,Nrf2与Keap1结合被泛素化,在胞浆中快速降解。当氧化物聚积时,Nrf2与Keap1解离,转移到核内与ARE结合,激活目标基因,保护机体免受毒害物质 (致癌物、药物代谢活化产物等) 的侵害[8]。人Keapl蛋白一级结构包含5个区 (图 2) 分别是: ① N末端区域; ② BTB (broad complex,tramtrack,bric-a-brac): 在肌动蛋白结合蛋白和锌指转录因子中发现的一个蛋白−蛋白相互作用的进化保守基序,通常与其他BTB区形成二聚体,是Keapl与Nrf2解离、阻止II相基因转录所必需的; ③ 干预区 (intervening region,IVR): 该区域不仅富含半胱氨酸,而且含有Keapl活性最强的半胱氨酸残基,是整个蛋白的功能调节区,不仅参与亲电化合物及氧化剂的反应,同时还参与形成泛素化连接酶稳定Nrf2; ④ DGR区: 含有6个双甘氨酸重复序列或6个Kelch模序,重复的Kelch模序形成6片经典的p螺旋,含有多个潜在的蛋白质结合位点,是Keapl与Neh2区结合的位点,也是Keapl与胞浆肌动蛋白结合的位点; ⑤ C末端[10, 11]。
|
图 2 Keap1结构示意图 |
氧化应激即氧化还原状态的失衡,促氧化剂导致活性氧簇 (reactive oxygen species,ROS) 产生的增加超过了抗氧化剂的清除能力。氧化应激是涉 及呼吸系统、心血管系统、神经系统与消化系统等疾病的一个重要因素,在氧化应激过程中,常伴有自由基ROS,如超氧阴离子 (O2−)、羟自由基 (·OH) 和过氧化氢 (H2O2) 等生成,如果ROS增加或不能及时清除,大量堆积则导致脂质过氧化、蛋白氧化和DNA损伤而造成严重的器官、组织或细胞损害。机体存在两类抗氧化系统,一类是酶抗氧化系统,包括超氧化物歧化酶 (superoxidase dismutase,SOD)、过氧化氢酶 (catalase,CAT) 和谷胱甘肽过氧化物酶 (glutathione S-transferase,GST) 等; 另一类是非酶抗氧化系统,包括维生素C、谷胱甘肽、褪黑素、类胡萝卜素和微量元素铜等。Nrf2-Keap1-ARE是机体抗氧化应激炎症系统中重要的信号通路[12, 13]。
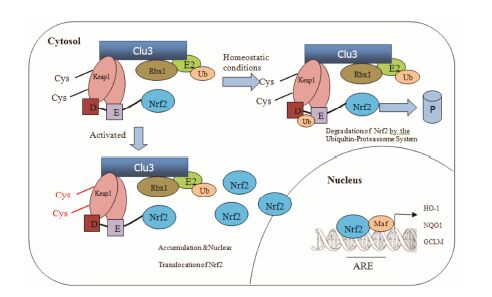
ARE是一个特异的DNA-启动子结合序列,位于SOD和CST等保护基因5' 端的启动序列,这一序列能被多重氧化剂和亲电性化合物激活,从而启动II相抗氧化酶的转录翻译。Nrf2-Keap1-ARE是机体氧化应激系统重要的信号通路。正常情况下,同源二聚体Keap1的两个DGR分别与Nrf2的DLG序列和ETGE序列结合,Nrf2被Cul3复合物泛素化并被蛋 白酶降解,Nrf2处于失活状态[8]。当细胞处于氧化应激状态时,亲电子试剂攻击Keap1的半胱氨酸,使Keap1发生构象改变,二聚体Keap1的一个DGR与低亲和力DLG模体的结合断开,Nrf2-Keap1-Cul3复合物构型改变使Nrf2不能被泛素化和降解[14]。另外,研究显示通过蛋白激酶C(protein kinase C,PKC)、丝裂原活化蛋白激酶 (mitogen activated protein kinases,MAPKs) 和细胞外信号调节激酶 (extracellular signal- regulated kinase,ERK) 等途径使Nrf2磷酸化,干扰Nrf2-Keap1的相互作用也是激活Nrf2的一条途径,但是激酶诱导Nrf2磷酸化从而使其活化机制还不十分清楚[15]。Nrf2通过核定位信号 (nuclear localization signal,NLS) 游离至核内,与小Mafs蛋白形成异二聚体,并协同转录因子CBP与抗氧化反应元件ARE结合,启动Nrf2/ARE信号通路,上调ARE调控的抗氧化酶及II相解毒酶基因表达,增加细胞对氧化应激的抗性,清除自由基。当细胞恢复正常时,Keap1进入核内,与核内Nrf2形成Nrf2-Keap1复合物,并通过Keap1核输出信号 (nuclear export sequence,NES) 运出核外,Nrf2/ARE信号通路终止[11]。Nrf2-Keap1-ARE信号通路调节机制如图 3所示[4]。
|
图 3 Nrf2-Keap1-ARE信号通路调节机制[4] |
ROS可以来源于外界刺激,如香烟、外界环境中的阳光辐射、空气污染 (PM2.5,汽车尾气等)、吸烟和农药等。在生理状态下,体内产生的自由基可作为信号分子参与体内防御反应,但在病理条件下,过多的自由基对机体产生毒性作用[16]。研究显示,炎症、肿瘤、衰老、血液病以及心、肝、肺、皮肤等疾病的发生与体内自由基产生过多或清除自由基能力下降有密切关系[17]。
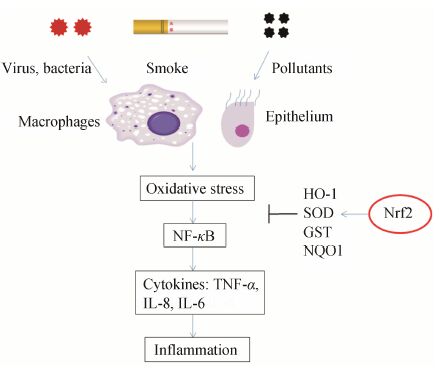
呼吸道作为参与整个机体代谢和维持生命活动的重要器官之一,是人体直接与外界相通的一个特别器官,气管和支气管是呼吸气体出入的通道,内层的黏膜内含有黏液腺,分泌黏液。肺是直接暴露于高氧环境中的唯一器官,在肺泡水平的氧分压要比其他重要脏器如心、肝和脑高很多[18]。气道首先与吸入性氧化剂接触,由于不断受外界多种因素尤其是活性氧化物刺激,支气管气道上皮细胞和组织细胞内外含有丰富的抗氧化剂,此氧化还原平衡可被过强的氧化负荷打乱引起失衡,产生慢性炎症,Nrf2对炎症的调节如图 4。已知许多急、慢性呼吸系统疾病,包括肺气肿、慢性阻塞性肺疾病 (COPD)、支气管哮喘、急性肺损伤 (ALI) 和急性呼吸窘迫综合征 (acute respiratory distress syndrome,ARDS) 发病机制与氧化应激有关[19]。
|
图 4 Nrf2对炎症的调节 |
COPD是一种以气道受限为特征的疾病,与肺部对香烟烟雾等有害气体或有害颗粒的异常炎症反应有关[20]。近年来,COPD表型的相关研究引起了广泛关注,其中肺气肿是目前认为具有一定临床意义的COPD表型。研究COPD肺气肿表型的气道炎症特征及其意义,有助于深入了解COPD的发病机制,探索新的治疗措施[21]。氧化应激是COPD的重要发病机制之一。当ROS的增加与累积超出了自身抗氧化物质的清除能力,将导致氧化抗氧化失衡,从而造成肺部损伤,气流受限进行性加重。吸烟及大气污染是COPD的主要病因,Nrf2在对抗香烟烟雾所致的氧化应激方面具有重要作用,Nrf2作为转录因子与抗氧化反应元件ARE作用,调控ARE依赖的II相解毒酶基因和抗氧化基因的转录活性,包括GST、过氧化氢酶、超氧化物歧化酶SOD和血红素氧合酶 (heme oxygenase 1,HO-1) 等[22]。对香烟所致的氧化应激反应,Nrf2的保护作用还表现在抗炎上。Soares等[23]研究显示,内皮细胞受Nrf2调控,HO-1可抑制NF-κB (nuclear factor kappaB) 依赖的TNF-α的生成,这种抗炎作用可能与Nrf2抑制NF-κB活性有关。Guan等[24]研究显示,烟草提取物 (cigarette smoke extract,CSE) 刺激支气管上皮细胞,致其氧化应激损伤,以穿心莲内酯干预,通过提高Nrf2活性上调抗氧化酶谷酰胺半−胱氨酸连接酶 (glutamate-cysteineligase,GCLC) 和谷胱甘肽过氧化物酶等,生成GSH,清除氧自由基; 同时,穿心莲内酯还可降低COPD小鼠肺组织中DNA损害标志物8-羟脱氧鸟苷 (8-hydroxy-2'-deoxyguanosine,8-OHdG) 生成,发挥抗炎抗氧化作用。研究表明,在香烟烟雾 (CS) 诱发的肺气肿患者中,正性调节蛋白DJ-1表达减少及HDAC2活性降低,下调Nrf2表达[25]。老年 吸烟者和COPD患者中肺组织和肺泡巨噬细胞中Nrf2-Keapl-Bach1 (transcription factor BTB and CNC homology1,Bach1) 平衡低下,Bach1和Keapl水平增高,Nrf2水平相对降低[26, 27]。Ishii等[28]研究显示,相比Nrf2+/+小鼠,Nrf2−/−小鼠对CS及弹性蛋白酶诱导的肺气肿有很强的易感性,将导致更严重的肺气肿症状; DNA氧化物形成增多,而ARE调节的抗氧化和抗炎基因表达缺乏; 抗氧化和抗蛋白酶表达下调,分泌物增加,呼吸道阻力增大。除香烟外,大气污染物 (细菌、病毒和真菌等微生物等)、燃烧颗粒 (SO2、NO2等) 等可通过呼吸作用进入体内刺激线粒体,产生内源性ROS及活性氮自由基 (RNS),进而激活Nrf2-ARE信号通路,但抗氧化系统不足以清除自由基时,反复或持续性刺激,产生慢性炎症[29]。
2.2 哮喘和过敏性气道疾病鼻黏膜接触变应原后,由IgE介导的炎症反应及其引发的一系列鼻部症状,导致了过敏性鼻炎,然而半数以上的哮喘患者是由过敏性鼻炎发展而致[30]。哮喘是一种以可恢复的支气管阻塞、炎性细胞浸润和气道高反应性 (airway high reactivity,AHR) 为特征的慢性呼吸道疾病[31]。暴露于环境中的各种氧化剂, 如PM2.5、超细大气颗粒物 (ambient ultrafine particles,UFP) 或汽车尾气颗粒 (diesel exhaust particle,DEP) 等,可直接产生氧自由基ROS,引起哮喘样症状或加重原有气道变应性疾病。Deng等[32]研究显示, 16 μg·cm2 PM2.5即可刺激A549细胞内ROS升高,siRNA敲除Nrf2后,ROS较阴性组升高,另外,用Western blot和激光共聚焦显微镜观察到,PM2.5可以启动抗氧化修复系统,促进Nrf2 进入核内,调控ARE依赖的抗氧化基因的转录翻译。在以UFP为辅助佐剂OVA诱导的小鼠哮喘模型,与野生型小鼠相比,Nrf2−/−小鼠炎性细胞浸润明显,Th2炎性因子水平升高,说明Nrf2−/−小鼠能加强UFP的佐剂致敏效应,引起肺部炎症。另外,从 Nrf2−/−小鼠骨髓造血干细胞中分离的树突状细胞在静息状态下表现出Th2细胞样特征,即生成低水平的IL-12p70及高水平IL-6,表明Nrf2在哮喘小鼠中显示抗炎作用[33]。Li等[34]研究显示,Nrf2诱导剂萝卜硫素可激活Nrf2,诱导肺泡巨噬细胞和支气管上皮细胞1型血红素氧化酶HO-1、GST和其他II相酶表达,降低哮喘小鼠肺组织氧化应激水平。DEP可以直接在肺部产生ROS,进而加重氧化应激反应,激活NF-κB,产生炎症反应,而与野生型小鼠相比,暴露于低剂量DEP后,Nrf2−/−小鼠气道高反应性以及淋巴细胞和嗜酸性细胞的炎症显著增强,肺泡灌洗液中IL-12和IL-13显著升高,表明Nrf2对DEP诱导的过敏性哮喘有重要的调节作用[33, 34]。因此,Nrf2可能为哮喘气道炎症和气道重塑的治疗或研究提供新的靶点或思路。
2.3 急性肺损伤ALI是由各种肺内外因素导致的急性进行性加重的呼吸困难和难治性低氧血症,内皮细胞损伤和功能紊乱,造成弥漫性肺间质及肺泡水肿,导致急性低氧性呼吸功能不全等,是ALI/ARDS重要的病理特征[35]。ALI与ARDS与慢性炎症不同,过度全身炎症反应或抗炎反应导致包括急性肺损伤在内的多器官功能障碍,可进一步发展至ARDS[36]。Mehla等[37]研究显示,没食子酸乙酯通过上调Nrf2从而诱导HO-1的表达来减弱内毒素 (lipopolysaccharide,LPS) 诱导的小鼠急性肺损伤。siRNA处理THP-1细胞后,没食子酸乙酯未能起到上调HO-1和抗炎的作用。有研究报道,Nrf2可直接抑制NF-κB及激活蛋 白-1 (activator protein 1,AP-1) 功能,减弱LPS引起的急性炎症效应,Nrf2诱导剂萝卜硫素还通过抑制LPS活化的Toll样受体 (Toll like receptor 4,TLR4) 抑制炎性因子的生成。TLR4识别的配体主要包括革兰阳性菌磷壁酸和热休克蛋白60,它们不能直接识别结合细菌LPS,但与LPS活化信号转导密切相关,Nrf2可能间接调节NF-κB功能[38]。Kim等[39]研究显示,相对于野生型小鼠,Nrf2敲除小鼠急性肺损伤的程度更重,提示Nrf2信号通路是急性肺损伤保护的关键靶点。
3 Nrf2诱导剂诸多研究显示,Nrf2在抵御各种疾病中扮演重要角色,包括慢性阻塞性肺疾病、急性肺损伤、自身免疫性疾病、癌症、神经退行性疾病和炎症。一些天然成分,如异硫氢酸酯、莱菔硫烷和白藜芦醇等均已被证实是Nrf2转录活性的重要调节因子,并在防治与细胞氧化应激关系密切的疾病形成中显示出较好的应用前景和受到关注[40]。抗气道炎症的抗炎药物,主要包括糖皮质激素和磷酸二酯酶4抑制剂等,可明显抑制气道炎症,但仍有相当部分患者对激素不甚敏感,应用激素治疗效果较差 ,存在激素抵抗,并有研究报道,激素不能抑制中性粒细胞炎症。而抗氧化药物可以改善激素抵抗,且毒副作用较少,对预防和治疗肺部疾病具有重要意义。因此,Nrf2作为潜在性靶点及其诱导剂的研究,对指导临床用药与寻找新药研发均有重要意义[41],Nrf2诱导剂总结见表 1[42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54]。
3.1 植物来源的 Nrf2诱导剂根据文献[42, 43]报道,较强植物来源的Nrf2诱导剂有: 莱菔硫烷 (十字花科蔬菜)、姜黄素 (香料)、表 1儿茶素酸酯 (绿茶)、白藜芦醇 (葡萄)、咖啡酸苯乙酯 (松树)、咖啡醇和咖啡白 (咖啡)、番茄红素 (番茄) 等。
|
|
表 1 Nrf2诱导剂的研究进展 |
一类间接抑制Keap1−Nrf2连接的化合物,有姜黄素和咖啡酸苯乙酯等。迈克尔受体能与蛋白半胱 氨酸残基中的硫醇基团进行共轭加成反应,被称为迈克尔反应,迈克尔受体与Keap1半胱氨酸残基反应引起Keap1构象变化,导致Nrf2与之解离,使依赖Keap1的Nrf2泛素化降解程度下降,Nrf2稳定性增 加,是Nrf2最普遍的活化方式[44]。姜黄素是从姜黄中提取的黄色色素。生理状态下,线粒体呼吸链是ROS的主要来源,大量ROS可氧化不饱和脂质导致脂质过氧化,加剧线粒体功能障碍,研究显示,姜黄素能够使线粒体膜电位去极化,减少ROS产生,诱导HO-1表达,发挥抗氧化作用。Balogun等[45]研究显示,在大鼠肾上皮细胞 (NRK-52E),姜黄素可通过迈克尔反应,破坏Nrf2-Keap1复合结构,上调Nrf2与ARE结合,增加HO-1的活性。另外,在肺上皮细胞中姜黄素还可以激活PI3K和p38MAP激酶来稳定Nrf2,上调GCL mRNA表达,清除自由基,减少氧化损伤。
酚类醌类抗氧化剂,如槲皮素、白藜芦醇、表儿茶素酸酯等。此类化合物中的酚羟基可以清除自由基,起到抗氧化作用。研究显示,槲皮素能上调Nrf2细胞核的表达并伴有HO-1表达升高,siRNA基因沉默Nrf2后,槲皮素未能上调HO-1; 加入MEK (ERK1/2激酶) 抑制剂PD98059,槲皮素的Nrf2激活作用被抑制,表明槲皮素可通过调节MEK/ERK1/2信号通路来激活Nrf2[46]。白藜芦醇 (resveratrol) 是含有芪类结构的非黄酮类多酚化合物,广泛存在于葡萄、松树、虎杖及花生等天然植物和果实中,具有抗菌、抗癌、抗炎、抗过敏、降血脂和抗氧化等多方面药理活性[47]。Kode等[48]研究显示,白藜芦醇可减少CSE刺激A549细胞ROS产生,提高GCLC活性,使GSH生成增多,进一步清除氧自由基,而siRNA敲除Nrf2后,白藜芦醇未能上调GCLC,表明白藜芦醇可能通过Nrf2发挥其抗氧化作用。Chen等[49]研究显示,白藜芦醇可通过激活Nrf2来上调HO-1表达,PI3K和ERK的抑制剂可以减弱白藜芦醇对HO-1的上调作用。Sajish等[50]最新发现,白藜芦醇可以强有力激活人类细胞一种进化上的古老应激反应酶,与氨基酪氨酸相关的tRNA合成酶 (tryptophanyl-tRNA synthetases,TyrRS) 作为其研究小组潜在研究靶标,可激活PARP-1 [poly (ADP-ribose) polymerase-1] 从而使长寿基因FOXO3A与SIRT6一系列保护性基因活化以及肿瘤抑制基因p53和HO-1等表达。
3.2 化学合成诱导剂除植物来源化学物质外,有些化学合成的药品,如PMX-290、甲基巴多索隆 (triterpenoid bardoxolone methyl,CDDO-Me),也是Nrf2强诱导剂[49]。CDDO-Me一直用于治疗慢性肾病、癌症 (白血病和实体肿瘤) 和其他疾病,CDDO- Me是合成的三萜类化合物,可以与带有半胱氨酸残基的蛋白质可逆性加合,如Keap1和IκB激酶。CDDO- Me主要通过活化Nrf2并同时抑制NF-κB显示其抗炎作用,CDDO-Me与IκB激酶Cys-179结合使其激活,抑制NF-κB活性[51]。在急性肾炎模型下,CDDO- Me可下调Keap1的同时促进Nrf2核易位,进而上调HO-1、NQO1等抗氧化酶发挥抗炎作用[52]。但在CDDO-Me用于慢性肾脏疾病III期临床试验中,发现伴有肾功能不全及心血管副作用而被迫终止[53, 54]。Wong等[55]研究显示,化合物PXM-290含有迈克尔受体与巯基反应,增强Keap1和Clu3的连接,抑制Nrf2泛素化,增加Nrf2浓度及转录活性。体内外研究显示,化合物PXM-290具有抗肿瘤增殖活性。
研究报道,Nrf2激活剂饮食多酚 (姜黄素、白藜芦醇和槲皮素) 等有抗气道炎症作用。白藜芦醇能够明显降低COPD患者和吸烟者支气管灌洗液中IL-8和人粒细胞−巨噬细胞集落刺激因子 (GM-CSF) 的水平,能够明显抑制COPD患者肺泡巨噬细胞炎性因子的分泌,改善激素个体的耐受。Nrf2激活剂作为天然的抗氧化剂可能成为治疗肺部疾病潜在药物。然而,这些化合物对Nrf2诱导的特异性、药物代谢动力学、生物利用度和毒性仍需进一步研究[56, 57, 58]。
4 结语与展望氧化应激是体内许多疾病始发的关键因素,机体内氧化还原反应调节失衡是众多疾病的病理生理基础。Nrf2是氧化应激的重要调节因子,Nrf2通路活化,能进一步启动生物体内多种ARE依赖性的靶基因的转录活化和蛋白表达,很可能与多种生理功能及病理改变密切关联。当肺暴露于高氧、烟雾、PM2.5和病原体等环境中,Nrf2可以减少环境造成的肺部损伤,Nrf2除了通过调控下游抗氧化酶HO-1、NQO1及GST等消除氧自由基外,还可抑制NF-κB活性从而减少炎症因子生成。鉴于Nrf2在抗氧化、抗炎和延缓衰老等生理功能中扮演重要的角色,寻找基于调控内源性抗氧化损伤Nrf2-Keap1-ARE通路的Nrf2诱导剂,将为气道炎症治疗与药物研发提供潜在靶点和新的研究思路。
| [1] | Zhang DD. Mechanistic studies of the Nrf2-Keap1 signaling pathway[J]. Drug Metab Rev, 2006, 38:769-789. |
| [2] | Jaiswal AK. Nrf2 signaling in coordinated activation of antioxidant gene expression[J]. Free Radic Biol Med, 2004, 36:1199-1207. |
| [3] | Abreu CC, Cardozo L, Mafra D. Could physical exercises modulate Nrf2-Keap1 pathway in chronic kidney disease[J]. Med Hypotheses, 2015, 84:44-46. |
| [4] | Jaramillo MC, Zhang DD. The emerging role of the Nrf2-Keap1 signaling pathway in cancer[J]. Genes Dev, 2013, 27:2179-2191. |
| [5] | Kansanen E, Kuosmanen SM, Leinonen H, et al. The Keap1-Nrf2 pathway:mechanisms of activation and dysregulation in cancer[J]. Redox Biol, 2013, 1:45-49. |
| [6] | Plafker KS, Nguyen L, Barneche M, et al. The ubiquitinconjugating enzyme UbcM2 can regulate the stability and activity of the antioxidant transcription factor Nrf2[J]. J Biol Chem, 2010, 285:23064-23074. |
| [7] | Katoh Y, Itoh K, Yoshida E, et al. Two domains of Nrf2 cooperatively bind CBP, a CREB binding protein, and synergistically activate transcription[J]. Genes Cells, 2001, 6:857-868. |
| [8] | Suzuki T, Motohashi H, Yamamoto M. Toward clinical application of the Keap1-Nrf2 pathway[J]. Trends Pharmacol Sci, 2013, 34:340-346. |
| [9] | Wang H, Liu K, Geng M, et al. RXRα inhibits the NRF2-ARE signaling pathway through a direct interaction with the Neh7 domain of NRF2[J]. Cancer Res, 2013, 73:3097- 3108. |
| [10] | Richardson BG, Jain AD, Speltz TE, et al. Non-electrophilic modulators of the canonical Keap1/Nrf2 pathway[J]. Bioorg Med Chem Lett, 2015, 25:2261-2268. |
| [11] | Singh S, Vrishni S, Singh BK, et al. Nrf2-ARE stress response mechanism:a control point in oxidative stressmediated dysfunctions and chronic inflammatory diseases[J]. Free Radic Res, 2010, 44:1267-1288. |
| [12] | Devasagayam TP, Tilak JC, Boloor KK, et al. Free radicals and antioxidants in human health:current status and future prospects[J]. J Assoc Physicians India, 2004, 52:794-804. |
| [13] | Ozben T. Oxidative stress and apoptosis:impact on cancer therapy[J]. J Pharm Sci, 2007, 96:2181-2196. |
| [14] | Maher J, Yamamoto M. The rise of antioxidant signaling-the evolution and hormetic actions of Nrf2[J]. Toxicol Appl Pharmacol, 2010, 244:4-15. |
| [15] | Mann GE, Bonacasa B, Ishii T, et al. Targeting the redox sensitive Nrf2-Keap1 defense pathway in cardiovascular disease:protection afforded by dietary isoflavones[J]. Curr Opin Pharmacol, 2009, 9:139-145. |
| [16] | Finkel T, Holbrook NJ. Oxidants, oxidative stress and the biology of ageing[J]. Nature, 2000, 408:239-247. |
| [17] | Chung HY, Kim HJ, Kim JW, et al. The inflammation hypothesis of aging[J]. Ann New York Acad Sci, 2001, 928:327-335. |
| [18] | Domej W, Oettl K, Renner W. Oxidative stress and free radicals in COPD-implications and relevance for treatment[J]. Int J Chron Obstruct Pulmon Dis, 2014, 9:1207-1224. |
| [19] | Cho HY, Kleeberger SR. Nrf2 protects against airway disorders[J]. Toxicol Appl Pharmacol, 2010, 244:43-56. |
| [20] | Shi Ji, Meng AM, Hou Q. Sirtuin 1 and lung disease[J]. Acta Pharm Sin (药学学报), 2012, 47:417-420. |
| [21] | Kensler TW, Wakabayashi N, Biswal S. Cell survival responses to environmental stresses via the Keap1-Nrf2-ARE pathway[J]. Annu Rev Pharmacol Toxicol, 2007, 47:89-116. |
| [22] | Cantin AM, Richter MV. Cigarette smoke-induced proteostasis imbalance in obstructive lung diseases[J]. Curr Mol Med, 2012, 12:836-849. |
| [23] | Soares H, Marinho HS, Real C, et al. Cellular polarity in aging:role of redox regulation and nutrition[J]. Genes Nutr, 2013, 9:371. |
| [24] | Guan SP, Tee W, Ng DS, et al. Andrographolide protects against cigarette smoke-induced oxidative lung injury via augmentation of Nrf2 activity[J]. Br J Pharmcol, 2013, 168:1707-1718. |
| [25] | Ma Q. Role of Nrf2 in oxidative stress and toxicity[J]. Annu Rev Pharmcol Toxicol, 2013, 53:401-426. |
| [26] | Garbin U, Pasini AF, Stranieri C, et al. Cigarette smoking blocks the protective expression of Nrf2/ARE pathway in peripheral mononuclear cells of young heavy smokers favouring inflammation[J]. PLoS One, 2009, 4:e8225. |
| [27] | Boutten A, Goven D, Boczkowski J, et al. Oxidative stress targets in pulmonary emphysema:focus on the Nrf2 pathway[J]. Expert Opin Ther Targets, 2010, 14:329-346. |
| [28] | Ishii Y, Itoh K, Morishima Y, et al. Transcription factor Nrf2 plays a pivotal role in protection against elastase-induced pulmonary inflammation and emphysema[J]. J Immunol, 2005, 175:6968-6975. |
| [29] | Hu G, Zhong N, Ran P. Air pollution and COPD in China[J]. J Thorac Dis, 2015, 7:59-66. |
| [30] | Simons F. Allergic rhinobronchitis:the asthma-allergic rhinitis link[J]. J Allergy Clin Immunol, 1999, 104:534-540. |
| [31] | Umetsu DT, Mclntire JJ, Akbari O, et al. Asthma:an epidemic of dysregulated immunity[J]. Nat Immunol, 2002, 3:715-720. |
| [32] | Deng X, Rui W, Zhang F, et al. PM2.5 induces Nrf2-mediated defense mechanisms against oxidative stress by activating PIK3/AKT signaling pathway in human lung alveolar epithelial A549 cells[J]. Cell Biol Toxicol, 2013, 29:143-157. |
| [33] | Li N, Wang M, Barajas B, et al. Nrf2 deficiency in dendritic cells enhances the adjuvant effect of ambient ultrafine particles on allergic sensitization[J]. J Innate Immunol, 2013, 5:543- 554. |
| [34] | Li YJ, Kawada T, Azuma A. Nrf2 is a protective factor against oxidative stresses induced by diesel exhaust particle in allergic asthma[J]. Oxid Med Cell Longev, 2013, 2013:323607. |
| [35] | Yu J, Shi J, Gong L, et al. Role of Nrf2/ARE pathway in protective effect of electroacupuncture against endotoxic shock-induced acute lung injury in rabbits[J]. PLoS One, 2014, 9:e104924. |
| [36] | Tsushima K, King LS, Aggarwal NR, et al. Acute lung injury review[J]. Intern Med, 2008, 48:621-630. |
| [37] | Mehla K, Balwani S, Agrawal A, et al. Ethyl gallate attenuates acute lung injury through Nrf2 signaling[J]. Biochimie, 2013, 95:2404-2414. |
| [38] | Kim KH, Kim DH, Jeong N, et al. Therapeutic effect of Chung-Pae, an experimental herbal formula, on acute lung inflammation is associated with suppression of NF-κB and activation of Nrf2[J]. Evid Based Complement Alternat Med, 2013, 2013:659459. |
| [39] | Kim KH, Kwun MJ, Han CW, et al. Suppression of lung inflammation in an LPS-induced acute lung injury model by the fruit hull of Gleditsia sinensis[J]. BMC Complement Altern Med, 2014, 14:402. |
| [40] | Magesh S, Chen Y, Hu L. Small molecule modulators of Keap1-Nrf2-ARE pathway as potential preventive and therapeutic agents[J]. Med Res Rev, 2012, 32:687-726. |
| [41] | Dai SM. Recent advances in the study of oxidative stress in the treatment of chronic obstructive pulmonary disease[J]. Guide China Med (中国医药指南), 2013, 11:74-76. |
| [42] | Sandberg M, Patil J, D'Angelo B, et al. NRF2-regulation in brain health and disease:implication of cerebral inflammation[J]. Neuropharmacology, 2014, 79:298-306. |
| [43] | Wang S, Penchala S, Prabhu S, et al. Molecular basis of traditional Chinese medicine in cancer chemoprevention[J]. Curr Drug Discov Technol, 2010, 7:67-75. |
| [44] | Ramyaa P, Krishnaswamy R, Padma VV. Quercetin modulates OTA-induced oxidative stress and redox signaling in HepG2 cells-up regulation of Nrf2 expression and down regulation of NF-κB and COX-2[J]. Biochim Biophys Acta, 2014, 1840:681-692 |
| [45] | Balogun E, Hoque M, Gong P, et al. Curcumin activates the haem oxygenase-1 gene via regulation of Nrf2 and the antioxidant-responsive element[J]. Biochem J, 2003, 371:887-895. |
| [46] | Lee YJ, Song JH, Oh MH, et al. ERK1/2 activation in quercetin-treated BEAS-2B cell plays a role in Nrf2-driven HO-1 expression[J]. Mol Cell Toxicol, 2011, 7:347-355. |
| [47] | Donnelly LE, Newton R, Kennedy GE, et al. Anti-inflammatory effects of resveratrol in lung epithelial cells:molecular mechanisms[J]. Am J Physiol Lung Cell Mol Physiol, 2004, 287:L774-L783. |
| [48] | Kode A, Rajendrasozhan S, Caito S, et al. Resveratrol induces glutathione synthesis by activation of Nrf2 and protects against cigarette smoke-mediated oxidative stress in human lung epithelial cells[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294:L478-L488. |
| [49] | Chen CY, Jang JH, Li MH, et al. Resveratrol upregulates heme oxygenase-1 expression via activation of NF-E2-related factor 2 in PC12 cells[J]. Biochem Biophys Res Commun, 2005, 331:993-1000. |
| [50] | Sajish M, Schimmel P. A human tRNA synthetase is a potent PARP1-activating effector target for resveratrol[J]. Nature, 2015, 519:370-373. |
| [51] | Sussan TE, Rangasamy T, Blake DJ, et al. Targeting Nrf2 with the triterpenoid CDDO-imidazolide attenuates cigarette smoke-induced emphysema and cardiac dysfunction in mice[J]. Proc Natl Acad Sci USA, 2009, 106:250-255. |
| [52] | Wang YY, Yang YX, Zhe H, et al. Bardoxolone methyl (CDDO-Me) as a therapeutic agent:an update on its pharmacokinetic and pharmacodynamic properties[J]. Drug Des Dev Ther, 2014, 8:2075-2088. |
| [53] | Hur W, Gray NS. Small molecule modulators of antioxidant response pathway[J]. Curr Opin Chem Biol, 2011, 15:162-173. |
| [54] | Surh YJ, Kundu JK, Na HK. Nrf2 as a master redox switch in turning on the cellular signaling involved in the induction of cytoprotective genes by some chemopreventive phytochemicals[J]. Planta Med, 2008, 74:1526-1539. |
| [55] | Wong DP, Wells G, Hagen T. Heteroaromatic 4-arylquinols are novel inducers of nuclear factor-erythroid 2-related factor 2(Nrf2)[J]. Eur J Pharmacol, 2010, 643:188-194. |
| [56] | Saso L, Firuzi O. Pharmacological applications of antioxidants:lights and shadows[J]. Curr Drug Targets, 2014, 15:1177-1199. |
| [57] | Rahman I. Pharmacological antioxidant strategies as therapeutic interventions for COPD[J]. Biochim Biophys Acta, 2012, 1822:714-728. |
| [58] | Rahman I, MacNee W. Antioxidant pharmacological therapies for COPD[J]. Curr Opin Pharmacol, 2012, 12:256-265. |
 2015, Vol. 50
2015, Vol. 50


