2. 青海大学 医学院, 青海 西宁 810001
2. Medical College, Qinghai University, Xining 810001, China
高原是指海拔高度一般在1 000 m以上、面积广大、地形开阔、周边以明显陡坡为界的大面积隆起地区,目前国际上普遍认为海拔高于1 500 m时机体才出现一定的生理学反应。高原环境具有低氧、低气 压、强辐射、寒冷、干燥等基本特点,其中低氧是影响人类生命活动的主要因素。根据海拔高度高原缺氧分为轻度缺氧 (1 500~2 500 m)、中度缺氧 (2 500~4 500 m) 和重度缺氧 (4 500~5 500 m),海拔越高,大气压越低,氧分压也越低。随着大气氧分压降低,吸入气和肺泡气氧分压降低,经肺泡弥散入血的氧减少,动脉血氧分压和氧饱和度降低,引起低氧血症,导致组织缺氧[1]。缺氧引起的机体一系列功能、代谢和结构的改变是高原特有疾病或病理过程的病理生理学基础。
高原低氧对机体的血液系统、循环系统、神经 系统、内分泌系统和物质代谢等有显著影响,导致机体脏器功能、代谢和结构发生改变,形成高原特有疾病 (高原病),如急性缺氧引起高原反应、高原肺水肿和脑水肿,慢性缺氧引起红细胞增多症和心血管疾病[2, 3]。高原低氧对机体功能和代谢的影响在各个水平和层次上均有表现,其影响的程度和结果,除了与海拔高度有关外,还取决于进入高原的速度、停留的时间以及机体的功能代谢状态。缓慢进入低海拔高 原时,主要以代偿性反应为主,而快速进入较高海拔高原时,主 要引起组织、细胞代谢障碍和系统功能紊乱[4, 5]。
高原低氧研究主要集中在高原病防治、高原营 养和高原适应等方面[6, 7],20世纪80年代以来高原低氧对药物体内代谢的影响引起广泛关注,低氧条件下机体产生一系列生理性变化,部分为病理性变化,这些变化影响药物在体内的吸收、分布、代谢和排泄,导致药物代谢动力学特征发生改变[8, 9, 10]。近年来高原活动明显增多,在高原急、慢性缺氧环境中,如何对急进高原和久居高原人群合理用药逐渐成为研究热点。
本文综述了高原低氧对药物代谢的影响,阐述了高原低氧条件下部分药物的代谢特征及药物代谢酶活性和表达的变化,并探讨了相关机制,旨在为高原地区合理用药提供参考依据。
1 高原低氧对药物代谢动力学的影响高原低氧影响药物的代谢动力学特征,通过相关研究可以有效掌握药物在体内治疗间隔和效果的变化。不同药物的代谢途径和代谢机制存在差异,但是由于药物的体内生物转化是一个耗氧的过程,在缺氧条件下,肝脏的代谢能力受到限制,多数药物生物转化率降低,清除率受到影响。Powell等[11]发现慢性阻塞性肺疾病、肺水肿、肺性心脏病和心功能衰竭病人中茶碱的清除率 (CL) 降低30%~60%,这些疾病都与急性缺氧有关,所以推测茶碱CL的降低归因于低氧,这一观点已得到证实[12]。急性缺氧家兔和家犬体内的研究也表明茶碱和地尔硫䓬的CL降低[13, 14]。近年来相关研究逐渐增多,大鼠急进4 010 m高原后,普萘洛尔的药-时曲线下面积 (AUC)、平均驻留时间 (MRT)、半衰期 (t1/2)、峰浓度 (Cmax) 均显著增大,CL、表观分布容积 (Vd) 均显著降低[15]。大鼠急进 4 300 m高原后,阿莫西林的AUC、MRT、Cmax均显著增大,CL显著降低[16]。Anjana等[17]和Shefali等[18]通过模拟急性缺氧条件,在相当于4 572 m海拔高度处,发现乙酰水杨酸、庆大霉素、苯巴比妥和乙酰唑胺在家兔体内的MRT和t1/2均增大,消除速率常数(Ke) 均降低; 在相当于7 620 m海拔高度处,布洛芬在大鼠体内的MRT和t1/2分别显著增大42% 和51%。Du Souich等[19]探讨了低氧血症、高碳酸血症以及二者相结合时对苯妥英钠药代动力学的影响,发现其他条件均不改变药代动力学特征,但低氧血症组家兔苯妥英钠的CL降低50%。
人体与动物体内药物代谢酶的活性和水平存在一定差异,药物的代谢途径及代谢产物也不完全相同,导致高原低氧环境中药物的人体代谢水平出现不同结果,有些药物清除率降低,有些药物增加,甚至个别药物在急、慢性缺氧试验中出现了双向结果。平原志愿者急进4 500 m高原后,茶碱和维拉帕米的CL等参数未改变,提示急性缺氧对两种药物的体内代谢无影响[20]。本课题组发现磺胺甲噁唑在急进和久居3 800 m高原健康志愿者体内的吸收和代谢发生明显变化,主要表现为CL降低、t1/2延长[8]。Arancibia等[9, 21]在平原志愿者急进3 600 m高原和在此高原地区生活6个月后,探讨了呋塞米和泼尼松龙的药物动力学特征,结果显示高原急、慢性缺氧均使呋塞米Cmax降低,急性缺氧条件下呋塞米AUC、Vd和CL均减少,而慢性缺氧条件下呋塞米的AUC、Vd和CL反而增大,其原因是否与高原低氧影响肾功能和改变体液pH值有关还需进一步去探讨。高原急、慢性缺氧分别使泼尼松龙的AUC增大12.8% 和13.5%,Cmax增大16.9% 和14.1%,而Vd降低20.4% 和15.6%,CL降低25.2% 和1 5.6%。人体试验提示,除了年龄、性别、饮食、个人体质等外,缺氧时间与缺氧程度也是影响高原低氧环境下药物在人体内代谢的重要因素。
种族差异导致同一药物在不同种族人群安全性、疗效、剂量和给药方案的不同,在高原低氧环境下,机体的生理性变化和身体状况存在一定差异,遗传因素和生活习惯也不相同,导致药物代谢存在一定差异。本课题组通过比较平原汉族、世居高原汉族和藏族志愿者体内磺胺甲噁唑的药代动力学特征,发现磺胺甲噁唑在高原世居汉族和藏族健康男性志愿者体内的药物代谢动力学均发生显著变化,主要表现为t1/2延长、CL降低; 高原世居藏族组磺胺甲噁唑的AUC比高原世居汉族组显著降低10.8%,其他参数无显著性差异[22]。
综上,除个别药物外,在高原低氧特殊环境中大部分药物的体内代谢减慢,表现为MRT、t1/2、AUC升高,Ke、CL降低。不同药物在高原低氧环境下药代动力学参数的变化见表 1。
|
|
表 1 高原低氧条件下药物药动学参数的变化. -: 无变化; ↑: 升高; ↓: 降低; △: 慢性缺氧; *: 人体试验 (未标注者为动物试验) |
CYP450酶系是一个由庞大基因家族编码调控的氧化酶系统,其主要亚型酶有CYP1A2、CYP2A6、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4、CYP3A5等。90 %以上药物由CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP2E1及CYP3A4代谢,其中CYP3A4是人体中最重要的药物代谢酶,代谢50 %以上的药物[23, 24]。
茶碱是最早用于研究低氧影响药物代谢的药物之一,体内主要由P450同工酶CYP1A代谢,低氧影响药物代谢酶的研究始于P450酶系。Proulx等[25]发现家兔在急性缺氧8 h后,CYP450酶的含量降低而 活性没有变化,但24 h后含量和活性均降低,提示低氧对CYP450酶活性的影响与机体缺氧时间有关,较短时间内机体存在代偿性反应,CYP450酶活性变化不明显。Kurdi等[26]以低压氧舱模拟高原低氧环境,急性缺氧48 h后家兔P450酶的活性和表达发生明 显变化,CYP1A1活性显著降低、CYP1A1和CYP1A2蛋白表达降低约20%,而CYP3A6蛋白表达升高50%。Fradette等[27]在相同实验条件下的研究也显 示,急性缺氧显著降低CYP1A1和CYP1A2蛋白和基因表达,而CYP3A6和CYP3A11的蛋白和基因表达显著提高。另外研究还发现,在低氧条件下,大鼠和家兔体内P450同工酶CYP2B4、CYP2B6、CYP2C5、CYP2C9、CYP2C16和CYP2C19活性和表达均显著降低[28, 29]。
本课题组利用高原实际环境研究发现,高原急、慢性缺氧导致CYP1A2的活性、蛋白和mRNA表达均显著降低,其中2 800 m海拔急、慢性缺氧CYP1A2的活性分别降低62.3% 和60.8%,蛋白表达分别降低60.4% 和62.0%,mRNA表达分别降低51.1% 和32.9%。4 300 m海拔急、慢性缺氧CYP1A2的活性分别降低60.8% 和53.8%,蛋白表达分别降低65.8% 和64.8%,mRNA表达分别降低37.2% 和30.7%[30]。CYP2D6 的研究显示,2 800 m海拔和4 300 m海拔慢性缺氧使CYP2D6的活性和表达均显著升高,但两个海拔急 性缺氧对CYP2D6的活性和表达无影响。在CYP2E1和CYP3A4的研究中也发现了同样的现象,急性缺氧无影响,但两个海拔慢性缺氧使CYP2E1、CYP3A4的活性和表达均显著降低,其中中度海拔CYP2E1 活性、蛋白和mRNA表达分别降低60.2%、33.9% 和56.0%,高海拔分别降低44.2%、35.5% 和52.0%; 中度海拔CYP3A4活性、蛋白和mRNA表达分别降低43.2%、39.7% 和31.1%,高海拔分别降低50.1%、27.5% 和31.7%[30, 31]。高原急慢性缺氧不影响CYP2C9和CYP2C19的蛋白表达,4 300 m海拔急性缺氧仅使CYP2C19的活性升高117.6%[30, 32]。CYP2D6、CYP2E1和CYP3A4的研究结果提示,高原慢性缺氧是影响代谢酶活性和表达的重要因素。
以上研究结果显示,低氧对动物体内CYP450 酶活性和表达的影响有一定的争议,除CYP2C9和CYP2C19外,较为一致的结果是CYP1A1、CYP1A2、CYP2E1和CYP3A4的活性和表达降低,CYP3A6和CYP2D6的活性和表达升高,见表 2。
|
|
表 2 高原低氧条件下药物代谢酶活性和表达的变化. -: 无变化; ↑: 升高; ↓: 降低; +: 有争议; △: 慢性缺氧 |
同一种酶在人体和动物存在一定差异,Jürgens等[33]在人体进行了CYP450亚型酶的相关研究,发现平原志愿者急进4 559 m高原后,CYP2D6和CYP3A4活性均有所降低,回到平原地区后两种酶的活性升高,在此实验条件下,CYP1A2和CYP2C19活性无变化。
2.2 其他药物代谢酶高原低氧影响药物代谢酶的研究主要集中在P450酶系,近年来陆续才有少量其他代谢酶的报道。本课题组研究发现大鼠从低海拔 地区(400 m) 急进4 600 m高原后,N-乙酰基转移 酶2 (NAT2) 活性显著降低38.7%[10, 34]。后续研究进一步证实高原急性缺氧显著降低大鼠NAT2的活性和表达,但慢性缺氧无影响。2 800 m高原急性缺氧使大鼠NAT2的活性和mRNA表达分别降低23.1% 和55.8%,4 300 m高原急性缺氧分别降低28.6% 和19.5%[30]。Shefali等[18]利用低压舱模拟7 620 m高原研究发现,大鼠急 性缺氧6 h和24 h后,谷胱甘肽巯基转移酶 (GSTs) 活性分别显著降低15% 和23%。人体试验同样存在一定差异,低氧条件下葡糖醛酸转移酶(UGTs) 的活性没有降低[35]。
高原环境导致代谢酶活性和表达的改变与部分酶底物药物代谢变化特征一致,如低氧使CYP1A2、CYP2B6、CYP2C9、CYP2C19和NAT2活性和表达降低,其底物茶碱、苯妥英钠、布洛芬和磺胺甲噁唑在高原环境中的代谢减慢,提示在高原低氧环境中这些药物的给药剂量应适当减少[36]。
3 高原低氧对细胞因子和核受体的影响低氧影响药物代谢酶的相关机制还处于探索阶段,早期认为低氧使血液在内脏器官重分布,肝血流量降低,阻止药物向肝脏的传递,导致药物消除减慢[37],但Du Souich等[38]在急、慢性缺氧家犬体内发现利多卡因代谢产物的清除率降低,而肝、肾血流量并未发生改变,提示在低氧条件下,药物清除率的降低与肝、肾血流量之间无因果关系。目前主要从细胞因子和核受体两个方面开展相关机制研究。
3.1 细胞因子低氧对P450的影响与急性炎症反应引起P450酶活性的变化相似,唯一例外的是炎症反应使CYP3A下调,而低氧使其上调[39]。在炎症家兔体内发现白介素6 (IL-6) 是P450酶活性降低的血清调节剂,白介素1β (IL-1β)、肿瘤坏死因子 (TNF)、干扰素γ(IFN-γ) 也有较弱的类似作用[40, 41, 42]。低氧促进细胞因子IL、TNF、IFN、促红细胞生成素 (EPO)、低氧诱导因子1 (HIF-1) 的释放[43, 44, 45],激活酪氨酸蛋白激酶 (PTK)、蛋白激酶C (PKC)、丝裂原活化蛋白激酶 (MAPK) 信号转导途径,使HIF-1和激活子蛋白-1 (AP-1) 激活和核易位,进而调节P450酶的活性和表达[28, 46]。
体外实验证实,对照家兔肝细胞与急性缺氧家兔的血清孵育24 h后,CYP1A1、1A2活性和表达下调,而CYP3A6活性和表达上调,孵育体系中分别加入IFN-γ、IL-1β等调节因子的抗体时,CYP1A1、1A2的下调和CYP3A6的上调受到抑制,提示IL-1β、IL-2β、IFN-γ是CYP1A1、1A2下调的调节因子,而CYP3A6上调主要与EPO有关[27],另外也发现低氧能激活HIF-1与CYP3A6核苷酸探针的结合而对其活性进行调节[28]。
低氧调节多种基因的表达以改善血液运输和细胞代谢,这些影响部分是通过HIF-1转录激活剂来调节的[47, 48]。HIF-1由α、β亚单位组成,其中HIF-1β是芳香羟受体核易位子 (ARNT),不受低氧影响,但能与芳香羟受体 (AhR) 形成二聚体易位至核内,结合并激活相应的靶基因[38]。低氧条件下CYP1A1、1A2的向下调节与HIF-1α有关。HIF-1α在有氧细胞中的表达水平甚低,甚至检测不到,但在缺氧状态下,HIF-1α水平迅速升高,并优先与HIF-1β形成二聚体,使得HIF-1β/AhR二聚体减少。在机体内Ahr被组成性激活,CYP1A1/1A2被组成性表达,通过低氧激活HIF-1使HIF-1β/AhR异源二聚体的形成减少,并降低CYP1A的表达[46, 49]。
哺乳动物ARD1可以使HIF-1α乙酰化,从而促进HIF-1α的降解,但低氧条件下,ARD1被抑制,有利于HIF-1α的稳定[50]。Fisher等[51]研究显示人类ARD1蛋白的水平在低氧条件下未降低,也不会使HIF-1α乙酰化。以上研究结果能否解释低氧条件下人体和动物体内药物代谢的差异还有待进一步证实。
另外,Rahman等[52]认为CYP1A表达的下调除与IL-1β有关,还与NO增多有关。 此外,低氧对CYP450的调节也与P-糖蛋白、激活蛋白-1的激活有关[29]。
3.2 核受体近年来,在外源性化合物影响CYP450依赖性代谢的机制方面取得了重要进展,并且外源性化合物诱导肝脏CYP450同工酶表达的机制研究上有了突破性发现,确定了3个主要的核受体超家族成员: 孕烷X受体 (PXR)、组成型雄烷受体 (CAR) 和过氧化物酶体增殖体激活受体 (PPAR)。研究表明,PXR是CYP3A基因表达调控的关键转录因子,CAR则主要调节CYP2B、CYP1A及CYP3A的基因转录[53, 54]。基因敲除实验证实,PXR和CAR两种通路都能调控CYP2C9、CYP2C19和CYP2C18的表达[55, 56]。另外,Ⅱ相代谢酶中除了UGT1A1是由PXR和CAR共同调控外,大部分UGT1A是由PXR调控[57]。研究证 实,低氧使PXR和CAR的表达均降低,并进一步调节CYP450的活性和表达[58, 59]。有关高原低氧对PXR和CAR介导的CYP450的转录调节作用,本课题组正在进行深入研究。
血清中细胞因子与核受体对低氧条件下药物代谢酶的调节机制,如图 1所示。
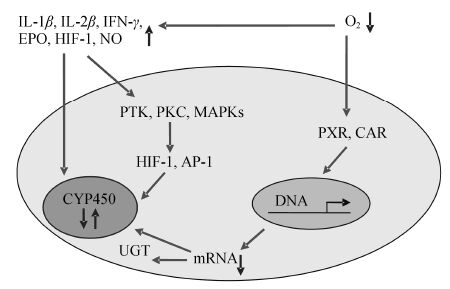
|
图 1 低氧条件下细胞因子与核受体对药物代谢酶的调节机制 |
低氧影响药物代谢酶的相关机制主要围绕CYP1A1、CYP1A2和CYP3A6进行探讨,其他药物代谢酶活性和表达的变化机制还有待进一步去研究。
4 存在问题及展望近年来,人类高原活动日益频繁,平原机体急进高原后形成急性缺氧并几乎不可避免地面临高原反应甚至高原疾病,关注高原急救、高原地区驻防和救灾官兵的防护及高原常住人群的个体化用药,逐渐成为医学和药学研究人员关注的重点。在高原环境中,研究药物代谢酶的特点及相关机制,以及如何对急进高原和久居高原人群进行合理有效的用药将是未来研究的热点。
高原低氧对药物代谢的影响是高原医学和药物代谢研究的一个新方向,目前主要集中在急性低氧和CYP450酶系,且大多采用低压氧舱模拟高原环 境,难以全面客观反映高原实际环境。高原低氧影响药物代谢的研究虽在P450酶及其相关药物方面取 得一定的研究成果,但目前仍处于探索阶段,存在很大研究空间,今后应从以下几方面进行深入研究。
前期研究主要集中在大鼠、家兔等哺乳动物,而动物与人体的药物代谢存在一定差别,应重视人体试验,分别探讨高原急慢性缺氧的影响及机制。全球有3 800万人长期生活在高原慢性缺氧环境中,相比急进高原人群,久居和世居高原人群是未来研究的重点。另外,高原地区居住的少数民族较多,如青藏高原青海地区有藏、回、土、撒拉、蒙古等5个世居少数民族,由于遗传因素和生活习惯的不同,不同民族间的药物代谢差异也应引起重视。
采用急性缺氧模型或低压氧舱只能模拟低氧,难以模拟低温、强辐射、干燥等,无法反映高原的真实环境。机体进入高原并生活较长时间后才能形成慢性缺氧,受试验条件的限制,缺氧模型适合模拟急性缺氧,很难模拟慢性缺氧。另外,无论采用何种交通工具,从平原进入高原都需要一定的时间,使得机体有个适应过程,即低氧通过外周化学感受器,间接刺激呼吸中枢引起早期通气增加,机体可吸入更多的氧气以进行代偿。缺氧模型没有适应过程,所以应以高原实际环境为实验场所,克服模拟环境的局限性, 综合低氧、低压、强辐射和寒冷等各种因素考察高原特殊环境下药物代谢的变化。
氨茶碱、地塞米松、呋塞米、乙酰唑胺等是治疗急性高原疾病的常用药物,前期研究较多,今后除加强这些药物的人体验证试验外,应重视防治慢性高原疾病的心血管类药物在高原低氧环境中的代谢动力学研究,为高原地区合理用药提供更多的参考依据。药物代谢酶活性和表达方面,目前主要集中在CYP450酶系,除CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4等主要同工酶外,应扩大研究范围,重视对其他CYP450同工酶及NAT2、UGT、UST等Ⅱ相代谢酶的研究。
目前主要围绕细胞因子的调节进行机制研究,应综合病理学、细胞生物学以及分子生物学,在细胞信号传导和基因调控水平上深入探讨高原低氧环境中的药物代谢机制。
| [1] | West JB. High-altitude medicine[J]. Am J Respir Crit Care Med, 2012, 186:1229-1237. |
| [2] | Eide RP, Asplund CA. Altitude illness:update on prevention and treatment[J]. Curr Sports Med Rep, 2012, 11:124-130. |
| [3] | Zafren K. Prevention of high altitude illness[J]. Travel Med Infect Dis, 2014, 12:29-39. |
| [4] | Netzer N, Strohl K, Faulhaber M, et al. Hypoxia-related altitude illnesses[J]. J Travel Med, 2013, 20:247-255. |
| [5] | Simon RB, Simon DA. Illness at high altitudes[J]. Nursing, 2014, 44:36-44. |
| [6] | Imray C, Wright A, Subudhi A, et al. Acute mountain sickness:pathophysiology, prevention, and treatment[J]. Prog Cardiovasc Dis, 2010, 52:467-484. |
| [7] | Pennardt A. High-altitude pulmonary edema:diagnosis, prevention, and treatment[J]. Curr Sports Med Rep, 2013, 12:115-119. |
| [8] | Li XY, Gao F, Li ZQ, et al. Comparison of the pharmacokinetics of sulfamethoxazole in male Chinese volunteers at low altitude and acute exposure to high altitude versus subjects living chronically at high altitude:an open-labeled, controlled, prospective study[J]. Clin Ther, 2009, 31:2744-2754. |
| [9] | Arancibia A, Gai MN, Chávez J, et al. Pharmacokinetics of prednisolone in man during acute and chronic exposure to high altitude[J]. Int J Clin Pharm Ther, 2005, 43:85-91. |
| [10] | Li XY. Pharmacokinetics Study of Sulfamethoxazole Under Hypoxia Environment at High Altitude (高原低氧环境中磺胺甲噁唑的药物动力学研究)[D]. Shenyang:Shenyang Pharmaceutical University, 2010. |
| [11] | Powell JR, Vozeh S, Hopewell P, et al. Theophylline disposition in acutely ill hospitalized patient[J]. Am Rev Respir Dis, 1978, 118:229-238. |
| [12] | Richer M, Lam YW. Hypoxia, arterial pH and theophylline disposition[J]. Clin Pharmacokinet, 1993, 25:283-299. |
| [13] | Letarte L, Du Souich P. Influence of hypercapnia and/or hypoxemia and metabolic acidosis on theophylline kinetics in conscious rabbits[J]. Am Rev Respir Dis, 1984, 129:762- 766. |
| [14] | Du Souich P. Effect of hypercapnia acute and chromic moderate hypoxia on diltiazem kinetics and metabolism in the dog[J]. Pharmacology, 1993, 47:378-385. |
| [15] | Zhang JH, Wang R, Xie H, et al. Effect of acute exposure to high altitude on pharmacokinetics of propranolol and metoprolol in rats[J]. J South Med Univ (南方医科大学学报), 2014, 34:1616-1620. |
| [16] | Zhang JH, Wang R, Xie H, et al. Effects of aminophylline on the pharmacokinetic parameters at high altitude[J]. Pharm J Chin PLA (解放军药学学报), 2014, 30:125-131. |
| [17] | Anjana GV, Krishna K, Joginder D. Effect of intermittent hypobaric hypoxia on efficacy and clearance of drug[J]. Indian J Med Res, 2012, 135:211-216. |
| [18] | Shefali G, Gaurav KK, Asheesh G. Hepatic metabolism of ibuprofen in rats under acute hypobaric hypoxia[J]. Exp Toxicol Pathol, 2013, 65:751-758. |
| [19] | Du Souich P. Effect of hypercapnia and/or hypoxemia and metabolic acidosis on kinetics and concentration of phenytoin in the cerebrospinal fluid of conscious rabbits[J]. Neuropharmacology, 1986, 25:857-862. |
| [20] | Streit M, Goggelmann C, Dehnert C, et al. Cytochrome P450 enzyme-mediated drug metabolism at exposure to acute hypoxia (corresponding to an altitude of 4500 m)[J]. Eur J Clin pharmacol, 2005, 61:39-46. |
| [21] | Arancibia A, Nella Gai M, Paulos C, et al. Effects of high altitude exposure on the pharmacokinetics of furosemide in healthy volunteers[J]. Int J Clin Pharm Ther, 2004, 42:314- 320. |
| [22] | Li XY, Liu YN, Li YP, et al. Pharmacokinetic study of sulfamethoxazole in healthy Han volunteers living at plain and native Han and Tibetan healthy volunteers living at high altitude[J]. Acta Pharm Sin (药学学报), 2011, 46:1117- 1122. |
| [23] | Preissner SC, Hoffmann MF, Preissner R, et al. Polymorphic cytochrome P450 enzymes (CYPs) and their role in personalized therapy[J]. PLoS One, 2013, 8:e82562. |
| [24] | Sevrioukova IF, Poulos TL. Understanding the mechanism of cytochrome P4503A4:recent advances and remaining problems[J]. Dalton Trans, 2013, 42:3116-3126. |
| [25] | Proulx M, Du Souich P. Acute moderate hypoxia in conscious rabbits:effect on hepatic cytochrome P450 and on reactive oxygen species[J]. J Pharm Pharmacol, 1995, 47:392-397. |
| [26] | Kurdi J, Maurice H, El-Kadi AO, et al. Effect of hypoxia alone or combined with inflammation and 3-methylcholanthrene on hepatic cytochrome P450 in conscious rabbits[J]. Br J Pharmacol, 1999, 128:365-373. |
| [27] | Fradette C, Yamaguchi N, Du Souich P. 5-Hydroxytryptamine is biotransformed by CYP2C9, 2C19 and 2B6 to hydroxylamine, which is converted into nitric oxide[J]. Br J Pharmacol, 2004, 141:407-414. |
| [28] | Fradette C, du Souich P. Hypoxia-inducible factor-1 and activator protein-1 modulate the upregulation of CYP3A6 induced by hypoxia[J]. Br J Pharmacol, 2003, 140:1146- 1154. |
| [29] | Fradette C, Batonga J, Teng S, et al. Animal models of acute moderate hypoxia are associated with a down-regulation of CYP1A1, 1A2, 2B4, 2C5, and 2C16 and up-regulation of CYP3A6 and P-glycoprotein in liver[J]. Drug Metab Dispos, 2007, 35:765-771. |
| [30] | Li XY, Wang XJ, Li YP, et al. Effect of exposure to acute and chronic high-altitude hypoxia on the activity and expression of CYP1A2, CYP2D6, CYP2C9, CYP2C19 and NAT2 in rats[J]. Pharmacology, 2014, 93:76-83. |
| [31] | Li XY, Wang XJ, Li YP, et al. The activity, protein, and mRNA expression of CYP2E1 and CYP3A1 in rats after exposure to acute and chronic high altitude hypoxia[J]. High Alt Med Biol, 2014, 15:491-496. |
| [32] | Li XY, Liu YN, Yuan M, et al. The effect of high altitude hypoxia on the activity and protein expression of CYP2C9 and CYP2C19[J]. Acta Pharm Sin (药学学报), 2012, 47:188- 193. |
| [33] | Jürgens G, Christensen HR, Loft S, et al. Acute hypoxia and cytochrome P450-mediated hepatic drug metabolism in humans[J]. Clin Pharmacol Ther, 2002, 71:214-220. |
| [34] | Yang M, Zhu JB, Li YP, et al. The effect of high altitude hypoxia on NAT2 activity in rats[J]. J Qinghai Med Coll (青海医学院学报), 2013, 34:79-83. |
| [35] | Hao Y, Wang R, Xie H, et al. Influence of plateau environment on enzyme activity of cytochrome-P450 in drug metabolism and its progress[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2013, 27:898-902. |
| [36] | Du Souich P, Fradette C. The effect and clinical consequences of hypoxia on cytochrome P450, membrane carrier proteins activity and expression[J]. Expert Opin Drug Metab Toxicol, 2011, 7:1083-1100. |
| [37] | Roth RA Jr, Rubin RJ. Role of blood flow in carbon monoxide and hypoxic hypoxia-induced alterations in hexobarbital metabolism in rats[J]. Drug Metab Dispos, 1976, 4:460-467. |
| [38] | Du Souich P, Saunier C, Hartemann D, et al. Effect of acute and chronic moderate hypoxia on the kinetics of lidocaine and its metabolites and on regional blood flow[J]. Pulm Pharmacol, 1992, 5:9-16. |
| [39] | Frandette C, Bleau AM, Pichette V, et al. Hypoxia-induced down-regulation of CYP1A1/1A2 and up-regulation of CYP3A6 involves serum mediators[J]. Br J Pharmacol, 2002, 137:881-891. |
| [40] | Morgan ET. Impact of infectious and inflammatory disease on cytochrome P450-mediated drug metabolism and pharmacokinetics[J]. Clin Pharmacol Ther, 2009, 85:434-438. |
| [41] | Morgan ET. Regulation of cytochrome p450 by inflammatory mediators:why and how[J]. Drug Metab Dispos, 2001, 29:207-212. |
| [42] | Morgan ET, Li-Masters T, Cheng PY. Mechanisms of cytochrome P450 regulation by inflammatory mediators[J]. Toxicology, 2002, 181-182:207-210. |
| [43] | Merry HE, Phelan P, Doaks M, et al. Functional roles of tumor necrosis factor-alpha and interleukin 1-beta in hypoxia and reoxygenation[J]. Ann Thorac Surg, 2015, 99:1200- 1205. |
| [44] | Cokic BB, Cokic VP, Suresh S, et al. Nitric oxide and hypoxia stimulate erythropoietin receptor via MAPK kinase in endothelial cells[J]. Microvasc Res, 2014, 92:34-40. |
| [45] | Wenger RH. Cellular adaptation to hypoxia:O2-sensing protein hydroxylases, hypoxia-inducible transcription factors, and O2-regulated gene expression[J]. FASEB J, 2002, 16:1151-1162. |
| [46] | Eunjung L, Sujin Y, Seung KL, et al. Two transactivation domains of hypoxia-inducible factor-1alpha regulated by the MEK-1-p42-p44 MAPK pathway[J]. Mol Cells, 2002, 14:9-15. |
| [47] | Bigham AW, Lee FS. Human high-altitude adaptation:forward genetics meets the HIF pathway[J]. Genes Dev, 2014, 28:2189-2204. |
| [48] | Ji LD, Qiu YQ, Xu J, et al. Genetic adaptation of the hypoxia-inducible factor pathway to oxygen pressure among eurasian human populations[J]. Mol Biol Evol, 2012, 29:3359-3370. |
| [49] | Park H. A romatic hydrocarbon nuclear translocator as a common component for the hypoxia- and dioxin-induced gene expression[J]. Mol Cells, 1999, 9:172-178. |
| [50] | Arnesen T, Kong X, Evjenth R, et al. Interaction between HIF-1 alpha (ODD) and hARD1 does not induce acetylation and destabilization of HIF-1 alpha[J]. FEBS Lett, 2005, 579:6428-6432. |
| [51] | Fisher TS, Etages SD, Hayes L, et al. Analysis of ARD1 function in hypoxia response using retroviral RNA interference[J]. J Biol Chem, 2005, 280:17749-17757. |
| [52] | Rahman MS, Thomas P. Effects of hypoxia exposure on hepatic cytochrome P4501A (CYP1A) expression in Atlantic croaker:molecular mechanisms of CYP1A down-regulation[J]. PLoS One, 2012, 7:e40825. |
| [53] | Handschin C, Meyer UA. Induction of drug metabolism:the role of nuclear receptors[J]. Pharmacol Rev, 2003, 55:649-673. |
| [54] | Tien ES, Eegishi M. Nuclear receptors CAR and PXR in the regulation of hepatic metabolism[J]. Xenobiotica, 2006, 36:1152-1163. |
| [55] | Chen Y, Ferguson SS, Negishi M, et al. Induction of human CYP2C9 by rifampicin hyperforin and phenobarbital is mediated by the pregnane X receptor[J]. J Pharmacol Exp Ther, 2004, 308:495-501. |
| [56] | Hu BF, Bi HE, Huang M. Advances in the research of pregnane X receptor and constitutive androstane receptor[J]. Acta Pharm Sin (药学学报), 2011, 46:1173-1177. |
| [57] | Vyhlidal CA, Pogan PK, Leeder JS. Development and refinement of pregnane X receptor (PXR) DNA binding site model using information theory:insights into PXR-mediated gene regulation[J]. Biol Chem, 2004, 279:46779-46786. |
| [58] | Legendre C, Hori T, Loyer P, et al. Drug-metabolising enzymes are down-regulated by hypoxia in differentiated human hepatoma HepaRG cells:HIF-lα involvement in CYP3A4 repression[J]. Eur J Cancer, 2009, 45:2882-2892. |
| [59] | Fradette C, Du Souich P. Effect of hypoxia on cytochrome P450 activity and expression[J]. Curr Drug Metab, 2004, 5:257-271. |
 2015, Vol. 50
2015, Vol. 50


