白藜芦醇 (resveratrol, RES) 是一种从葡萄皮、虎杖和桑葚等植物中提取得到的重要植物抗毒素。近年来的药理学研究表明, 白藜芦醇具有明确的抑制癌细胞生长; 降血脂、防治心血管疾病; 抗氧化、延缓衰老等药理作用, 被喻为继紫杉醇之后的又一新的绿色抗癌药物[1, 2]。但由于白藜芦醇在水中的溶解度低, 且药物极易在胃肠道及肝脏内被代谢, 使得其口服生物利用度低, 应用受到限制[3, 4]。因此, 选择合适的纳米递药系统, 提高药物溶解度, 降低口服首过效应和改善生物利用度是解决问题的关键。
作为一种新型的药物递送载体, 聚合物胶束在难溶药物口服给药系统的研究中受到了广泛的关注。聚合物胶束是当聚合物浓度大于临界胶束浓度 (critical micelle concentration, CMC) 时, 在水性介质中自发形成的热力学稳定体系, 具有独特的核壳结构[5, 6]。由疏水链组成的胶束内核可以作为疏水药物的储库, 提高药物在水溶液中的溶解度, 避免其在生物环境中失活。同时, 由亲水链形成的亲水外壳, 可起到空间稳定作用, 并避免网状内皮系统的识别, 延长胶束在体内的循环时间[7, 8]。其中, 由聚氧乙烯 (PEO)−聚氧丙烯 (PPO)−聚氧乙烯 (PEO) 组成的三嵌段共聚物泊洛沙姆以其低毒、低免疫原性和生物相容性好的优点, 在胶束载药领域的研究中倍受青睐。由此类材料自组装形成的纳米粒, 通常粒径小于100 nm, 可以增强在病灶组织的滞留蓄积效应[9, 10]。此外, 以泊洛沙姆材料为载体的递药系统还具有抑制P-糖蛋白外排和逆转肿瘤多药耐药的活性[11−13]。目前, 以阿霉素为模型药物的泊洛沙姆181/407混合胶束 (SP1049C) 作为首个抗癌胶束制剂已经处于临床试验阶段[14]。由此可见, 泊洛沙姆类聚合物作为一种理想的药物载体材料, 有广阔的应用前景。
近年来, 由不同性质聚合物组成的混合胶束逐渐发展并替代由单一聚合物形成的胶束体系[14, 15]。这是因为具有较高比例疏水链的聚合物如泊洛沙姆401、403等虽然具有较大体积的疏水内核, 易于溶解较多的疏水性药物, 但由于亲水链所占比例较低, 往往造成这类胶束具有较薄的亲水外壳, 使得粒子在溶液环境中易聚集, 稳定性差[16]。相反, 亲水链比例较高的聚合物如泊洛沙姆407、188等由于具有较高的临界胶束浓度值, 往往面临载药量低、药物易泄露等诸多问题。因此将两种或两种以上的泊洛沙姆材料混合制备的胶束可弥补单一胶束稳定性差、载药量低和稀释不稳定等缺陷, 为聚合物给药系统的研究提供了新思路[17]。
尽管许多新型的纳米制剂如固体脂质纳米粒、脂质体等已多次用于提高白藜芦醇溶解度和口服生物利用度的实验研究, 但由于自身结构的限制, 这些纳米制剂的载药量较低, 一般只有1%~6%[18, 19]。聚合物胶束虽然具有更高的载药能力, 但目前关于白藜芦醇胶束制剂的研究也仅限于单纯的胶束, 难以同时满足载药量高、包封率大和稳定性好的制剂学要求[20−22]。因此, 本实验将白藜芦醇包载于由偏疏水的泊洛沙姆403 (poloxamer 403, P403) 与偏亲水的泊洛沙姆407 (poloxamer 407, P407) 联合制备的混合胶束中, 期望既可发挥P403高载药量和高包封率的优势, 又可通过联合具有较高亲水链比例的P407增加胶束的空间稳定性, 从而实现白藜芦醇的高负载、高稳定性和缓慢释放。
材料与方法 材料泊洛沙姆403 (Sigma-Aldrich公司); 泊洛沙姆407 (巴斯夫公司); 十二烷基硫酸钠 (sodium dodecyl sulfate, SDS, 安徽山河药用辅料股份有限公司); 白藜芦醇 (纯度≥99.7%, 西安冠宇生物技术有限公司); 8-苯胺-1-萘磺酸 (8-anilino-1-naphthalenesulfonic acid, ANS, 东京化成工业株式会社); 其余试剂均为分析纯。
聚合物胶束的制备采用薄膜水化法制备胶 束[23]。按不同的质量比称取总量270 mg的P403和P407, 加无水乙醇3 mL使其溶解。称取适量的RES溶于该无水乙醇溶液中, 涡旋5 min使其混合均匀, 将混合溶液转移至50 mL茄形瓶中, 50 ℃下旋转蒸发0.5 h除去有机溶剂, 得到透明的半固体膜, 之后真空干燥过夜除去残留溶剂。向旋蒸瓶内加入蒸馏水6 mL, 在35 ℃下水化45 min, 得到载药的聚合物胶束分散液, 将该溶液用0.45 μm微孔滤膜过滤, 得到透明胶束溶液。空白聚合物胶束除处方中不添加药物外, 其余制备方法同上。
白藜芦醇P403-P407混合胶束的表征 胶束的载药量和包封产率测定采用反相高效液相色谱法测定胶束的载药量和包封产率。色谱条 件如下[18]: 拓普C18色谱柱 (5 μm, 200 mm × 4.6 mm); 流动相比例为乙腈−水 (40∶60, v/v), 流速1.0mL·min−1; 紫外检测器, 检测波长为306 nm。精密吸取胶束溶液100 μL, 加入无水乙醇稀释20倍, 使胶束溶解以释放药物, 将上述药物溶液稀释到适宜浓度, 于10 000 r·min−1离心10 min, 取上清液20 μL进样, 测定药物峰面积, 根据标准曲线计算药物浓度 (A = 1.996 3 C + 0.017, r = 0.999 9), 并按照下述公式计算载药量 (drug loading, DL) 和包封产率 (encapsulation yield, EY):
DL=[Wm/(Wc+Wf)]×100%
EY=(Wm/Wf)×100%
其中, Wm为胶束中药物质量, Wc为载体质量, Wf为投药量。
聚合物胶束粒径及粒径分布的测定采用马尔文纳米粒度仪Nano-ZS90以动态光散射法测定胶束粒径大小及其分布。仪器散射角为90°, 波长633 nm, 测试的温度为 (25 ± 0.5) ℃, 每个样品平行测量3次。
空白胶束临界胶束浓度的测定以ANS为荧光探针, 用稳态荧光法测定空白载体P403及混合体系 (P403∶P407=0.34∶0.66) 的CMC值。精密称取ANS 7.5 mg于25 mL量瓶中, 用无水乙醇溶解并稀释至刻度, 摇匀, 得1.01×10−3 mol·L−1的ANS储备液。取空白胶束溶液适量, 用蒸馏水稀释成一系列不同浓度的空白胶束溶液。精密吸取ANS储备液100 μL至具塞玻璃试管中, 经N2吹干后, 将上述一系列空白胶束溶液分别加入这些试管中至总体积2 mL, ANS的终浓度为5×10−5 mol·L−1; 另取ANS储备液100 μL, N2吹干后, 加蒸馏水至2 mL, 设定为标准溶液。将这些溶液涡旋15 min后避光静置过夜, 用梅特勒荧光分光光度计测定荧光值。测定方法为固定激发波长为360 nm, 扫描发射光谱, 记录发射波长460 nm处的峰强。
胶束的稀释稳定性考察胶束的稀释稳定性是通过测定经模拟胃液 (pH 1.20 HCl) 和模拟肠液 (0.05mol·L−1, pH 6.86 PBS) 稀释后的胶束粒径变 化和稀释后胶束中药物剩余百分含量来评价[24]。将载药的P403-P407混合胶束经模拟胃液和模拟肠液分别稀释5倍和10倍后置于37 ℃的恒温振荡器中, 以100 r·min−1振摇48 h后, 取样过滤, 收集续滤液, 测定粒径和载药量, 并计算药物的剩余百分含量。
载药胶束体外释放行为研究采用透析法考察白藜芦醇胶束的体外释放行为。取载药胶束溶液1 mL置于截留分子质量为3 500 Da的透析袋内, 平行3份, 在温度为37 ℃、转速为100 r·min−1的漏槽条件下, 研究药物从胶束中的释放行为, 释放介质为含2% SDS (w/v) 的模拟人工胃液和模拟人工肠液30 mL。在固定时间点取出释放介质1 mL, 并补充相同体积和温度的空白介质。释放介质经高速离心后取上清液, HPLC法测定RES的含量, 计算累积释放百分率, 并绘制胶束释放曲线。
数据统计分析平行实验所得数据均采用x±s表示。对稀释稳定性实验采用t-检验进行显著性差异分析, 显著水平为P < 0.05。
结果与讨论 1 星点设计效应面法优化混合胶束的制备在采用星点设计优化处方前, 首先通过单因素实验考察了旋蒸温度、有机溶剂种类、P407质量百分比、水化介质用量和投药量对药物包封产率、载药量和胶束粒径的影响。根据单因素考察结果, 固定有机溶剂为乙醇, 旋蒸温度为50 ℃, 水化温度为35 ℃, 以RES用量、水化介质用量和P407含量, 对包封产率、载药量和粒径影响较为显著的因素作为考察对象。采用3因素、5水平的星点设计−效应面法优化处方, 取值范围见表 1。
|
|
Table 1 Factors and levels for poloxamer 403/407 mixed micelles optimization |
P403-P407载药混合胶束星点设计试验安排和结果见表 2。对取值越大越好的载药量、包封产率或取值越小越好的胶束粒径, 采用Hassan方法分别进行数学转换求归一值 (d)。其计算公式如下[25]:
$ {d_1}或{d_2} = \frac{{{Y_i} - {Y_{{\rm{min}}}}}}{{{Y_{\max }} - {Y_{{\rm{min}}}}}}\;\;\;\;\;\;\;\;\;{d_3} = \frac{{{Y_{\max }} - {Y_i}}}{{{Y_{\max }} - {Y_{{\rm{min}}}}}} $
|
|
Table 2 Matrix of the experiments and results for the measured responses of the mixed micelles |
公式中, d1、d2、d3分别代表胶束的载药量、包封产率和粒径的归一值。其中, Yi为实测值, Ymin与Ymax是实验中载药量、包封产率或粒径的最小值和最大值。各指标“归一值”求算几何平均数, 得总评归一值 (overall desirability, OD), 公式如下:
OD=(d1×d2×d3)1/3
用Design-Expert 8.0.5b分析软件, 对各因素进行二次多项式拟合, 根据拟合方程绘制描述OD与各因素之间关系的三维效应面图 (其他自变量设为中心点值), 选取优化工艺条件, 制备载药胶束并进行预测分析。
从星点设计的结果看, 总评归一值可以很好地拟合成二次多项式方程, 且有较高的相关系数 (r = 0.93, P < 0.05) , 方程如下:
$ \begin{array}{*{20}{l}} {OD = 0.80 + 0.052{X_1} - 0.059{X_2} - 0.013{X_3} + 0.052{X_1}{X_2} + }\\ \begin{array}{l} \;\;\;\;\;\;\;\;\;0.010{X_1}{X_3} + 1.090E - 003{X_2}{X_3} + 4.101E - 004{X_1}^2 - \\ \;\;\;\;\;\;\;\;\;0.073{X_2}^2 - 0.027{X_3}^2 \end{array} \end{array} $
在上述方程中, X1为P407含量, X2为投药量, X3为水化介质体积。效应面法优化的结果如下: X1 = 65.81%, X2 = 44.4 mg, X3 = 6.19 mL (图 1a、b、c)。
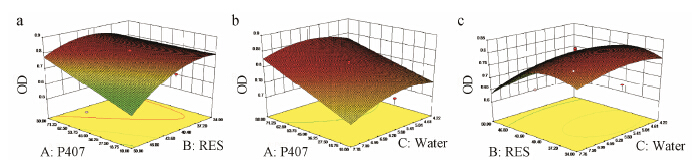 | Figure 1 Predicted response surface plots of resveratrol (RES) loaded poloxamer 403/407 mixed micelles.a: The amount of water was fixed at 6 mL; b: The amount of RES was fixed at 42 mg; c: The percent of poloxamer 407 was fixed at 45%. OD: Overall desirability |
在优化条件下对试验进行了验证, 星点设计的实测值和预测值偏差为2.46%, 所以星点设计可较好地预测白藜芦醇载药胶束的处方制备工艺, 具有良好的适用性。最优处方的载药量和包封产率分别为11.78% 和82.51%。在混合胶束中, 药物的溶解度高达5.92 mg·mL−1, 这与药物本身溶解度 (0.03 mg·mL−1) 相比, 提高了197倍左右。最优处方的粒径较小, 约为24 nm。图 2是混合胶束的粒径分布图, 可以看出胶束呈单峰分布, 表明胶束粒径分布较均匀。
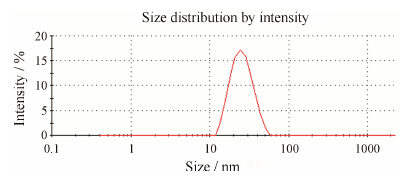 | Figure 2 Size distribution of resveratrol loaded poloxamer 403/407 mixed micelles |
P403和P403-P407混合胶束CMC测定以ANS为荧光探针, 经360 nm处激发后, 发射光谱中会在460 nm附近出现发射峰, 其中发射峰的荧光强度依赖于探针分子所处环境的极性, 当极性越低时, 荧光强度值越大 [26, 27]。因此, 可用荧光强度值的突变来测定表面活性剂CMC。
以ANS在460 nm处的荧光强度值为纵坐标, 聚合物浓度对数logC为横坐标作图。由图 3可见, 单一P403和P403-P407混合体系的CMC分别为0.03和0.05 mg·mL−1, 与文献报道一致 (0.02~0.06 mg·mL−1)[15, 25]。结果表明, 混合胶束组的荧光强度值均低于P403组, 这是因为P407的加入增加了胶束的极性, 使得荧光强度值降低。同样地, 由于P407亲水性很强, 形成胶束的能力较弱的缘故, 混合胶束的CMC值略高于P403。
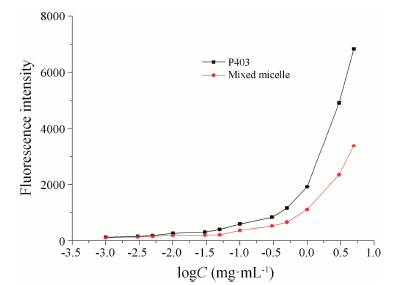 | Figure 3 Fluorescence intensity profile for 8-anilino-1- naphthalenesulfonic acid (5×10−5 mol·L−1) at 298 K in different polymers solutions of pure poloxamer 403 and poloxamer 403/ 407 mixed system (n = 3) |
对于口服递药系统来说, 胃肠道中复杂的pH环境及稀释作用很容易对药物产生破坏作用, 因此考察混合胶束的胃肠液稀释稳定性是非常必要的[28]。分别用人工胃肠液稀释5倍和10倍后, 于37 ℃水浴孵化48 h, 测定粒径和药物剩余百分含量。如图 4所示[23, 25], 经模拟胃液和模拟肠液稀释后, 胶束的剩余药物含量均大于90%, 与稀释前的载药量无显著性差异 (P > 0.05)。结果表明混合胶束具有很强的热力学稳定性, 这可能与混合胶束较低的CMC值相关, 使得聚合物胶束在一定程度上能够抵御溶液的稀释。经稀释后, 胶束粒径略有增加, 但与稀释前粒径相比无明显变化 (P > 0.05), 说明胶束的结构经稀释后基本保持稳定, 这可能与混合胶束的组成有关。图 5是P403和P407混合胶束的结构示意图, 具有相同疏水链结构的P403和P407易于形成具有协同作用的胶束, 在生理环境中被体液稀释后, 不容易解离, 稳定性好[29, 30]。另外, P403和P407相间排列的亲水链增加了混合胶束的固有水化层厚度, 克服了单一P403胶束壳水化层较薄的弊端, 有助于保护胶束内核不受稀释的破坏, 增强胶束的空间稳定性。
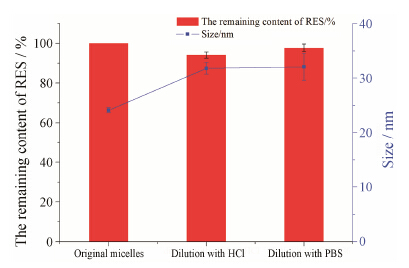 | Figure 4 Stability of mixed micelles upon dilution with HCl (pH 1.20) and PBS (pH 6.86) for 5 and 10 times separately (n = 3) |
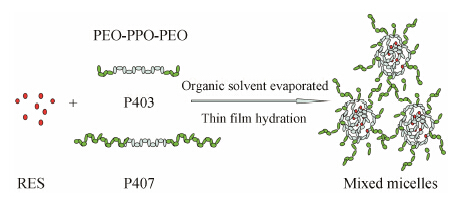 | Figure 5 Schematic illustration of resveratrol-loaded micelles composed of poloxamer 403 and poloxamer 407 |
P403-P407混合胶束 (比例为0.34∶0.66) 的体外释放见图 6。由图可见, 白藜芦醇溶液在人工肠液中, 1 h内即可释放90% 以上, 表明透析袋对药物没有截留作用。 通常, 胃的排空时间为1~2 h, 肠排空时间约3~4 h[31, 32], 由释放结果可见, 混合胶束在模拟胃肠液的漏槽条件下, 4 h内药物释放均不高于25%, 表明在胃肠道中胶束基本保持完整, 可有效避免药物被胃肠液降解, 有利于胶束以完整形态透膜吸收, 增强药效[33, 34]。分别采用零级、一级和Higuchi方程对载药胶束的释放曲线进行了释放动力学拟合, 结果表明, Higuchi方程能很好地描述胶束释放行为。混合胶束在模拟胃液和模拟肠液的释放动力学方程分别为: y/y∞ = 0.146 t1/2 − 0.053 8 (r = 0.980 2) 和y/y∞ = 0.156 t1/2 − 0.062 7 (r = 0.984 9)。
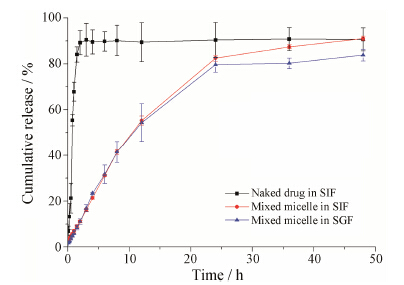 | Figure 6 The in vitro release profile of resveratrol from poloxamer 403/407 mixed micelles in simulated gastric fluid (SGF) and simulated intestinal fluid (SIF) at 37 ℃ (n = 3) |
混合胶束的缓释效果好可能是由于多酚类化合物白藜芦醇可以通过氢键作用与P403和P407的羟基键紧密结合[35], 从而使胶束在模拟胃肠液中能缓慢释放药物, 并且其较小的粒径可增加胃肠黏膜的摄取, 有利于提高药物的口服吸收。
结论采用星点设计效应面法优化制备的P403-P407混合胶束不仅对难溶性药物白藜芦醇具有较高的载药量和包封产率, 而且胶束均匀、粒径小和CMC值较小。胶束在模拟胃液和模拟肠液中稀释稳定, 且在漏槽条件下均能缓慢释放药物, 对白藜芦醇口服给药系统的研究具有重要意义。为了确认制剂的安全性和有效性, 仍需继续完善一系列药理学、药动学和药效学方面的实验。
| [1] | Singh G, Pai RS. Recent advances of resveratrol in nanostructured based delivery systems and in the management of HIV/AIDS [J]. J Control Release, 2014, 194: 178-188. |
| [2] | Zhang YH, Guo JG, Guo ZH, et al. Involvement of p38-p53 signal pathway in resveratrol-induced apoptosis in MCF-7 cells [J]. Acta Pharm Sin (药学学报), 2011, 46: 1332-1337. |
| [3] | Wenzel E, Somoza V. Metabolism and bioavailability of trans-resveratrol [J]. Mol Nutr Food Res, 2005, 49: 472-481. |
| [4] | Planas JM, Alfaras I, Colom H, et al. The bioavailability and distribution of trans-resveratrol are constrained by ABC transporters [J]. Arch Biochem Biophys, 2012, 527: 67-73. |
| [5] | Chen D, Ding PT, Deng YH, et al. Advances in the study of polymeric micelles used in oral administration [J]. Acta Pharm Sin (药学学报), 2010, 45: 560-564. |
| [6] | Kim S, Shi Y, Kim JY, et al. Overcoming the barriers in micellar drug delivery: loading efficiency, in vivo stability, and micelle-cell interaction [J]. Expert Opin Drug Del, 2010, 7: 49-62. |
| [7] | Jokerst JV, Lobovkina T, Zare RN, et al. Nanoparticle PEGylation for imaging and therapy [J]. Nanomedicine, 2011, 6: 715-728. |
| [8] | Mao SR, Tian Y, Wang LL. Research progress on drug nanocontainer-polymeric micelles [J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2010, 27: 979-986. |
| [9] | Dahmani FZ, Yang H, Zhou J, et al. Enhanced oral bioavailability of paclitaxel in pluronic/LHR mixed polymeric micelles: preparation, in vitro and in vivo evaluation [J]. Eur J Pharm Sci, 2012, 47: 179-189. |
| [10] | Tian Y, Mao SR. Amphiphilic polymeric micelles as the nanocarrier for peroral delivery of poorly soluble anticancer drugs [J]. Expert Opin Drug Del, 2012, 9: 687-700. |
| [11] | Zhang W, Shi Y, Chen YZ, et al. Multifunctional Pluronic P123/F127 mixed polymeric micelles loaded with paclitaxel for the treatment of multidrug resistant tumors [J]. Biomaterials, 2011, 32: 2894-2906. |
| [12] | Guan YB, Huang JG, Zuo L, et al. Effect of Pluronic P123 and F127 block copolymer on P-glycoprotein transport and CYP3A metabolism [J]. Arch Pharm Res, 2011, 34: 1719- 1728. |
| [13] | Li D, Sheng L, Li Y. Methods for the study of drug transporters [J]. Acta Pharm Sin (药学学报), 2014, 49: 963- 970. |
| [14] | Chen LC, Sha XY, Jiang XY, et al. Pluronic P105/F127 mixed micelles for the delivery of docetaxel against Taxol-resistant non-small cell lung cancer: optimization and in vitro, in vivo evaluation [J]. Int J Nanomedicine, 2013, 8: 73-84. |
| [15] | Zhao LY, Du JC, Duan YW, et al. Curcumin loaded mixed micelles composed of Pluronic P123 and F68: preparation, optimization and in vitro characterization [J]. Colloid Surf B Biointerfaces, 2012, 97: 101-108. |
| [16] | Lee ES, Oh YT, Youn YS, et al. Binary mixing of micelles using Pluronics for a nano-sized drug delivery system [J]. Colloid Surf B Biointerfaces, 2011, 82: 190-195. |
| [17] | Kulthe SS, Inamdar NN, Choudhari YM, et al. Mixed micelle formation with hydrophobic and hydrophilic Pluronic block copolymers: implications for controlled and targeted drug delivery [J]. Colloid Surf B Biointerfaces, 2011, 88: 691-696. |
| [18] | Pandita D, Kumar S, Poonia N, et al. Solid lipid nanoparticles enhance oral bioavailability of resveratrol, a natural polyphenol [J]. Food Res Int, 2014, 62: 1165-1174. |
| [19] | Narayanan NK, Nargi D, Randolph C, et al. Liposome encapsulation of curcumin and resveratrol in combination reduces prostate cancer incidence in Pten knockout mice [J]. Int J Cancer, 2009, 125: 1-8. |
| [20] | Amri A, Chaumeil JC, Sfar S, et al. Administration of resveratrol: what formulation solutions to bioavailability limitations? [J]. J Control Release, 2012, 158: 182-193. |
| [21] | Lu XW, Ji CB, Xu H, et al. Resveratrol-loaded polymeric micelles protect cells from Aβ-induced oxidative stress [J]. Int J Pharm, 2009, 375: 89-96. |
| [22] | Carlson LJ, Cote B, Alani AWG, et al. Polymeric micellar co-delivery of resveratrol and curcumin to mitigate in vitro doxorubicin-induced cardiotoxicity [J]. J Pharm Sci, 2014, 103: 2315-2322. |
| [23] | Gao Y, Li LB, Zhai GX. Preparation and characterization of Pluronic/TPGS mixed micelles for solubilization camptothecin [J]. Colloid Surf B Biointerfaces, 2008, 64: 194-199. |
| [24] | Zhang W, Shi Y, Chen YZ, et al. The potential of Pluronic polymeric micelles encapsulated with paclitaxel for the treatment of melanoma using subcutaneous and pulmonary metastatic mice models [J]. Biomaterials, 2011, 32: 5934-5944. |
| [25] | Zhang W, Hao JG, Shi Y, et al. Paclitaxel-loaded Pluronic P123/F127 mixed polymeric micelles: formulation, optimization and in vitro characterization [J]. Int J Pharm, 2009, 376: 176- 185. |
| [26] | Mohanty ME, Rao VJ, Mishra AK. A fluorescence study on the interaction of telmisartan in triblock polymers pluronic P123 and F127 [J]. Spectrochim Acta A Mol Biomol Spectrosc, 2014, 121: 330-338. |
| [27] | Vasilescu M, Bandula R, Lemmetyinen H. Micropolarity and microviscosity of Pluronics L62 and L64 core-shell aggregates in water at various concentrations and additives examined by absorption and fluorescence probes [J]. Colloid Polym Sci, 2010, 288: 1173-1184. |
| [28] | Owen SC, Chan DPY, Shoichet MS. Polymeric micelle stability [J]. Nano Today, 2012, 7: 53-65. |
| [29] | Chaibundit C, Ricardo NMPS, Costa VdMLL, et al. Micellization and gelation of mixed copolymers P123 and F127 in aqueous solution [J]. Langmuir, 2007, 23: 9229-9236. |
| [30] | Chiappetta DA, Sosnik A. Poly(ethylene oxide)-poly(propylene oxide) block copolymer micelles as drug delivery agents: improved hydrosolubility, stability and bioavailability of drugs [J]. Eur J Pharm Biopharm, 2007, 66: 303-317. |
| [31] | Hurst S, Loi CM, Brodfuehrer J, et al. Impact of physiological, physicochemical, and biopharmaceutical factors in absorption and metabolism mechanisms on the drug oral bioavailability of rats and humans [J]. Expert Opin Drug Metab Toxicol, 2007, 3: 469-489. |
| [32] | Sawamoto T, Haruta S, Kurosaki Y, et al. Prediction of the plasma concentration profiles of orally administered drugs in rats on the basis of gastrointestinal transit kinetics and absorbability [J]. J Pharm Pharmacol, 1997, 49: 450-457. |
| [33] | Gaucher G, Satturwar P, Jones MC, et al. Polymeric micelles for oral drug delivery [J]. Eur J Pharm Biopharm, 2010, 76: 147-158. |
| [34] | Plapied L, Duhem N, des Rieux A, et al. Fate of polymeric nanocarriers for oral drug delivery [J]. Curr Opin Colloid Int Sci, 2011, 16: 228-237. |
| [35] | Parmar A, Singh K, Bahadur A, et al. Interaction and solubilization of some phenolic antioxidants in Pluronic® micelles [J]. Colloid Surf B Biointerfaces, 2011, 86: 319-326. |
 2015, Vol. 50
2015, Vol. 50


