2. 青龙高科技股份有限公司, 江西 宜春 336000
2. Qinglong High-Tech Co., Ltd., Yichun 336000, China
光动力学疗法 (photodynamic therapy, PDT) 由于其良好的靶向性、微创性和安全性, 已成为肿瘤治疗中的一种常规方法[1]。光敏剂是PDT的核心和关键, Photofrin作为第一个应用于临床的卟啉类光敏 剂, 至今仍是抗癌PDT的临床首选药物。但Photofrin及其仿制品 (如俄罗斯的Photogem、中国喜泊分等) 均存在组分复杂、质量不可控、皮肤光毒性较强等缺陷[2, 3], 其主要原因在于它们都是由许多卟啉衍生物组成的混合制剂, 有效成分不明确, 没有合适的分析方法控制产品质量。鉴于Photofrin已有很好的临床应用基础, 从中找出其有效成分, 无疑是开发新光敏剂的捷径, 为此必须建立能同时检测多种卟啉衍生物的科学适用的分析检测方法, 从而在新型光敏剂的研究开发中发挥导向作用。
文献 [4, 5, 6, 7, 8, 9, 10, 11]曾有报道用高效液相色谱法检测卟啉类光敏剂, 但这些方法或条件要求苛刻, 或只适用于某种卟啉衍生物, 对于不同类型的卟啉衍生物的分析效果尚不够理想。作者建立了一种新的HPLC分析方法, 发现了Photofrin中的微量有效成分, 并以此为基础自主开发了化学结构单一、抗癌光敏活性强、暗毒性低的新型卟啉类光敏剂“华卟啉钠”。同时, 用此方法检测一些已上市以及正在研发中的卟啉类光敏剂, 均显示很好的结果。本方法不仅适用于卟啉类化合物的鉴别和纯度检查, 也可进行卟啉类光敏剂的含量测定。
材料与方法试剂和仪器
甲醇 (液相色谱级, 100.0%) 购买自J. T. Baker公司 (美国制造); 冰乙酸 (分析纯, 99.5%) 购自北京化工厂; 娃哈哈饮用纯净水由杭州娃哈哈集团生产; 其他试剂均为分析纯。高效液相色谱系统采用安捷伦1200系列 (CA, USA), 该系统配有G1311A四元液相色谱泵, G1329A ALS自动进样器, G1316A柱温箱和G1315D检测器。色谱柱型号为Shiseido Capcell PAK C18 MG (150 mm × 4.6 mm, 5 μm)。电子天平HA202M由日本生产; 无菌注射器购自上海康寿医疗器械有限公司; 微孔过滤器购自天津津腾实验设备有限公司。
样品的制备
样品用甲醇溶解制成0.5 mg·mL−1的溶液 (用于杂质检查) 或加水制成0.05 mg·mL−1的溶液 (用于含量测定)。疏水性的样品用氯仿溶解。分析前用微孔过滤器过滤, 取续滤液进样20 μL。
色谱条件
Shiseido Capcell PAK C18 (150 mm × 4.6 mm, 5 μm) 为色谱柱, 柱温箱30 ℃。二极管阵列检测器检测波长380 nm。流动相A为1% 冰乙酸水溶液, 流动相B为甲醇, 流速1.000 mL·min−1。梯度洗脱程序: 0~30 min, 70%~90% B; 30~45 min, 90% B; 45~60 min, 90%~100% B; 60~70 min, 100% B; 70~70.5 min, 100%~70% B; 70.5~100.5 min, 70% B。
方法学研究
线性和标准曲线 取浓度约1.00 mg·mL−1的标准溶液储备液, 依次稀释到0.05、0.20、0.50、0.80和1.00 mg·mL−1, 分别进样, 以峰面积 (Y) 相对于分析物 (X) 的浓度绘制标准曲线, 进行线性回归。
检测限和定量限 用信噪比 (S/N) 法确定本方法的检测限 (S/N > 3) 和定量限 (S/N > 10)。将0.5 mg·mL−1的华卟啉钠溶液渐次反复稀释并测定。
溶液稳定性 配制好的样品溶液置于冰箱中 (2~8 ℃) 避光保存, 历时24 h, 其中分别于不同存放时间点 (0、2、4、6、8、10、12和24 h) 取样分析。
精密度 取样品适量, 用甲醇配制成含0.5 mg·mL−1的溶液6份, 每份样品溶液连续进样2次, 测定精密度。
回收率 取已经测定含量的样品溶液, 分为3份, 分别加入相当于样品含量80%、100% 和120% 的标准溶液, 再用甲醇稀释到10 mL, 分别进样并计算回收率。
重复性 对测定条件进行变动 [变化范围分别是: 柱温 (30 ± 5) ℃、检测波长 (380 ± 5) nm、流动相pH 2.56~2.96、流速 (1.0 ± 0.2) mL·min−1], 测定同一份样品改变前后结果的RSD%。
各类卟啉衍生物样品的分析
依照上述操作方法逐一分析了Photofrin、Photogem、光卟啉、喜泊分、血卟啉醚酯、HPPH以及作者开发的新药华卟啉钠等样品。
结果1 方法学考察
1 1.1 专属性
如图 1, 其中tR 43.8 min是主成分华卟啉钠。主成分可以与原料、中间体和工艺杂质实现完全分离, 主成分峰的峰纯度 > 990, 与相邻杂质峰的分离度大于2.0。另外, 原料药华卟啉钠经高温、强酸和强碱破坏后, 所产生的降解产物也可以被分离和检测。
 | Figure 1 Chromatogram of sinoporphyrin sodium (tR 43.8 min) |
结果显示, 在0.050 7~1.014 mg·mL−1内具有良好的线性关系, 相关系数为0.999 5。
1.3 检测限和定量限
结果显示, 本方法的检测限和定量限分别为0.73和4.71 μg·mL−1。
1.4 溶液稳定性 结果表明, 各时间点主峰和总杂质峰的相对标准偏差 (RSD%) 均小于2%, 说明华卟啉钠样品溶液在冰箱中 (2~8 ℃) 避光存放24 h基本稳定。但24 h后杂质略有增加。所以, 样品溶液和标准溶液必须每天制备, 并在12 h内使用。
1.5 精密度
结果显示, 主成分测定结果的RSD为0.11%。
1.6 回收率
结果显示, 回收率在97.84%~101.24%, 说明本方法准确度良好。
1.7 重复性
结果显示改变条件前后的RSD均小于2%, 说明上述条件的微小变化不影响测定结果, 方法耐用性良好。
2 生物样品分析
分析结果如图 2。可以看出, Photofrin及其仿制品在本方法条件下均是多种成分的混合物, 难以进行质量控制, 只有新一代的光敏剂HPPH和华卟啉钠为单一化合物, 这也为质量可控、保证疗效奠定了基础。
讨论本方法是在以第一代光敏剂Photofrin为分析对象经多年不断摸索、修正而形成的。其间, 作者参照文献[4−11]报道的各种HPLC方法对Photofrin进行测试, 但多次重复均未能再现文献所报道的分离效果。并且, 文献[4, 5]报道的方法有各种不足之处, 如分离效果较差; 有些属于生物样品测定方法, 不适于药品质量控制[8, 9]; 有的只针对特定类型的卟啉衍生物如单卟啉类[10]; 有的需要使用特殊的色谱柱 (如十八聚乙烯醇聚合物)[7], 或流动相组成较复杂[6, 11]。另外, 总体而言, 文献方法所报道的色谱图从峰形、分离度等方面看均不够理想。目前本文所建立的方法克服了上述方法的不足, 分离度好、专属性强、灵敏度高, 基本可以达到化合物鉴别、纯度检查的要求, 且适用于不同类型的卟啉衍生物, 是迄今为止分析卟啉类光敏剂较为理想的HPLC方法。就分析Photofrin及其仿制品而言, 明显可以看出, 所得色谱峰的数量、峰形和分离度等均优于文献报道, 见图 2a~e。
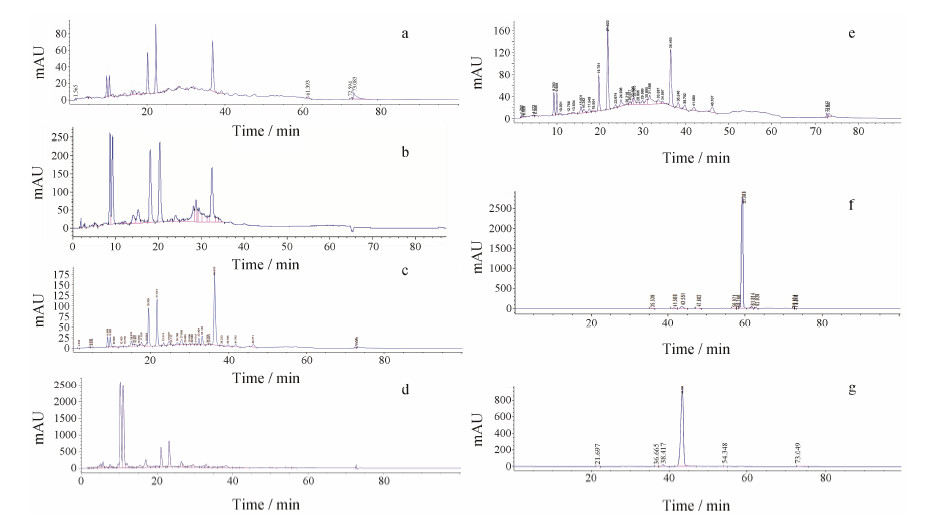 | Figure 2HPLC of some photofrin compounds. a: Photofrin; b: Photogem; c: Photoporphyrin; d: Hiporfin; e: Hematoporphyrin ether ester; f: 2-(1-Hexyloxyethyl)-2-devinylpyropheophorbide-α (HPPH); g: Sinoporphyrin sodium |
本方法的特点是采用梯度洗脱, 分析一个样品的全程约需1 h, 有足够的分离空间, 卟啉类化合物只要在结构上有些微的差别就能得到很好的分离。如Photofrin采用本法分析可出现20多个峰, 且大部分峰有很好的峰形及分离度。该方法不仅可以用于卟啉类光敏剂的鉴别以及纯度检查, 还可以用于定量分析, 对于指导优化合成工艺, 分离纯化反应产物也是必不可少。如与MS和NMR联用, 对推导微量成分的化学结构也有很多裨益。
在HPLC方法引导下, 本课题组对Photofrin中卟啉衍生物进行了系统的化学研究, 并结合动物抗癌光敏活性筛选, 发现Photofrin制剂中, 95% 以上是无效或抗癌光敏活性很弱的成分, 而光敏活性强的有效成分含量很低, 只占总成分的1%~5%。进一步分析后发现, 其抗肿瘤光敏活性很强 (约为Photofrin的
10倍)、而暗毒性低, 测定了化学结构并进行了人工合成[12], 完成了临床前药学研究以及药理学和毒理学研究, 研发出新光敏剂华卟啉钠[13, 14] (sinoporphyrin sodium, 代号: DVDMS, 结构式见图 3), 这也是以分析方法为导向进行新药研发的成功范例。
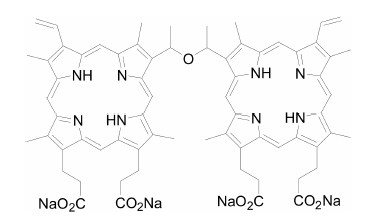 | Bis[1-[6, 7-bis[2-(sodiumcarbonate) ethyl] 1, 3, 5, 8-tetra-methyl-2- vinylporphin-4-yl]-ethyl]ether Figure 3 Structure of sinoporphyrin sodium (C68H66N8O9Na4) |
经过对比以上各种光敏剂的混合制剂的图谱, 发现Photofrin、Photogem的主要成分均出现在39 min以前。在39 min之前虽有很强的峰, 如血卟啉、2(4)- (1-羟乙基)-6,7-二[2-(甲氧甲酰)乙基]-1,3,5,8-四甲基- 4(2)-乙烯基卟啉、原卟啉等均为无效或活性很低的成分[14], 实际有光敏活性的化合物主要出现在39min之后。Photofrin不同批号制剂的HPLC图谱极其近 似, 说明其生产工艺比较稳定。而光卟啉和血卟啉醚酯的HPLC图谱与Photofrin的HPLC图谱相似, 可以推断这二个制剂与Photofrin有类同的效果。而喜泊分的HPLC图谱与Photofrin的HPLC图谱比较相去甚远, 且在39 min之后看不到吸收峰。另外, “喜泊分原料的质量标准为按干燥品计算含总卟啉以血卟啉 (C34H38N4O6) 计, 不得少于70.0%。含血卟啉应为30.0%~50.0%”, 而文献[15]报道血卟啉无抗癌光敏活性。因此用血卟啉含量作为标示成分进行质量控制是不够合理的, 也会影响到临床用药效果。
在对叶绿素卟啉类化合物研究过程中, 本方法对许多半合成的衍生物也均能进行良好的分离, 如同系化合物methyl-2-(1-hexyloxy-ethyl)-2-devinylpheo phorbide-α和methyl-2-(1-pentyloxy-ethyl)-2-devinylpheophorbide-α虽只差一个 -CH2, 但保留时间却相差11 min。而酸和相应的酯保留时间差别很大, 其他如卟啉环上联接的基团不同就更明显。对于卟啉类化合物的羧酸和相应的盐是例外, 那是因为本方法所采用的是酸性溶剂系统, 盐在层析过程中自动解离成酸, 所以羧酸和对应的盐的保留时间是一样的。
结论本文所建立的HPLC分析方法是分析卟啉类光敏剂的一种新的较为理想的方法, 曾对研发新型光敏剂华卟啉钠起到了关键性的引导作用, 同时该方法还可应用于其他类似光敏剂的研究和比对, 只要卟啉类化合物在结构上有微小差别, 使用本方法都可能得到良好的分离效果。对华卟啉钠定量方法的 研究结果可以推断本HPLC分析方法也可适用于其他卟啉类光敏剂的质量监控。
| [1] | Agostinis P, Berg K, Cengel KA, et al. Photodynamic therapy of cancer: an update [J]. CA Cancer J Clin, 2011, 6: 250-281. |
| [2] | Sibata CH, Colussi VC, Oleinick NL, et al. Photodynamic therapy in oncology [J]. Expert Opin Pharmacother, 2001, 2: 917-927. |
| [3] | Jia MG, Zhou JY, Fang QC. Research progress of photodynamic therapy in the treatment of cancer [J]. Chin J Pract Med (中华实用医学杂志), 2004, 4: 1470-1473. |
| [4] | Liu YL, Zhu LZ, Wu P, et al. Chromatographic analysis of hematoporphyrin derivative and its active fractions [J]. Acta Pharm Sin (药学学报), 1984, 19: 706-709. |
| [5] | Liu YL, Hou CY, Yang SL, et al. Comparative studies on physico-chemical properties of four prophyrin photosensitizers [J]. Acta Pharm Sin (药学学报), 1986, 21: 823-828. |
| [6] | Owens JW, Robins M, Robinson R, et al. Chromatographic analysis of photodynamically significant porphyrin dimers and trimer [J]. J Chromatogr B, 1996, 682: 327-336. |
| [7] | Suzuki Y, Tanabe K, Shioi Y. Determination of chemical oxidation products of chlorophyll and porphyrin by high-performance liquid chromatography [J]. J Chromatogr A, 1999, 839: 85-91. |
| [8] | Li P, Sun JG, Huang CR, et al. Determination of hematoporphyrin monomethyl ether in dogs plasma by HPLC using fluorescence detection [J]. Chin J Laser Med Surg (中国激光医学杂志), 2005, 14: 212-216. |
| [9] | Bozek P, Hutta M, Hrivnakova B. Rapid analysis of porphyrins at low ng/l and μg/l levels in human urine by a gradient liquid chromatography method using octadecylsilica monolithic columns [J]. J Chromatogr A, 2005, 1084: 24-32. |
| [10] | Kashiyama Y, Kitazato H, Ohkouchi N. An improved method for isolation and purification of sedimentary porphyrins by high-performance liquid chromatography for compound-specific isotopic analysis [J]. J Chromatogr A, 2007, 1138: 73-83. |
| [11] | Yong Z, He B, Wang X. Determination of hematoporphyrin derivatives injection using HPLC [J]. Acta Acad Med CPAF (武警医学院学报), 2011, 20: 964-984. |
| [12] | Fang QC, Yang D. Ether-linked porphyrin dimer salts and their manufacturing method: CN, 200910179116.5 [P]. 2012-08-29. |
| [13] | Fang QC. Photodynamic therapy for cancer treatment and the new antitumor photosensitizer Sinoporphyrin sodium [J]. Chin J New Drugs (中国新药杂志), 2014, 23: 1540-1545. |
| [14] | Jiang ZH, Shi R, Li C, et al. Inhibitory effects of DVDMS-2-based-photodynamic therapy on the growth of tumor in vitro and in vivo [J]. Carcinogenesis Teratogenesis Mutagenesis (癌变·畸变·突变), 2013, 25: 163-167. |
| [15] | Pandey RK, Smith KM, Dougherty TJ. Porphyrin dimers as photosensitizers in photodynamic therapy [J]. J Med Chem, 1990, 33: 2032-2038. |
 2015, Vol. 50
2015, Vol. 50


