2. 中国药科大学新药研究中心, 江苏 南京 210009
2. Center of Drug Discovery, China Pharmaceutical University, Nanjing 210009, China
新药创新起源于先导物的发现, 而基于结构的理性药物设计是发现先导物的有效方法[1, 2]。在结构多样的药效团中, 具有广泛药理活性的五元杂环酮, 尤其是绕丹宁已成为药物化学的优势骨架而被广泛用于新药分子化学骨架的构建[3], 主要包括5-位活泼亚甲基与醛的缩合反应形成C=C键而构筑的α, β-不饱和酮衍生物 [4, 5, 6, 7], 与此同时, 3-位氨基与羧酸类拼合形成氨基羧酸类或酰胺类等衍生物[8, 9]。另外, 为改善绕丹宁衍生物的水溶性, 在绕丹宁骨架取代基上再引入多酰氨基肽类侧链, 以提高其生物利用度、促进其向成药性发展[10]。近期, 以1-取代-6-氟-喹啉 (萘啶)-4-酮-3-羧酸为抗菌氟喹诺酮药物的优势骨架, 发现氟喹诺酮C-3羧基并非是抗肿瘤活性所必需的药效团, 而且以C-3酰氨基为连接链搭载另一抗肿瘤活性的药效团, 可实现不同药效团的拼合和活性的叠加, 可有效转化其抗菌活性到抗肿瘤活性[11, 12]。然而, 氟喹诺酮骨架与绕丹宁骨架相拼合的酰胺结构修饰尚未见报道。为此, 本研究把具有抗肿瘤活性的绕丹宁α, β-不饱和酮骨架和氟喹诺酮骨架以酰氨基为连接链进行拼合, 进而构建了氟喹诺酮 (绕丹宁α, β-不饱和酮) 酰胺类目标化合物 (5a~5r), 并通过体外抗肿瘤活性筛选, 评价了该类化学结构构建的合理性, 为抗肿瘤氟喹诺酮或绕丹宁化合物分子的进一步设计提供新思路。目标化合物的合成如合成路线1所示。
结果与讨论 1 化学部分环丙沙星 (1) 与甲酸和甲醛发生Eschweiler- Clarke反应生成N-甲基环丙沙星 (2), 然后与80% 的水合肼直接发生肼解反应可方便得到相应的酰肼 (3)[13]。中间体3与双-(羧甲基) 三硫代碳酸酯在异丙醇中发生缩环合反应得N-甲基环丙沙星 (饶丹宁) 酰胺 (4)。芳香醛与4在乙酸钠的催化下在绕丹宁环的5-位引入芳甲叉基构筑绕丹宁α, β-不饱和酮结构。
绕丹宁骨架的构建通常有2条路线[14]: 一是胺类与二硫化碳缩合形成二硫代甲酸盐, 然后与氯乙酸钠发生取代反应后再通过分子内环合而得; 另一条路线是胺类与双-(羧甲基) 三硫代碳酸酯在适当的溶剂中直接缩环合而得。实验中发现, N-甲基环丙沙星酰肼 (3) 易与二硫化碳缩合形成相应的二硫代甲酸盐, 但与氯乙酸钠反应时易发生脱硫反应形成C-3噁二唑硫醇[13]。用中间体3与双-(羧甲基) 三硫代碳酸酯在异丙醇中直接反应可方便得到氟喹诺酮 (绕丹宁) 酰胺关键中间体4。绕丹宁环中的5-位活泼亚甲基与醛在弱碱乙酸钠的催化下形成绕丹宁α, β-不饱和酮结构, 可避免通常强碱催化引起的绕丹宁环的开环反应或连接链酰氨基的水解反应, 可成功得到预期的目标化合物(5a~5r)。目标化合物的结构经1H NMR、MS及元素分析确证, 其收率、理化常数及波谱数据见表 1、2。
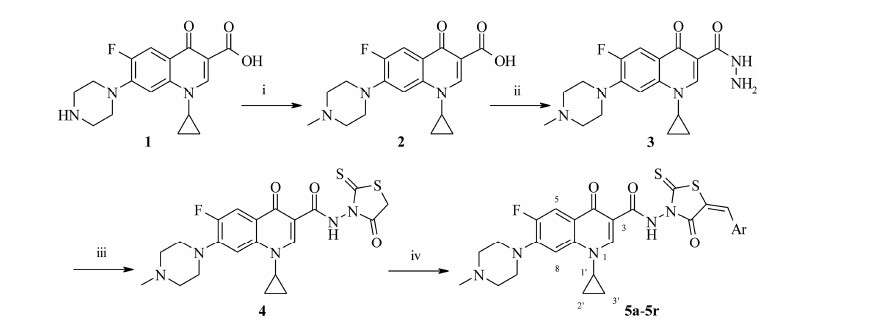 | Reagents: (i) HCOOH, CH2O; (ii) N2H4·H2O; (iii) Bis(carboxymethyl)trithiocarbonate, iPrOH; (iv) Ar-CHO, CH3COONa, HOAc. Ar: C6H5- (a); 4-CH3O-C6H4- (b); 2-CH3O-C6H4- (c); 3,4-(OCH2O)-C6H3- (d); 3,4,5-(OCH3)3-C6H2-(e); 4-CH3-C6H4- (f); 4-Cl-C6H4- (g); 4-F-C6H4- (h); 4-O2N-C6H4- (i); 3-O2N-C6H4- (j); pyridin-4-yl (k); pyridin-3-yl (l); pyridin-2-yl (m); furan-2-yl (n); 4-HOOC-C6H4- (o); 3-HOOC-C6H4- (p); 4-NC- C6H4- (q); 4-H2N-SO2-C6H4- (r). Scheme 1 Synthetic route of the title compounds 5a−5r |
|
|
Table 1 Physical constants and spectral data of the title compounds (5a−5r) |
|
|
Table 2 1H NMR data of the title compounds (5a−5r) |
2 抗肿瘤活性
18个目标物对Hep-3B、Capan-1及HL60 3种实验人癌细胞的IC50值均小于30.0 μmol·L−1 (表 3), 显著低于母体环丙沙星的IC50 (> 100 μmol·L−1) 值。构−效关系表明, 芳杂环如吡啶或呋喃衍生物或苯环带有吸电子基如 -F、-NO2、-COOH、-CN、-SO2NH2取代的目标化合物的IC50≤10.0 μmol·L−1, 其抗肿瘤活性显著高于供电子基取代的化合物的活性, 尤其是含COOH基化合物 (5o、5p) 或磺酰胺基化合物 (6r) 的活性最强。同时, 随着苯环取代基体积的增大活性下降, 如甲氧基化合物 (5b、5c) 到三甲氧基化合物 (5e), 而对对位或间位的吸电子取代基如硝基、羧基或芳杂环吡啶基而言, 取代基位置的变化对活性的
|
|
Table 3 The in vitro antitumor activity of the title compounds 5a−5r against the tested cancer cells. DOX: Doxorubicin; CFX: Ciprofloxacin |
影响不显著。另外, 目标化合物对3个实验癌细胞的抗增殖活性结果表明, 对人胰腺癌Capan-1细胞显示出最强的活性, 部分目标化合物的IC50值已达到或低于微摩尔浓度, 其活性优于或相当于对照抗肿瘤药物阿霉素的活性。基于此, 氟喹诺酮与绕丹宁α, β-不饱和酮骨架相拼合构建的酰胺类化合物作为抗肿瘤先导物值得进一步的发展。
实验部分采用WK-1B数字熔点仪测定熔点 (上海精密科学仪器厂), 毛细管法, 温度未校正; AM-400型核磁共振仪 (德国Bruker公司), CD3Cl为溶剂; Esquire LC型质谱仪 (德国Bruker公司); 2400-Ⅱ元素分析仪 (美国PE公司)。所用环丙沙星为商品, N-甲基环丙沙星酰肼按文献[12]的方法制备, 其他试剂均为分析纯。
1 化学合成
1.1 1-环丙基-6-氟-7-(4-甲基-哌嗪-1-基)-喹啉-4 (1H)-酮-3-(2-硫代-噻唑烷-4-酮-3-基)-酰胺 (4) 的合成 N-甲基环丙沙星酰肼3 (10.0 g, 28.0 mmol) 与双-(羧甲基) 三硫代碳酸酯 (7.6 g, 34.0 mmol) 在异丙醇(300 mL) 回流反应至原料消失 (TLC检测, 氯仿−甲醇5∶1)。冷至室温, 用浓氨水碱化至pH 8.0~9.0, 放置过夜。滤集产生的固体, 干燥。粗品用无水乙醇重结晶, 得黄色结晶3, 收率82.5 %, mp 183~185 ℃。1H NMR (400 MHz, CDCl3): 1.17~1.30 (m, 4H, 2'-和3'-H), 2.25 (s, 3H, CH3), 2.78~3.63 (m, 9H, piperazine- H和1'-H), 4.67 (s, 2H, SCH2), 7.68 (d, J = 6.4 Hz, 1H, 8-H), 7.85 (d, J = 13.2 Hz, 1H, 5-H), 8.86 (s, 1H, 2-H), 11.36 (s, 1H, NH); MS (m/z): 476 [M+H]+; Calcd. for C21H22FN5O3S2: 475.57。
1.2 1-环丙基-6-氟-7-(4-甲基-哌嗪-1-基)-喹啉-4 (1H)- 酮-3-(5-芳甲叉基-2-硫代-[1, 3]-噻唑烷-4-酮-3-基)-酰胺 (5a~5r) 的合成通法
中间体4 (1.0 g, 2.1 mmol) 与熔融的无水乙酸钠 (0.26 g, 3.2 mmol) 溶于冰醋酸 (10 mL) 中, 加入芳香醛 (2.5 mmol), 搅拌, 油浴回流反应12 h, 减压蒸除溶剂。残留物用水 (20 mL) 溶解, 加入适量的活性炭在60 ℃脱色0.5 h, 过滤。滤液用浓氨水碱化至pH 9.0, 滤集产生的固体。干燥, 用无水乙醇重结晶得目标物5a~5r。
2 抗肿瘤细胞体外增殖活性评价
目标化合物5a~5r及对照环丙沙星 (ciprofloxacin, CFX) 和结构类似抗癌药物阿霉素 (doxorubicin, DOX) 用DMSO配成1.0×10−2 mol∙L−1的储备液, 用RPMI- 1640稀释到所需浓度梯度 (50、10、5、1.0、0.1×10−6 mol∙L−1)。取对数生长期的人肝癌Hep-3B细胞、人胰腺癌Capan-1细胞及人白血病HL60细胞分别以每孔5 000个细胞接种于96孔板, 培养隔夜后, 加入不同浓度的上述供试化合物溶液, 继续培养48 h后弃去培养基。每孔加入1 g·L-1 MTT溶液100 μL, 继续培养 4 h后弃上清液。每孔加入150 μL二甲基亚砜, 轻轻振荡30 min, 用酶标仪在570 nm波长处测其吸光度值。计算各组对癌细胞的抑制率: 抑制率 (%) = [(1−实验组吸光度值)/对照组吸光度值]×100%。然后以各药物浓度的对数值对各浓度下的抑制率作线性回归, 得浓度−效应方程, 以此计算出各供试化合物对实验肿瘤细胞的半数抑制浓度 (IC50)。所有实验在相同条件下重复进行3次, 最终结果以mean ± SD表示。
| [1] | Erlanson DA, McDowell RS, O'Brien T. Fragment-based drug discovery [J]. J Med Chem, 2004, 47: 3463-3482. |
| [2] | Devine SM, Mulcair MD, Debono CO. Promiscuous 2-aminothiazoles (PrATs): a frequent hitting scaffold [J]. J Med Chem, 2015, 58: 1205-1214. |
| [3] | Tomašić T, Šink R, Zidar N, et al. Dual inhibitor of MurD and MurE ligases from Escherichia coli and Staphylococcus aureus [J]. ACS Med Chem Lett, 2012, 3: 626-630. |
| [4] | Li HQ, Yang J, Ma S, et al. Structure-based design of rhodanine-based acylsulfonamide derivatives as antagonists of the anti-apoptotic Bcl-2 protein [J]. Bioorg Med Chem, 2012, 20: 4194-4200. |
| [5] | Li W, Zheng CJ, Sun LP, et al. Novel arylhydrazone derivatives bearing a rhodanine moiety: synthesis and evaluation of their antibacterial activities [J]. Arch Pharm Res, 2014, 37: 852-861. |
| [6] | Zhang YQ, Wang SZ, Wu SC, et al. Facile construction of structurally diverse thiazolidinedione-derived compounds via divergent stereoselective cascade organocatalysis and their biological exploratory studies [J]. ACS Comb Sci, 2013, 15: 298-308. |
| [7] | Sirivolu VR, Vernekar SKV, Marchand C, et al. 5-Arylidenethioxothiazolidinones as inhibitors of tyrosyl-DNA phosphodiesterase I [J]. J Med Chem, 2012, 55: 8671-8684. |
| [8] | Mendgen T, Steuer C, Klein CD. Privileged scaffolds or promiscuous binders: a comparative study on rhodanines and related heterocycles in medicinal chemistry [J]. J Med Chem, 2012, 55: 743-753. |
| [9] | Nitsche C, Schreier VN, Behnam MAM, et al. Thiazolidinone-peptide hybrids as dengue virus protease inhibitors with antiviral activity in cell culture [J]. J Med Chem, 2013, 56: 8389-8403. |
| [10] | Behnam MAM, Nitsche C, Vechi SM. C-Terminal residue optimization and fragment merging: discovery of a potent peptide-hybrid inhibitor of dengue protease [J]. ACS Med Chem Lett, 2014, 5: 1037-1042. |
| [11] | Gao LZ, Xie YS, Li T, et al. Synthesis, antitumor activity and SAR of C-3 oxadiazole sulfanyl-acetylhydrazone-substituted fluoroquinolone analogues [J]. Acta Pharm Sin (药学学报), 2014, 49: 1964-1968. |
| [12] | Li T, Gao LZ, Xie YS, et al. Synthesis and anti-proliferative activity of fluoroquinolone C-3 fused heterocyclic α, β-unsaturated ketones derived from ciprofloxacin [J]. Acta Pharm Sin (药学学报), 2015, 50: 569-573. |
| [13] | Hu GQ, Hou LL, Wang GQ, et al. Part IV: Design, synthesis and antitumor activity of fluoroquinolone C-3 heterocycles: bis-oxadiazole methylsulfide derivatives derived from cipro-floxacin [J]. Acta Pharm Sin (药学学报), 2012, 47: 1017- 1022. |
| [14] | Brown FC, Bradsher CK, Morgan EC, et al. Some 3-substituted rhodanines [J]. J Am Chem Soc, 1956, 78: 384-388. |
 2015, Vol. 50
2015, Vol. 50


