2. 英国利物浦大学分子生物学, 英国
2. University of Liverpool Molecular Biology, England
动脉粥样硬化(AS)是一种炎性血管病变,是心脑血管疾病的主要病理基础,因此预防、治疗AS是防止心脑血管疾病发生的重要手段。血管平滑肌细胞(VSMCs)可分为收缩型和合成型两种[1,2],在病理情况下,VSMCs由不能增殖的收缩型转变为具有很强增殖能力的合成型。VSMCs的增殖、迁移及细胞外基质合成是AS与经皮冠状动脉介入治疗(PCI)术后血管再狭窄等心血管疾病发生和发展的重要病理过程[3,4]。
近年来的研究[5,6,7]发现,许多生长因子,如碱性成纤维细胞生长因子(bFGF)、血管内皮生长因子(VEGF)、血小板源性生长因子(PDGF)以及一些物理、化学因素都能够显著促进VSMCs的增殖。其中PDGF是其中促VSMCs增殖作用效果较显著、特异性较高的一种生长因子。PDGF可显著促进内皮细胞、成纤维细胞及平滑肌细胞生长和运动,并且是一个重要的有丝分裂原。PDGF由4种肽链构成,即A、B、C和D链,可形成AA、AB、BB、CC和DD等5种二聚体形式[8]。PDGF-BB通过与PDGF受体α或β亚型结合激活胞内信号通路,其为PDGF主要亚型。因此,本实验细胞增殖建模选择PDGF-BB作为诱导剂。
肝素寡糖由普通肝素经过酶法、化学法等解聚得低分子量肝素后,经分离纯化而得。肝素寡糖与普通肝素相比,表现出不同的生物特性,比如:抗炎和抗血管平滑肌细胞增殖活性[9]。文献[2]报道,一定分子量范围的肝素寡糖具有较强的抑制VSMCs增殖活性,而VSMCs大量增殖是导致AS进而引发一系列心脑血管疾病的重要因素。
VSMCs异常增殖是AS进程中的重要因素,因此抑制VSMCs增殖是抗AS的可行途径。本实验检测了VSMCs细胞增殖信号通路中几种关键蛋白和原癌基因的表达水平,以期研究肝素寡糖抑制PDGF诱导血管平滑肌细胞增殖的分子机制。 材料与方法 材料
人主动脉平滑肌细胞(HASMC),购自中国典型培养物保藏中心;Mr 3 200的肝素寡糖,本实验室精制[2];高糖DMEM培养基、澳洲进口胎牛血清(fetal bovine serum,FBS)和胰蛋白酶,Gibco公司;四甲基偶氮唑盐(MTT),Sigma公司;血小板衍生生长因子(PDGF),Peprotech公司;二甲基亚砜(DMSO),南京化学试剂一厂;Western及IP细胞裂解液,碧云天生物公司;细胞周期检测试剂盒、ECL检测液试剂盒和逆转录试剂盒,凯基生物公司;PVDF膜,Millipore公司;PKC-α抗体、β-actin抗体、SABC免疫组化染色试剂盒和DAB显色试剂盒,博士德生物工程有限公司;Akt抗体、p-Akt抗体、p-PDK1抗体和p-GSK-3β抗体,Cell Signaling公司;ERK1/2抗体,博奥森生物技术有限公司;p-ERK1/2抗体,艾菲生物技术有限公司;RNA逆转录试剂盒,Fermentas公司。 细胞培养
采用含10% FBS的DMEM高糖培养基(1×105 u·L-1青霉素,100 mg·L-1链霉素),置37℃、5% CO2细胞培养箱中进行VSMCs细胞培养。当VSMCs细胞长至90%~95%时用0.25%胰酶+0.02% EDTA进行消化传代。 MTT检测细胞增殖活性
将生长近融合的VSMCs用0.25%胰酶消化后,以每孔8×103细胞数接种于96孔培养板。培养24 h待细胞贴壁后,将细胞分为对照组(无血清培养基)、模型组(一定浓度的PDGF+无血清培养基)及肝素寡糖组(一定浓度的PDGF+无血清培养基+0.01、0.1或1µmol·L-1 HDO),每组设6个复孔,并将各组培养液更换为含0.5% FBS的DMEM培养液以使细胞同步化。孵育24 h后,每孔加入5 mg·mL-1 MTT溶液20µL,37℃孵育4 h。小心吸出培养液,每孔加入DMSO 150µL溶解结晶,振荡混匀后于570 nm处测定各孔吸收度。 流式细胞仪测定细胞周期分布
将生长近融合的VSMCs以每毫升1×104个细胞接种于六孔板中,同"MTT检测细胞增殖活性"分组,肝素寡糖各组分别加入不同浓度的肝素寡糖预孵。孵育24 h后,弃培养液,加入新的含0.5%血清的DMEM培养液,然后除对照组加入相应量的PBS外,其余各组加入一定浓度的PDGF。孵育24 h后,弃培养液,PBS洗涤后以0.25%胰酶消化收集细胞。PBS洗涤2次,70%冷乙醇固定,4℃过夜。将细胞悬液1 000 r·min-1离心10 min,弃乙醇,PBS洗涤2次,弃上清液,沉淀加入碘化丙啶染色液0.5 mL (PI 50µg·mL-1,RNaseA 100µg·mL-1),室温避光染色1 h,流式细胞仪上测定细胞周期分布,并按公式Proliferation index (%)=(S+G2/M)/(G0/G1+S+G2/M)× 100计算细胞增殖指数[10]。 Western blot法测定蛋白表达或磷酸化的变化
将生长近融合的VSMCs以每毫升1×104个细胞接种于六孔板中,分为对照组、模型组及肝素寡糖组。将培养的VSMCs用PBS漂洗后加入细胞裂解液提取总蛋白,BCA法测定蛋白浓度并定量,经10% SDS-PAGE电泳分离蛋白,半干电转法将蛋白转移到PVDF膜上。10%脱脂奶粉室温封闭1 h,PKC-α、Akt、p-Akt、ERK 1/2、p-ERK 1/2、p-PDK 1和p-GSK-3β一抗4℃孵育过夜,TBST室温洗10 min × 3次。辣根酶标记羊抗兔二抗室温孵育1 h,TBST室温洗10 min × 3次。ECL化学发光法显影,Bio-Rad成像系统拍照。采用Bio-Rad凝胶成像系统进行分析,蛋白表达量用光密度值表示,结果用目标条带与内参的比值表示。 免疫细胞化学法半定量检测蛋白表达或磷酸化的变化
将生长近融合的VSMCs以每毫升1×104个细胞接种于六孔板中,分为对照组、模型组及肝素寡糖组。取生长于盖玻片上的第3代细胞,丙酮4℃固定,3% H2O2抑制内源性过氧化物酶,BSA封闭,PKC-α、p-Akt和p-ERK 1/2一抗孵育湿盒内4℃过夜,生物素化羊抗兔二抗37℃孵育30 min。然后采用SABC、DAB显色。计分原则如下所述:每组结果随机选取5个视野,以棕色作为阳性标准,对阳性细胞比例进行计数。(A)按细胞显色有无及深浅记分:0为无色,1为浅色,2为深色;(B)按显色细胞所占比例记分:0为阳性细胞率为0,1为阳性细胞率为1%~5%,2为阳性细胞率为6%~25%,3为阳性细胞率为26%~50%,4为阳性细胞率为51%~75%,5为阳性细胞率大于75%。MT积分=A×B;按积分高低分为:阴性(-)0~1分,弱阳性(+)2分,阳性(++)3~4分,强阳性(+++)5~10分。 RT-PCR法测定蛋白和原癌基因mRNA的表达
将生长近融合的VSMCs以每毫升1×104个细胞接种于六孔板中,分为对照组、模型组及肝素寡糖组。孵育24 h后,弃培养液,PBS洗涤消化收集细胞。Trizol、氯仿处理细胞分离总RNA,异丙醇沉淀RNA,冷乙醇洗涤,溶于0.1% DEPC水中,测定RNA浓度。以逆转录后的cDNA为模板,用PKC-α、Akt、c-fos、c-myc、c-jun、GAPDH引物分别进行PCR扩增。PCR产物经1.6%琼脂糖凝胶电泳、Goldenview染色后,在紫外灯下,采用Bio-Rad凝胶成像分析仪观察、拍照并测定光密度值,结果以目的基因与内参基因的光密度比值表示。引物序列信息如表1所示。
|
|
Table 1 Primer sequence information |
所有数据均用x±s表示。采用SPSS 16.0统计软件的单因素方差分析(One-Way ANOVA)及LSD检验进行统计学分析。 结果 1 HDO抑制PDGF诱导VSMCs细胞增殖活性测定
为了检测HDO抑制PDGF诱导VSMCs细胞增殖活性,首先进行PDGF诱导VSMCs细胞增殖模型的建立,结果如图1A所示,与对照组相比,PDGF能明显促进VSMCs细胞增殖,且结果呈一定的浓度依赖性,其中30 ng·mL-1 PDGF作用较强,质量浓度大于30 ng·mL-1时细胞增殖作用并不明显,因此,在后续实验中以30 ng·mL-1 PDGF来制备基于VSMCs的增殖模型。然后,检测HDO抑制PDGF诱导VSMCs细胞增殖活性,结果如图1B所示,与对照组相比,30 ng·mL-1 PDGF均能明显地促进VSMCs增殖,故PDGF增殖模型建立成功。经0.01、0.1和1µmol·L-1肝素寡糖预孵24 h后,VSMCs细胞模型中诱导的细胞增殖活性均明显降低,其抑制率分别为9.2%、14.6%和23.1%。
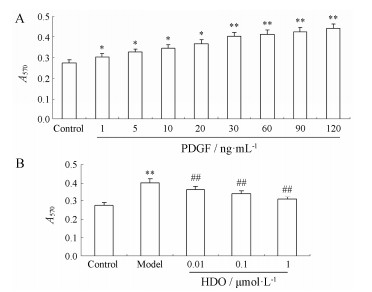 | Figure 1 Establishment of vascular smooth muscle cells (VSMCs) proliferation model by platelet-derived growth factor (PDGF) and effect of heparin-derived oligosaccharide (HDO, Mr 3 200) on VSMCs proliferation. A: Establishment of VSMCs proliferation model induced by PDGF; B: Inhibition effect of HDO on PDGF-induced VSMCs proliferation. P < 0.05, **P < 0.01 vs control group; ##P < 0.01 vs model group |
如图2和图3A所示,经30 ng·mL-1 PDGF刺激诱导后,对照组b图中G1期细胞数分别由对照组a的(85.5 ± 8.6)%减少到(66.8 ± 7.4)%,而处于S期的细胞数则由对照组的(4.3 ± 0.56)%增加到(16.3 ± 1.7)%,说明30 ng·mL-1 PDGF能明显促进细胞从G1期进入S期,而加入不同浓度(0.01、0.1和1µmol·L-1)的肝素寡糖后,模型组被阻滞于G1期的细胞上升至(71.34 ± 3.5)%、(76.52 ± 5.6)%和(82.4 ± 8.4)%,而S期的细胞数减少到(13.96 ± 1.9)%、(10.98 ± 1.6)%和(6.24 ± 0.9)%。进一步计算细胞增殖指数,结果如图3B所示,加入30 ng·mL-1 PDGF后,增殖指数由对照组的(14.4 ± 1.5)%增加到模型组的(33.2 ± 3.4)%,加入肝素寡糖(0.01、0.1和1µmol·L-1)预孵24 h后,PDGF诱导的细胞增殖指数降至(28.7 ± 2.6)%、(23.5 ± 2.3)%和(17.6 ± 1.8)%。这一实验结果提示肝素寡糖主要是抑制PDGF诱导的G1期细胞进入S期,从而抑制细胞的进程。
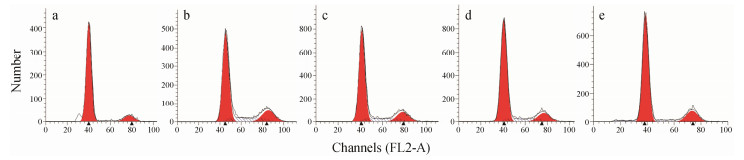 | Figure 2 Representative flow cytometric profiles demonstrating cell cycle distribution of VSMCs. a: Control; b: Model (30 ng·mL-1 PDGF); c: 0.01 μmol·L-1 HDO + 30 ng·mL-1 PDGF; d: 0.1 μmol·L-1 HDO + 30 ng·mL-1 PDGF; e: 1 μmol·L-1 HDO + 30 ng·mL-1 PDGF |
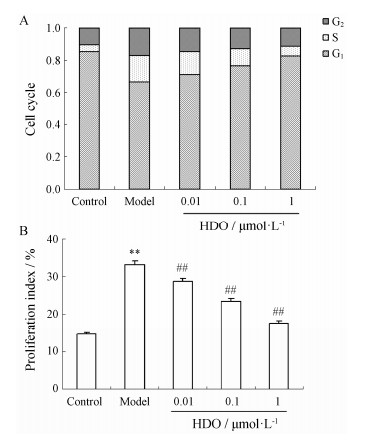 | Figure 3 Effect of HDO on cell cycle distribution. A: The percentage of PDGF-induced cells in each phase B: PDGF- induced cells proliferation index. Proliferation index (%) = (S + G2/M) / (G0/G1 + S + G2/M) × 100. n = 3, x±s. **P < 0.01 vs control group; ##P < 0.01 vs model group |
在正常VSMCs细胞中,PKC-α、Akt、p-Akt、ERK 1/2、p-ERK 1/2、p-PDK 1和p-GSK-3β均有一定程度的表达。30 ng·mL-1 PDGF刺激诱导后,PKC-α、p-Akt、p-ERK 1/2、p-PDK 1和p-GSK-3β表达量有明显升高,分别为对照组的5.01、3.11、4.98、3.75和2.61倍,而Akt和ERK 1/2表达无明显变化。不同浓度的肝素寡糖对PKC-α、p-Akt、p-ERK 1/2、p-PDK1和p-GSK-3β的表达或磷酸化有不同程度的抑制作用,0.01、0.1和1 μmol·L-1肝素寡糖对PKC-α表达的抑制率分别为39.6%、48.2%和67.1%;对p-Akt表达的抑制率分别为32.8%、44.5%和62.1%;对p-ERK 1/2表达的抑制率分别为37.5%、47.8%和64.1%;对p-PDK 1表达的抑制率分别为34.5%、70.4%和87.3%;对p-GSK-3β表达的抑制率分别为40.6%、53.1%和69.1%,见图4。
 | Figure 4 Effect of HDO on PDGF-induced PKC-α, p-Akt, p-ERK 1/2, p-PDK 1 and p-GSK-3β proteins expression in VSMCs by Western blot. A: Representative results of each protein SDS-PAGE electrophoresis; B: Optical density analysis shown as the ratio of each protein/β-actin. n = 3, x±s. **P < 0.01 vs control group; ##P < 0.01 vs model group |
为了证实以上结果,采用免疫细胞化学法对PKC-α、p-Akt、p-ERK1/2蛋白表达进行检测,结果如图5所示,PKC-α、p-Akt和p-ERK 1/2在正常VSMCs中的表达表示为弱阳性(+),30 ng·mL-1 PDGF刺激诱导后,PKC-α、p-Akt和p-ERK 1/2表达量大幅上升,表示为强阳性(+++)。不同浓度肝素寡糖可以抑制PKC-α、p-Akt和p-ERK 1/2的表达,0.01、0.1和1 μmol·L-1肝素寡糖抑制PKC-α、p-Akt和p-ERK 1/2结果分别表示为阳性(++)、阳性(++)和弱阳性(+)。
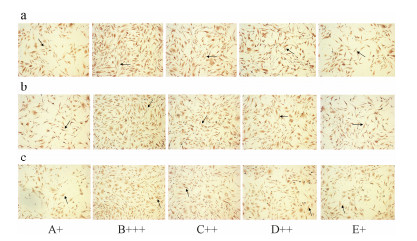 | Figure 5 Effect of HDO on PDGF-induced PKC-α (a), p-Akt (b) and p-ERK1/2 (c) expression in VSMCs by immunocytochemistry. The positive cells indicated by arrows were stained brown, and the cells were visualized using microscopy at 25 × magnification. PKC-α, p-Akt and p-ERK 1/2 mainly located in cytoplasm. A: Control; B: Model; C: 0.01 μmol·L-1 HDO + 30 ng·mL-1 PDGF; D: 0.1 μmol·L-1 HDO+ 30 ng·mL-1 PDGF; E: 1 μmol·L-1 HDO + 30 ng·mL-1 PDGF |
在正常VSMCs中,c-myc、c-jun、c-fos、PKC-α和Akt mRNA均有一定程度的表达。30 ng·mL-1 PDGF刺激后,c-myc、c-jun、c-fos和PKC-α mRNA表达均有明显的升高,分别为对照组的1.3、1.7、1.5和1.3倍,而Akt mRNA表达无明显变化。不同浓度肝素寡糖预孵后,30 ng·mL-1 PDGF诱导的c-myc、c-jun、c-fos和PKC-α mRNA的表达均受到不同程度的抑制,其中0.01、0.1和1 μmol·L-1肝素寡糖对c-myc mRNA表达的抑制率分别为12.3%、25.4%和30.2%;对c-jun mRNA表达的抑制率分别为8.6%、11.4%和21.5%;对c-fos mRNA表达的抑制率分别为20.8%、23.6%和36.6%;对PKC-α mRNA表达的抑制率分别为14.7%、17.4%和35.4%,见图6。
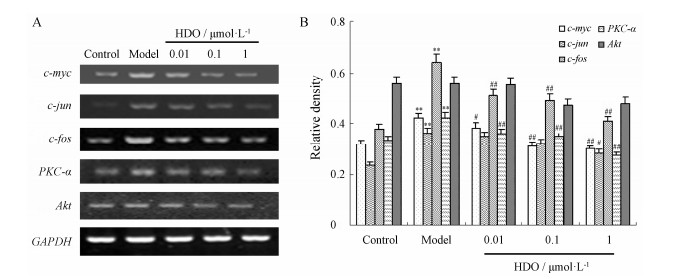 | Figure 6 Effect of HDO on PDGF-induced PKC-α, Akt, c-jun, c-myc and c-fos mRNA expression in VSMCs. A: Representative results for agarose gel electrophoresis of PCR products; B: Optical density analysis shown as the ratio of target gene mRNA/GAPDH mRNA. n = 3, x±s. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs model group |
AS的形成包括两个阶段,第一阶段为病灶形成阶段,主要表现是泡沫细胞的生成。第二阶段为斑块形成阶段,主要表现为VSMCs的迁移和增殖,同时表型发生改变,由收缩型变成整合型,失去收缩能力,并分泌大量细胞外基质[11]。VSMCs增殖是AS、血管术后再狭窄和其他相关心血管疾病的病理基础[12]。根据"滞留反应假说",胞外基质蛋白聚糖捕获、截留脂蛋白是动脉粥样硬化发病过程中的早期事件,并且,脂质条纹是AS形成的早期表现[13,14]。因此,越来越多的研究者认为AS起始病灶区VSMCs进行增殖,然后导致内膜增厚,内膜增厚先于肉眼可见脂质沉积[15]。婴幼儿早期冠状动脉粥样硬化病变研究表明冠状动脉粥样硬化始发儿童时期而持续进展。在AS病变处,VSMCs细胞极性和浸润性丧失,并且内膜弹性薄板破裂。此外,细胞增殖相关原癌基因c-fos过表达。这些数据表明VSMCs在动脉粥样硬化形成过程中起着关键作用[16,17],因此,VSMCs有望成为一个有价值的AS治疗靶点。
本实验发现HDO (0.01~1 μmol·L-1)可抑制VSMCs增殖,呈现浓度依赖性。抑制细胞增殖与细胞周期进展改变密切相关。正常生理状况下,VSMCs保持在G0/G1期,只有当活化时细胞才进入S期。因此,G1/S期转换增加是细胞增殖分化的一特点。在本实验中,流式细胞仪检测细胞周期分布表明,HDO抑制PDGF活化的VSMCs G1/S期转换。因此,推测抑制VSMCs G1/S期转换可能是HDO抑制VSMCs增殖分子机制之一。
目前研究发现,参与VSMCs增殖的胞内信号转导通路主要有:蛋白激酶C (PKC)途径、丝裂原活化的蛋白激酶(MAPK)途径、蛋白激酶B/磷脂酰肌醇3-激酶(Akt/PI3K)途径[18,19,20]。因此本文研究了HDO对PKC、MAPK和Akt/PI3K信号通路中关键蛋白表达影响,以探究HDO抑制VSMCs增殖可能分子机制。PKC是PKC信号传导通路中的关键因子。PKC从胞浆向胞膜的转移是PKC活化的重要标志,而PKC的活化和磷酸化之间没有必然的联系。PKC-α是PKC重要亚型,在VSMCs增殖过程中起着重要作用[21]。因此,PKC信号通路部分的研究对象为PKC-α总蛋白。MAPK通路主要介导细胞外信号向膜内及细胞核的传递,调节细胞增殖、分化、应激反应及凋亡等过程[22]。MAPK家族的3个主要成员是:细胞外信号调节激酶1/2(ERK1/2)、c-jun氨基末端激酶/应激活化蛋白激酶(JNK/SAPK)和p38 MAPK。ERK 1/2磷酸化活化是VSMCs增殖的必要条件,抑制ERK 1/2活化能有效地抑制VSMCs增殖。因此,MAPK信号通路部分的研究对象为p-ERK 1/2。除了PKC途径和MAPK途径外/span>,Akt/PI3K途径也是调节VSMCs增殖一条重要信号通路。当细胞受到激素、生长因子和细胞因子刺激后,Akt磷酸化活化继而磷酸化一系列底物蛋白成分,如糖原合成酶激酶-3β(GSK-3β),参与细胞增殖过程。磷酸肌醇依赖性蛋白激酶1(PDK1)是Akt/PI3K途径中重要上游调控蛋白,其磷酸化水平直接影响Akt活性。因此,Akt/PI3K信号通路部分我们选取的研究对象为p-Akt、p-GSK-3β和p-PDK1。研究发现,PDGF刺激VSMCs,可显著促进PKC-α、p-ERK1/2、p-Akt、p-GSK-3β和p-PDK1的表达,HDO可浓度依赖性抑制这几种关键蛋白表达。
上述3种信号通路调控VSMCs增殖的作用不是独立的,而是互相影响的。有学者[23]发现MAPK活性降低可反馈调节降低PKC活性,采用MAPK反义寡核苷酸可抑制PKC-α活性。此外,PKC也可通过磷酸化PYK2活化ERK1/2,其与Ca2+活化ERK1/2过程类似。PKC可影响PDK磷酸化水平,从而与Akt/PI3K信号通路相互影响。与这些发现相吻合,结果表明,HDO抑制总PKC-α表达,降低ERK1/2和Akt磷酸化水平。此外,肝素寡糖对PKC-α抑制率略高于对p-ERK1/2和p-Akt抑制率,这可能是反馈调节所致。
c-myc、c-fos和c-jun等原癌基因表达参与VSMCs增殖和表型转换。在正常生理条件下,原癌基因在细胞内有较低水平的表达,在细胞受到刺激后,原癌基因的表达会增强。研究发现,PDGF刺激VSMCs,可促进c-myc、c-fos和c-jun mRNA转录,HDO可浓度依赖性抑制原癌基因转录。
综上所述,肝素寡糖可能通过抑制PKC、MAPK和Akt/PI3K信号通路中关键蛋白的表达水平从而抑制原癌基因表达和G1/S期转换,进而抑制PDGF诱导的血管平滑肌细胞增殖,可能分子机制原理如图7。
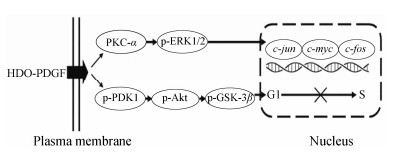 | Figure 7 The possible molecular mechanism of HDO inhibiting PDGF-induced VSMCs proliferation. HDO may decrease the expression of PDGF-induced key regulatory proteins, including PKC-α, p-ERK1/2, p-PDK1, p-Akt and p-GSK-3β, thus to suppress the transcription of proto-oncogene involving c-jun, c-myc and c-fos and G1/S transition, finally inhibiting VSMCs proliferation |
| [1] | Millauer B, Wizigmann-Voos S, Schnurch H, et al. High affinity VEGF binding and developmental expression suggest Flk-1 as a major regulator of vasculogenesis and angiogenesis [J]. Cell, 1993, 72: 835-846. |
| [2] | Niu J, He SY, Li W, et al. Preparation of heparin derived oligosaccharides and effection of them on vascular smooth muscle cells proliferation [J]. Pharm Biotechnol (药物生物技术), 2009, 16: 46-49. |
| [3] | Little PJ, Ivey ME, Osman N. Endothelin-1 actions on vascular smooth muscle cell functions as a target for the prevention of atherosclerosis [J]. Curr Vasc Pharmacol, 2008, 6: 195-203. |
| [4] | Mao YJ, Wang L, Wang WJ. Effect of ginkgolide B on the function of rat aorta smooth cells and U937 cells stimulated by oxLDL [J]. Acta Pharm Sin (药学学报), 2006, 41: 36-40. |
| [5] | Ishizawa K, Izawa-Ishizawa Y, Ohnishi S, et al. Quercetin glucuronide inhibits cell migration and proliferation by platelet-derived growth factor in vascular smooth muscle cells [J]. Pharmacol Sci, 2009, 109: 257-264. |
| [6] | Vij N, Sharma A, Thakkar M, et al. PDGF-driven proliferation, migration, and IL8 chemokine secretion in human corneal fibroblasts involve JAK2-STAT3 signaling pathway [J]. Mol Vis, 2008, 14: 1020-1027. |
| [7] | Simon F, Stutzin A. Protein kinase C-mediated phosphorylation of p47 phox modulates platelet-derived growth factor-induced H2O2 generation and cell proliferation in human umbilical vein endothelial cells [J]. Endothelium, 2008, 15: 175-188. |
| [8] | Tallquist M, Kazlauskas A. PDGF signaling in cells and mice [J]. Cytokine Growth Factor Rev, 2004, 15: 205-213. |
| [9] | Ahmed T, Ungo J, Zhou M, et al. Inhibition of allergic late airway responses by inhaled heparin-derived oligosaccharides [J]. Appl Physiol, 2000, 88: 1721-1729. |
| [10] | Li L, Gao T, He SY, et al. Effect of heparin-derived oligosaccharide on vascular smooth muscle cell proliferation through inhibition of PKC-α expression [J]. Acta Pharm Sin (药学学报), 2012, 47: 993-1000. |
| [11] | Ren RJ, Ge ZP, Chen XC. Research progress on the relationship between the vascular smooth muscle cells and atherosclerosis [J]. Inner Mong Med J (内蒙古医学杂志), 2009, 41: 1469-1472. |
| [12] | Little PJ, Ivey ME, Osman N. Endothelin-1 actions on vascular smooth muscle cell functions as a target for the prevention of atherosclerosis [J]. Curr Vasc Pharmacol, 2008, 6: 195-203. |
| [13] | Nakashima Y, Wight TN, Sueishi K. Early atherosclerosis in humans: role of diffuse intimal thickening and extracellular matrix proteoglycans [J]. Cardiovasc Res, 2008, 79: 14-23. |
| [14] | Nakashima Y, Fujii H, Sumiyoshi S, et al. Early human atherosclerosis: accumulation of lipid and proteoglycans in intimal thickenings followed by macrophage infiltration [J]. Arterioscler Thromb Vasc Biol, 2007, 27: 1159-1165. |
| [15] | Finn AV, Nakano M, Narula J, et al. Concept of vulnerable/unstable plaque [J]. Arterioscler Thromb Vasc Biol, 2010, 30: 1282-1292. |
| [16] | Milei J, Grana DR, Navari C, et al. Coronary intimal thickening in newborn babies and ≤ 01-year-old infants [J]. Angiology, 2010, 61: 350-356. |
| [17] | Milei J, Ottaviani G, Lavezzi AM, et al. Perinatal and infant early atherosclerotic coronary lesions [J]. Can J Cardiol, 2008, 24: 137-141. |
| [18] | Yun MR, Lee JY, Park HS, et al. Oleic acid enhances vascular smooth muscle cell proliferation via phosphatidylinositol 3-kinase/Akt signaling pathway [J]. Pharmacol Res, 2006, 54: 97-102. |
| [19] | Lata M, Milhorn DM, Bharati M, et al. CD40-mediated activation of vascular smooth muscle cell chemokine production through a Src-initiated, MAPK-dependent pathway [J]. Cell Signal, 2004, 16: 375-384. |
| [20] | Ettore P, Renata C, Concetta DF, et al. Protein kinase C pathway and proliferative responses of aged and young rat vascular smooth muscle cells [J]. Atherosclerosis, 1993, 104: 137-145. |
| [21] | Chang CC, Lee JJ, Chiang CW, et al. Inhibitory effect of PMC, a potent hydrophilic α-tocopherol derivative, on vascular smooth muscle cell proliferation: the pivotal role of PKC-α translocation [J]. Pharm Biol, 2010, 48: 938-946. |
| [22] | Zheng Q, Peng F, Wu XP, et al. Effect and mechanism of action of non-mitogenetic human acidic fibroblast growth factor on the mitogenic activity of the mammary tumor cell [J]. Acta Pharm Sin (药学学报), 2006, 41: 263-267. |
| [23] | Wang XK, Wang Y, He ZY, et al. Effects of MAPK antisense oligodeoxy nucleotides on PKC gene expression of human vascular smooth muscle cells induced by insulin [J]. Chin J Appl Physiol (中国应用生理学杂志), 1999, 15: 346-349. |
 2015, Vol. 50
2015, Vol. 50


