慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续性气流受限为特征的慢性炎症性疾病,其发病机制与气道和肺对有毒颗粒或气体的慢性炎症反应增强有关[1]。吸烟是导致COPD的最主要诱因之一,此外,直径小于或等于2.5微米的颗粒物(PM2.5)、职业、基因、年龄、性别和感染等也是影响COPD发病的重要因素[2]。目前临床上仍依赖糖皮质激素和支气管扩张剂来缓解气道炎症,迄今尚未见可长期应用并安全有效的治疗药物。因此,结合COPD病理生理学进展,从中草药有效成分中寻找作用于新靶点的抗炎候选物是COPD抗炎药物研究的重要课题。
冬虫夏草为麦角菌科虫草属真菌,为虫草菌(Cordyceps sinensis Sacc)的子座与其寄主蝙蝠科昆虫蝙蝠蛾(Hepialus armoricanus Oberthuk)幼虫尸体的复合物,是我国的名贵中药材。《本草纲目拾遗》记载:冬虫夏草性温,补精益髓,此物保肺气。冬虫夏草的有效成分主要包括核苷类物质(如虫草素、腺苷等)、虫草多糖、虫草酸、甾醇类物质和超氧化物歧化酶等,具有免疫调节、抗衰老、抗炎和抗氧化等多种生物活性[3]。由中国医学科学院药物研究所植化室提供的单体化合物WS070117M1为N6-(3-羟基苯基)腺苷,是以虫草素为基本结构进行修饰和优化合成的。前期研究显示,虫草素具有免疫调节和抗氧化等作用。
AMPK是由一个催化亚基α和两个调节亚基β、γ构成的异源三聚体。Guo等[4]发现,WS070117以其嘌呤环、苯环和乙酰基通过疏水、静电和氢键瞬时弱相互作用诱导AMPKγ亚基构象发生改变,促进AMPKα亚基Thr172磷酸化表达,从而激活AMPK。作者前期研究发现,腺苷及结构类似化合物显示有免疫调节作用。化合物M是WS070117的脱乙酰基代谢产物,是WS070117在体内发挥药理作用的主要活性成分。本文观察了WS070117M1在COPD小鼠肺部炎症中的作用及其对AMPK磷酸化的影响。 材料与方法 药品和试剂
WS070117M1由中国医学科学院药物研究所植化室提供(白色粉末,纯度≥99%,化学结构如图1所示,相对分子质量为854);RPMI 1640培养基、胎牛血清(Hyclone公司);戊巴比妥钠、佛波酯(phorbol-12-myristate-13-acetate,PMA)、脂多糖(lipopolysa ccharide,LPS)(Sigma公司);PV-9000试剂1(GBI公司);pAMPKα [phospho-AMPKα (T172)]兔抗人(鼠)单克隆抗体(CellSignal Technology公司);人IL-8 ELISA试剂盒、小鼠IL-1β、IL-6、TGF-β1ELISA试剂盒(Biolegend公司);小鼠IL-8ELISA试剂盒(R&D公司);其他试剂为国产分析纯。
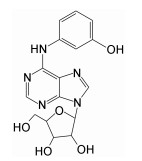 | Figure 1 Structure of N6-(3-hydroxylaniline)adenosine (WS070117M1) |
BALB/c小鼠,雄性SPF级,体重(20 ± 1) g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK (京)2012-0001。人单核细胞THP-1细胞购自北京协和医学院细胞资源中心,接种于含10%胎牛血清的RPMI 1640培养液中,37℃、5% CO2培养箱中培养。 模型制备及分组
依据参考文献[5]建立模型和方法。烟熏加两次气管内滴注LPS的方法建立COPD小鼠模型,实验小鼠随机分为对照组、模型组、6 mg·kg-1 WS070117M1组及12mg·kg-1 WS070117M1组,每组15只。分别于第1天、第14天腹腔注射0.8%戊巴比妥钠麻醉小鼠,气管内滴注0.66 g·L-1 LPS 30 μL,对照组以等量生理盐水代替。第2~13天、l5~35天小鼠于自制密闭的4 L有机玻璃仓内被动吸入半支香
烟的烟雾(每支香烟含焦油11 mg,烟雾烟碱量0.8 mg),5 min/次,一天熏烟两次,连续熏烟5周。于每日第二次熏烟前1 h给药一次。对照组、模型组灌胃给予生理盐水,给药组皮下给予相应剂量WS070117M1。
香烟烟雾凝集物(cigarettesmoke condensate,CSC)刺激PMA诱导的THP-1细胞模型的建立方法:取生长状态良好的THP-1细胞,用含10%胎牛血清(FBS)及终质量浓度为10 ng·mL-1 PMA的RPMI1640培养基调整细胞数为5×105个/mL,每孔0.5mL接种于48孔培养板中,培养24 h。磷酸盐缓冲液(PBS)轻柔漂洗3次,加入新鲜的完全培养基,加入终质量浓度为150 ng·mL-1的CSC,将细胞培养板置于37℃,5% CO2培养箱中孵育24 h。 动物取材
于末次给药并熏烟24 h后眼球取血,处死小鼠,切开小鼠颈部皮肤暴露气管,插入灌流针,用预冷的1 mL PBS行肺部支气管肺泡灌洗3次,吸出支气管肺泡灌流液(BALF),回收率在80%以上,混匀后置于4℃低温离心机,以1 500 r·min-1离心10min,小心收集上清液并分装冻存,用于细胞因子检测;沉淀细胞用PBS重悬,用于细胞分类计数。取小鼠完整的左侧肺组织,采用10%甲醛固定。 ELISA检测COPD小鼠BALF中IL-1β、IL-6、IL-8及TGF-β1水平
取上述冻存的BALF上清液,进行细胞因子检测,操作步骤按ELISA试剂盒说明书进行,酶标仪读取450 nm波长处吸光度值,并以570 nm波长处吸光度值矫正。 细胞分类计数仪检测COPD小鼠BALF中炎性细胞数量
沉淀细胞用预冷的PBS 50 μL重悬,用细胞分类计数仪对BALF中总白细胞和中性粒细胞进行分类计数。 HE染色
取同部位肺组织用10%甲醛固定,石蜡包埋后进行常规切片、HE染色,光学显微镜下观察对比各组小鼠肺组织病理形态学改变:将小鼠肺组织放入10%甲醛溶液中固定后,经水洗、脱水、透明、浸蜡和包埋后制作成蜡块。切成5 μm的薄片,将薄片附贴于多聚赖氨酸处理的载玻片上,65℃烤片1 h。脱蜡:二甲苯Ⅰ15 min,二甲苯Ⅱ15 min。水化:无水乙醇Ⅰ10 min,无水乙醇Ⅱ10 min,90%乙醇、80%乙醇、70%乙醇、60%乙醇和50%乙醇各5 min,蒸馏水洗5 min。苏木素染色2~5 min,蒸馏水充分冲洗,盐酸乙醇分化10 s,蒸馏水充分冲洗,氨水返蓝10 s,蒸馏水充分冲洗。伊红染色1~5min。50%乙醇、60%乙醇、70%乙醇、80%乙醇和90%乙醇各5 min,无水乙醇10 min,二甲苯透明10 min,中性树脂封片。
小鼠肺组织病理改变评分标准:肺组织采集照片放大倍数为200,200倍图片像素面积:429 408;标尺换算:1微米=5像素距离;每份样本选取5处气管及静脉周围(病变组织)视野。100~200 μm直径静脉、150~300 μm直径细气管旁炎症细胞浸润,每张切片选择5处进行评分。0,未见炎性细胞浸润;1,偶见静脉、支气管旁袖口状炎性细胞浸润;2,大多数静脉、支气管旁炎性细胞浸润明显,炎性细胞1~5层;3,大多数静脉、支气管旁大量炎性细胞浸润、炎性细胞大于5层。 免疫组织化学方法检测pAMPKα的分布和表达
将小鼠肺部组织按上述步骤水化后,PBS漂洗3次,每次3min。3% H2O2室温孵育10~20min。PBS漂洗3次,每次3 min。切片浸于预热的含EDTA (pH 6.0)的修复盒中,于95~98℃微波炉中加热15~25 min,室温自然冷却。PBS漂洗3次,每次3 min。滴加适当稀释的pAMPKα一抗,4℃孵育过夜。PBS漂洗3次,每次3 min。加入PV-9000试剂1,室温孵育20 min。PBS漂洗3次,每次3 min。加入PV-9000试剂1,室温孵育20 min。PBS漂洗3次,每次3 min。DAB显色,5~10min,镜下观察,显色充分后自来水中止反应。苏木素复染5~10 min,蒸馏水充分冲洗,盐酸乙醇分化10 s,蒸馏水充分冲洗,氨水返蓝10 s,蒸馏水充分冲洗。50%乙醇、60%乙醇、70%乙醇、80%乙醇和90%乙醇各5 min,无水乙醇10 min,二甲苯透明10 min,中性树脂封片。设阴性对照:PBS取代一抗[6]。
小鼠肺组织pAMPKα免疫组化计算方法:肺组织采集照片放大倍数为200,200倍图片像素面积:429 408;标尺换算:1微米=5像素距离;每份样本选取5处气管及静脉周围(病变组织)视野,计数200个细胞,计算阳性细胞比例。 ELISA法检测CSC刺激PMA分化的THP-1细胞上清液中IL-8水平
取生长状态良好的THP-1细胞,用含10% FBS及终质量浓度为10 ng·mL-1 PMA的RPMI1640培养基调整细胞数为5×105个/mL,每孔0.5mL接种于48孔培养板中,培养24 h。PBS轻柔漂洗3次,加入新鲜的完全培养基,相应孔内分别加入终浓度为1,5和10 μmol·L-1 WS070117M1,每组设4个复孔。孵育1 h后,加入终质量浓度为150 ng·mL-1CSC,将细胞培养板置于37℃,5% CO2培养箱中孵育24 h。ELISA法检测细胞培养上清中IL-8水平。 统计学分析
实验数据以x±s表示,采用SPSS16.0软件进行单因素方差分析比较组间差异性。 结果 1 WS070117M1对COPD小鼠BALF中细胞因子IL-1β、IL-6、IL-8及TGF-β1水平的影响
模型组与对照组相比,BALF中IL-1β、IL-6、IL-8及TGF-β1水平显著升高;皮下给予6和12 mg·kg-1WS070117M1,可明显降低COPD小鼠BALF中IL-6水平,抑制率分别为63.5%和80.1%;亦可明显降低小鼠BALF中IL-8水平,抑制率分别为27.7%和23.2%;12 mg·kg-1 WS070117M1组小鼠BALF中IL-1β、TGF-β1水平有明显的降低,抑制率分别为43.9%和80.6%。见图2。
 | Figure 2 Effectof WS070117M1 on inflammatory cytokines in bronchoalveolar lavage fluid (BALF) of mice. Concentrations of cytokines were measured by ELISA. Valuesare expressed as means ± SD, n = 8. #P < 0.05, ##P < 0.01, ###P < 0.001 vscontrol group; P < 0.05, **P < 0.01 vsmodel group |
模型组与对照组相比,BALF中总白细胞和中性粒细胞数量明显增加;皮下给予12 mg·kg-1 WS070117M1,可明显减少COPD小鼠BALF中总白细胞和中性细胞数目,抑制率分别为39.7%和49.6%。见图3。
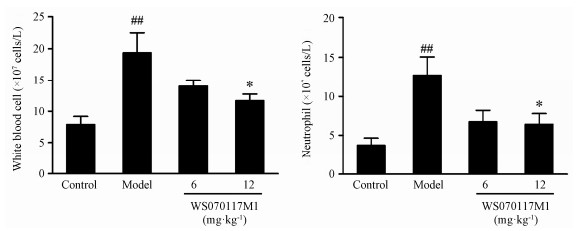 | Figure 3 Effectof WS070117M1 on the infiltration of total white blood cells and neutrophils in BALF, separately. Values are expressed as means ± SD, n = 8. ##P < 0.01 vscontrol group; P < 0.05 vs model group |
与空白对照组相比,模型组小鼠支气管周围有大量炎性细胞浸润,支气管上皮细胞脱落,呈绒毛状增生,黏性分泌物增加,局部肺泡间隔中度增宽,肺泡腔缩小,肺泡腔内可见纤维蛋白渗出,局部可见局灶样纤维化样改变;WS070117M1 6 mg·kg-1组和12 mg·kg-1组小鼠肺组织的间质散在少量炎性细胞、中性粒细胞浸润,肺泡间隔轻度增宽,未见纤维化样改变。支气管周围炎性细胞浸润情况较模型组减轻,上皮细胞增生及黏性分泌物减少。见图4。
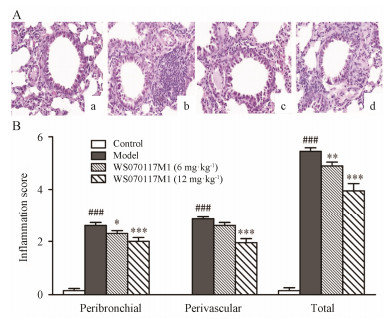 | Figure 4 Effectof WS070117M1 on inflammatory infiltration in lung tissues of mice. (A) HE staining of lung tissues and investigated under microscope (200×). a:Control group; b: Model group; c: WS070117M1 (6 mg·kg-1); d: WS070117M1 (12 mg·kg-1). (B) Inflammatory scores in lung tissues shown as the mean ofperibronchial and perivascular inflammation scores. Values are expressedas means ± SD, n = 6. ###P < 0.001 vscontrol group; P < 0.05, **P < 0.01, ***P < 0.001 vsmodel group |
免疫组织化学结果(图5A)显示,空白对照组小鼠肺部血管内皮细胞及气管周围有少量pAMPKα表达;模型组中pAMPKα在小鼠肺部血管内皮细胞表面及气管周围表达明显增加(P<0.001);与模型组相比,WS070117M1在剂量为6和12 mg·kg-1皮下给药可明显增加COPD小鼠气管及血管周围pAMPKα表达(P<0.001)。
 | Figure 5 Effectof WS070117M1 on expression of pAMPK in lung tissues of mice. (A) The expression of pAMPK in the lungs of mice was analyzed byimmunohistochemistry method and investigated under microscope (200×). a:Control group; b: Model group; c: WS070117M1 (6 mg·kg-1); d: WS070117M1 (12 mg·kg-1); (B) Percentage of pAMPK immunostained cells in lung tissues of mice. Valuesare expressed as means ± SD, n = 6. ###P < 0.001 vscontrol group; ***P < 0.001 vs model group |
终质量浓度为100 ng·mL-1的CSC能增加PMA分化的THP-1细胞IL-8的分泌水平;1,5,10 μmol·L-1 WS070117M1可CSC刺激PMA诱导的THP-1细胞IL-8的分泌,且在1~10μmol·L-1浓度内,随剂量增加,WS070117M1对炎症因子IL-8生成的抑制作用增强,IC50为3.4 μmol·L-1。见图6。
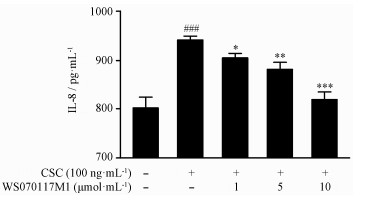 | Figure 6 Effect ofWS070117M1 on IL-8 production in cigarette smoke condensate (CSC) treated supernatants of phorbol-12-myristate-13-acetate(PMA) differentiated THP-1 cells. Concentrations of cytokines weremeasured by ELISA. Values are expressed as means ± SD, n = 5. ###P < 0.001 vscontrol group; P < 0.05, **P < 0.01, ***P < 0.001 vs CSCgroup |
COPD是呼吸系统常见的以反复发作的慢性气道炎症为主要症状的疾病,常伴有心、肺多种并发症或合并症,近年来发病率和病死率均逐年增加。随着大气污染加剧,环境因素在气道炎症性疾病病理机制中的作用日益受到关注。PM2.5作为大气中的细颗粒物,可激发和诱导气道炎症和氧化损伤。PM2.5暴露导致COPD等气道炎症性疾病发病率上升,并可导致症状加重。因此,以气道炎症为主的呼吸系统损伤防治药物的研发尤为重要。香烟烟雾可激活中性粒细胞、巨噬细胞和支气管上皮细胞等,致蛋白酶分泌和氧自由基产生,从而诱发气道炎症、肺组织破坏、气道阻塞等症状[6]。LPS是革兰阴性菌细胞壁的主要成分,是强有力的炎症始动因素[7],本研究用两次气道内滴注LPS的方法诱发小鼠气道和肺部炎症,模拟机体反复感染。结果显示,模型组小鼠BALF中总炎性细胞、中性粒细胞均有升高;BALF中炎症因子IL-1β、IL-6、IL-8及TGF-β1的水平明显升高;小鼠肺部呈典型病理改变:支气管周围有大量炎性细胞浸润,支气管上皮细胞脱落,肺泡腔内纤维蛋白渗出,局部可见局灶样纤维化改变。以上结果表明,本研究COPD小鼠模型造模成功。
细胞因子、炎性细胞与COPD发生发展密切相关。血液循环系统或气道中大量聚集的中性粒细胞及由中性粒细胞或巨噬细胞、气道上皮细胞分泌的IL-8是COPD典型的生物学标志,可诱导中性粒细胞形态改变及趋化,细胞内Ca2+ 浓度升高及脱颗粒,并诱导IL-8进一步分泌,致气道黏膜下及外膜组织水肿、杯状细胞数增加,引起COPD炎症继发性病理改变与气道重塑[8,9]。IL-6是一种具有多种生物学活性的刺激因子,在炎症和应激反应中可诱导肝脏产生多种急性期蛋白,与COPD疾病炎症发展密切相关[10]。TGF-β1可通过趋化炎症细胞,促进细胞外基质蛋白的产生和抑制细胞外基质蛋白的降解,最终促使细胞外基质沉积,产生气道重塑及肺纤维化,参与COPD发病过程[11]。IL-1β活化COPD患者巨噬细胞,分泌炎症因子、趋化因子及MMP9等[12]。本实验结果显示,WS070117M1治疗组小鼠BALF中IL-6、IL-8、IL-1β及TGF-β1水平明显降低;炎症细胞、中性粒细胞数明显减少,肺组织炎性细胞浸润及肺组织结构破坏减轻,表明WS070117M1可抑制COPD小鼠气道炎症。
虫草素是我国传统中药冬虫夏草有效活性成分,具有抗氧化、抗炎及免疫调节等多种药理作用。研究表明,虫草素通过激活AMPK发挥药理学作用[13]。AMPK是一种广泛参与人体内能量代谢活动的蛋白激酶。大量研究表明,激活AMPK可通过磷酸化SIRT1、PGC-lα、p53和FoxO3a调节NF-κB的活性,抑制TNF-α、IL-1β、IL-6炎症因子释放及iNOS表达,调节氧化应激反应,并显著减轻组织炎症损伤[14]。动物实验表明,AMPK激活剂可有效减轻急性肺损伤小鼠肺组织中的中性粒细胞聚集,降低肺泡灌洗液中的TNF-α和IL-6水平,降低LPS诱导的小鼠血清中细胞因子水平及脑组织中炎症相关基因表达[15]。目前,AMPK作为一种新型的信号蛋白在调节炎症和免疫反应中的作用已成为研究热点,通过药物或其他手段激活AMPK有望成为肺部炎症疾病防治的新策略。由于虫草素在腺苷脱氨酶作用下快速代谢生成无活性的代谢产物,限制了虫草素应用。因此,虫草素衍生物研发可能为新型肺部炎症疾病抗炎药物研发提供研究思路。本实验室前期实验已表明,WS070117M1作为虫草素衍生物体外实验在50 μmol·L-1浓度下对细胞活性未见影响,对AMPK有明显激活作用。体内实验未发现毒性反应,且在炎症模型上具有较好抗炎活性,本实验初步观察了WS070117M1作为AMPK激动剂对体外巨噬细胞及体内COPD小鼠模型炎症调节中的表达及作用,结果表明,WS070117M1以6和12mg·kg-1剂量皮下给药,可提高COPD小鼠肺部pAMPKα表达,抑制CSC诱导的巨噬细胞IL-8生成。WS070117M1可能通过激活AMPK及相关信号通路,抑制肺部炎症因子释放及炎症细胞浸润,缓解COPD小鼠气道炎症。
本实验表明,WS070117M1可激活AMPK,对COPD小鼠气道炎症有明显抑制作用,但其机制是否通过抑制线粒体呼吸链复合物1,升高AMP/ATP比值而激活AMPK,仍需深入研究。
| [1] | Zhou M, He JL, Yu SQ, et al. Effect of resveratrol on chronic obstructive pulmonary disease in rats and its mechanism [J]. Acta Pharm Sin (药学学报), 2008, 43: 128-132. |
| [2] | Decramer M, Janssens W, Miravitlles M. Chronic obstructive pulmonary disease [J]. Lancet, 2012, 379: 1341-1351. |
| [3] | Shen LL, Du G. Pharmacological action of Cordyceps sinensis Sacc [J]. Chin Hosp Pharm J (中国医院药学杂志), 2010, 30: 158-159. |
| [4] | Guo P, Lian ZQ, Sheng LH, et al. The adenosine derivative 2', 3', 5'-tri-O-acetyl-N6-(3-hydroxylaniline) adenosine activates AMPK and regulates lipid metabolism in vitro and in vivo [J]. Life Sci, 2012, 90: 1-7. |
| [5] | Tang WB, Xie JL, Xu S, et al. Novel nitric oxide-releasing derivatives of brusatol as anti-inflammatory agents: design, synthesis, biological evaluation, and nitric oxide release studies [J]. J Med Chem, 2014, 57: 7600-7612. |
| [6] | Shi J, Yin N, Xuan LL, et al. Vam3, a derivative of resveratrol, attenuates cigarette smoke-induced autophagy [J]. Acta Pharmacol Sin, 2012, 33: 888-896. |
| [7] | Baginski TK, Dabbagh K, Satjawatcharaphong C, et al. Cigarette smoke synergistically enhances respiratory mucin induction by proinflammatory stimuli [J]. Am J Respir Cell Mol Biol, 2006, 35: 165-174. |
| [8] | Zhang X, Zheng H, Zhang H, et al. Increased interleukin (IL)-8 and decreased IL-17 production in chronic obstructive pulmonary disease (COPD) provoked by cigarette smoke [J]. Cytokine, 2011, 56: 717-725. |
| [9] | Bucchioni E, Kharitonov SA, Allegra L, et al. High levels of interleukin-6 in the exhaled breath condensate of patients with COPD [J]. Respir Med, 2003, 97: 1299-1302. |
| [10] | Blidberg K, Palmberg L, Dahlén B, et al. Chemokine release by neutrophils in chronic obstructive pulmonary disease [J]. Innate Immun, 2012, 18: 503-510. |
| [11] | Chua F, Sly PD, Laurent GJ. Pediatric lung disease: from proteinases to pulmonary fibrosis [J]. Pediatr Pulmonol, 2005, 39: 392-401. |
| [12] | Barnes PJ. The cytokine network in asthma and chronic obstructive pulmonary disease [J]. J Clin Invest, 2008, 118: 3546-3556. |
| [13] | Xuan LL, Hou Q. Recent advances in the study of AMPK and inflammatory pulmonary disease [J]. Acta Pharm Sin (药学学报), 2014, 49: 1089-1096. |
| [14] | Giri S, Nath N, Smith B, et al. 5-Aminoimidazole-4-carboxamide-1-β-4-ribofuranoside inhibits proinflammatory response in glial cells: a possible role of AMP-activated protein kinase [J]. J Neurosci, 2004, 24: 479-487. |
| [15] | Zhao X, Zmijewski JW, Lorne E, et al. Activation of AMPK attenuates neutrophil proinflammatory activity and decreases the severity of acute lung injury [J]. Am J Physiol Lung Cell Mol Physiol, 2008, 295: L497-L504. |
 2015, Vol. 50
2015, Vol. 50


