2. 首都医科大学附属北京友谊医院, 北京 100050;
3. 解放军302医院中西医结合肝病诊疗与研究中心, 北京 100039;
4. 中国中医科学院中药研究所, 北京 100700
2. Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China;
3. Integrative Medical Center, 302 Military Hospital, Beijing 100039, China;
4. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
何首乌为蓼科植物何首乌Polygonum multiflorum Thunb.的块根,生品解毒、消痈、截疟、润肠通便,炮制品补肝肾、益精血、乌须发[1],是临床常用中药和大众保健食品。近年来,国内外有关何首乌不良反应的报道大量增加,包括服用生首乌、制首乌、含何首乌的复方、中成药或保健食品等[2, 3, 4, 5, 6, 7]。何首乌肝损伤的问题引起国内药品监管部门和研究机构的高度重视[8]。国家食品药品监督管理局(CFDA)药品不良反应监测中心近几年收集到何首乌制剂的不良反应报告近万份,其中肝功能损伤是其最主要的不良反应。解放军302医院药肝病例数据库中共收录1980例药物性肝损伤患者的信息,其中有关何首乌及其制剂的病例为40余例(单用何首乌的有7例)。针对何首乌致肝损伤风险的问题,2013年CFDA发出对6种含首乌制剂说明书进行修订的通告[9]。在制定监管措施过程中发现,约500种含首乌中药制剂中有15种用于治疗慢性肝病,既然何首乌有导致肝损伤风险,这些制剂是否可用于慢性肝病治疗,如何加以监管,这些问题尚无科学数据支撑。值得注意的是,这15种治疗慢性肝病的制剂并没有肝损伤不良反应或加重原有肝病的报道。一方面可能是基础肝病掩盖了何首乌自身的肝损伤作用;另一方面也可能是由于对病(证)用药,因而何首乌体现出的是保护和治疗作用,而不是损伤作用,也就是《黄帝内经》中"有故无殒"的认识[10, 11, 12, 13]。然而,何首乌对肝脏是否具有"有故无殒"的现象,尚无研究报道。为此,本研究根据"有故无殒"思想,采用病理毒理学方法对比考察何首乌在疾病(CCl4慢性肝损伤)大鼠与正常大鼠上的治疗与损伤作用,从实验的角度探讨何首乌是否可用于慢性肝病的治疗,为何首乌临床治疗慢性肝病的安全性评估与合理应用提供参考。 材料与方法
实验动物48只雄性SD大鼠,周龄40天[(180 ± 20) g],购于中国人民解放军军事医学科学院实验动物中心[SCXK-(军)2007-004]。饲养于解放军302医院实验动物中心[SYXK (军)2002-00500]。自由进食及饮水,实验室温度(22 ± 2)℃,湿度60%~80%,人工光照约12 h/12 h明暗周期,定期消毒。
药品大黄素(CAS 518-82-1,批号110796-201118,供含量测定用,以99.5%计),大黄素甲醚(CAS 521-61-9,批号110758-201013,供含量测定用,以99.8%计),没食子酸(CAS 149-91-7,批号110831-201204,供含量测定用,以89.9%计),儿茶素(CAS 154-23-4,批号110877-201203,供含量测定用,以97.2%计)购自中国食品药品检定研究院;二苯乙烯苷(CAS 82373-94-2,批号141101,供含量测定用,以98.48%计)购自成都普菲德生物科技公司;大黄素-8-O-葡萄糖苷(CAS 82373-94-2,批号23313-21-5,供含量测定用,以98.45%计)购自深圳菲斯化工有限公司;生何首乌(北京绿野药业有限公司,批号:13101701,产地湖北),经解放军第302医院肖小河研究员鉴定为蓼科植物何首乌(Polygonum multiflorum Thunb.)的干燥块根。何首乌50%醇提物制备:生首乌15 kg,加8倍量的50%乙醇冷浸提取两次,每次24 h,过滤,合并滤液,减压回收溶剂,浓缩成相当于生药材3 g·mL-1的药液。其中二苯乙烯苷、大黄素、大黄素-8-O-葡萄糖苷、没食子酸和儿茶素在总提物中的百分比分别是17.09%、0.48%、2.1%、3.9%和0.98%,所检测的5个化合物的总含量为24.55%。
主要试剂和仪器橄榄油(批号:20130326),CCl4(批号:20140220)(国药集团化学试剂有限公司);GPT/ALT试剂盒(批号:20140122),GOT/AST试剂盒(批号:20140118)(南京建成生物工程研究所);Rat total bilirubin (TB) ELASA Kit (批号:CSB-EQ027746),Rat HMGB-1 Kit (批号:CSB-E08224r)(RA CUSABIO公司);Rat IL-1β ELISA kit (DKW12-3012-096),Rat TNF-α ELISA Kit (DKW12-3720-096)(达科为生物技术有限公司);全功能酶标仪(BioTek Synergy H1,Hybrid Reader,美国伯腾仪器有限公司)等。
实验动物分组、造模及给药方法SD雄性大鼠正常喂养1周后,随机分为6组,每组8只,分别为:正常对照组(N)、何首乌正常高剂量组(NH)、何首乌正常低剂量组(NL)、模型对照组(M)、何首乌模型高剂量组(MH)和何首乌模型低剂量组(ML)。参照何首乌肝损伤文献[14,15],设置高剂量为20 g·kg-1,低剂量为10 g·kg-1(按生药量计算)。
CCl4与橄榄油配成40%油剂CCl4(40/60),大鼠腹腔注射给药,每周2次,2 mL·kg-1体重;每周称重2次,按实际体重调整给药量,持续8周。造模结束后,各给药组按剂量灌胃给药,空白组给予相同体积蒸馏水,每天1次,连续给药4周。给药结束后,大鼠眼眶取血,于4℃、3 500 r·min-1条件下离心10 min分离血清,-80℃保存;取大鼠左侧肝叶于10%中性PBS福尔马林溶液中固定保存。
血浆指标检测和肝组织病理学检查ALT、AST、TBIL、HMGB-1、IL-1β和TNF-α按试剂盒说明书检测;福尔马林固定肝脏样本经常规脱水、石蜡包埋、切片及HE染色后,显微镜下观察。
统计学分析各组计量数据以x± s表示,采用单因素方差分析(ANOVA)考察显著性,综合数据处理采用因子分析方法[11, 16]。采用SPSS 20.0统计软件处理,显著性概率水平P<0.05。 结果 1 一般情况观察
每日观察各剂量组动物的外观体征、行为活动、毛发变化、大小便形状颜色及有无异常分泌物等。观察结果显示:正常组大鼠体毛光滑、大小便及精神正常;正常和模型何首乌高剂量均见大鼠行为活动减少、毛色不光泽、便黑稍稀。 2 大鼠血清生化指标
模型对照组ALT显著高于正常对照组(P<0.01);何首乌正常高剂量组ALT显著高于正常对照组(P<0.05),表现出明显的损伤作用;而正常低剂量组ALT与正常对照组之间无显著性差异(P>0.05);模型高剂量组ALT低于模型对照组,但无显著性差异;在模型低剂量组中,ALT显著低于模型对照组(P<0.05),AST与模型对照组之间有显著差异(P<0.05),TBA与模型对照组之间也有显著差异(P<0.05)。正常高剂量组TBIL与正常对照组之间有显著差异(P<0.01),提示何首乌显著影响了肝脏胆红素代谢。见图 1。
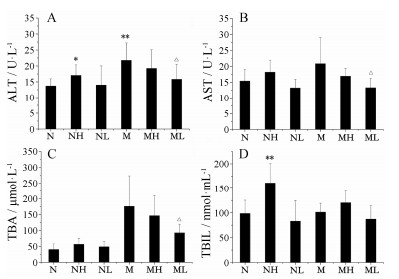 | Figure 1 Testing results of serum biochemical indices. A: Alanine transaminase (ALT); B: Aspartate transaminase (AST); C: Total bile acid (TBA); D: Total bilirubin (TBIL). N: Normal control group; NH: Normal high dose group (20 g·kg-1); NL: Normal low dose group (10 g·kg-1); M: Model control group; MH: Model high dose group (20 g·kg-1); ML: Model low dose group (10 g·kg-1). n = 8, x± s. P < 0.05, **P < 0.01 vs normal control group; △P < 0.05 vs model control group |
与正常对照组比较,模型对照组炎症因子HMGB-1、IL-1β和TNF-α均显著升高(P<0.05或P<0.01),何首乌正常高剂量组HMGB-1和IL-1β显著升高(P<0.01),而正常低剂量组无显著性改变。与模型对照组比较,何首乌模型高剂量组HMGB-1、TNF-α和IL-1β均显著降低(P<0.01或P<0.05)。见图 2。
 | Figure 2 Testing results of serum inflammatory cytokines. A: High mobility group box 1 (HMGB-1); B: Interleukin-1β (IL-1β); C: Tumor necrosis factor-α (TNF-α). N: Normal control group; NH: Normal high dose group (20 g·kg-1); NL: Normal low dose group (10 g·kg-1); M: Model control group; MH: Model high dose group (20 g·kg-1); ML: Model low dose group (10 g·kg-1). n = 8, x± s. P < 0.05, **P < 0.01 vs normal control group; △P < 0.05, △△P < 0.01 vs model control group |
病理切片HE染色发现,与正常对照组比较,何首乌正常低剂量组散在少许炎症细胞中,何首乌正常高剂量组除炎细胞浸润外,还存在汇管区扩大及纤维间隔形成;模型对照组与正常对照组比较,肝窦明显扩张,肝细胞重度空泡变性,偶见轻微点状或小灶状的肝细胞坏死,汇管区见纤维增生;何首乌模型低剂量组与模型对照组比较,肝细胞空泡变性有所减轻,尚见大量炎细胞浸润和纤维组织增生;模型高剂量组与模型对照组比较,肝细胞空泡变性、炎细胞浸润及纤维化程度都明显减轻(图 3)。
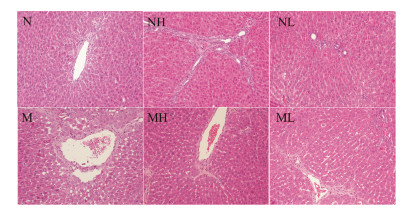 | Figure 3 Typical histopathological section (HE) photographs of rats in different groups (magnification, 200×). N: Normal control group; NH: Normal high dose group (20 g·kg-1); NL: Normal low dose group (10 g·kg-1); M: Model control group; MH: Model high dose group (20 g·kg-1); ML: Model low dose group (10 g·kg-1) |
肝组织Masson染色结果显示,正常对照组少量胶原纤维在汇管区和中央静脉分布,肝小叶间未见纤维组织增生,结构正常;何首乌正常低剂量组胶原纤维在汇管区和中央静脉分布,无明显纤维组织增生;何首乌正常高剂量组肝窦扩大及纤维条索形成;模型对照组大量胶原纤维弥漫分布,将肝小叶分隔成大小不等的肝细胞团,小叶结构紊乱,假小叶形成;何首乌模型低剂量组纤维间隔减少,肝小叶结构保留;何首乌模型高剂量组较模型对照组纤维条索明显减少,小叶结构接近正常(图 4)。
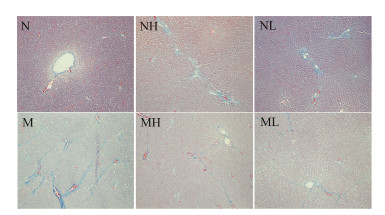 | Figure 4 Typical histopathological section (masson) photographs of rats in different groups (magnification, 100×). N: Normal control group; NH: Normal high dose group (20 g·kg-1); NL: Normal low dose group (10 g·kg-1); M: Model control group; MH: Model high dose group (20 g·kg-1); ML: Model low dose group (10 g·kg-1) |
为了更加直观地显示不同剂量何首乌对正常动物和肝损伤动物的作用特征,将大鼠血清变化明显的7个指标作为原始变量,采用因子分析的方法对原始数据进行降维,提取两个公因子(公因子-1和公因子-2)。两个公因子解释方差的累积贡献率为81.2%,证明所建立的分析模型较好地代表了原始数据的信息。因子分析模型的KMO统计量为0.690,大于可靠性限度(0.5),证明分析模型具有统计学意义;Bartlett's test χ2=68.992,单侧P<0.001,表明所建分析模型可靠。
根据因子分析的特点,变量载荷绝对值越大,对公因子的影响越大。从表 1可以看出,公因子-1主要由IL-1β、TNF-α和HMGB-1贡献,公因子-2主要由TBIL、ALT和TBA贡献。根据指标的意义,可以看出公因子-1(IL-1β、TNF-α和HMGB-1)主要反映了肝脏炎症情况,公因子-2(TBIL、ALT和TBA)主要反映了肝脏生化功能。
|
|
Table 1 Results of factor analysis after a varimax rotation. The value greater than 0.5 of common factor loading has statistically significant |
根据因子载荷图(图 5)和各组的公因子得分情况(表 2),可以看出何首乌量-效/毒应答的演变趋势和统计显著性:模型对照组在横轴方向(公因子-1)与纵轴方向(公因子-2)上都显著远离正常对照组(P<0.01),说明CCl4成功诱导了大鼠肝脏炎症和功能损伤;低剂量何首乌对正常大鼠的损伤作用以及对模型大鼠的保护作用在横、纵坐标上都有一些变化,而横轴变化较显著(P<0.05);高剂量何首乌对正常大鼠的损伤作用在横轴和纵轴上与正常对照组的差异都具有显著性(P<0.01),而对模型大鼠的保护作用主要表现在横轴上显著下降(P<0.01)。
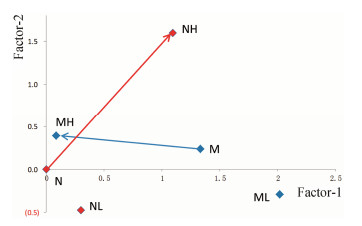 | Figure 5 Factor analysis loading plot of the treatments of Polygonum multiflorum in normal or model groups. N: Normal control group; NH: Normal high dose group; NL: Normal low dose group; M: Model control group; MH: Model high dose group; ML: Model low dose group |
|
|
Table 2 Common factor situation of different doses of Polygonum multiflorum in normal and model animals. n = 8, x±s. P < 0.05, **P < 0.01 vs normal control group; △△P < 0.01 vs model control group |
根据本文结果,大剂量何首乌(20 g·kg-1)确实可以引起正常大鼠的肝脏损伤,病理切片可见炎细胞浸润、肝窦扩大及纤维条索形成,且血清肝功能生化指标ALT、TBIL和炎症因子指标HMGB-1、IL-1β均显著升高(P<0.05或P<0.01),文献[14,15,17,18]研究也证实何首乌可以导致动物肝脏损伤;而大剂量何首乌对CCl4慢性肝损伤模型大鼠却表现出治疗作用,病理切片可见CCl4导致的肝细胞空泡变性、炎细胞浸润及纤维化程度都明显减轻,且血清炎症因子HMGB-1、TNF-α和IL-1β显著下降(P<0.05或P<0.01)。从多指标的因子分析结果可以直观看出(图 5),大剂量何首乌显著改善了模型大鼠的炎症公因子,对肝生化功能公因子也有一定的作用,在载荷图上恢复到离正常对照组非常接近的位置,两个公因子得分与正常对照组无显著性差异(表 2)。概括来说,何首乌用于慢性肝病的治疗可显著改善肝脏组织病理损伤,并明显控制了炎症;但何首乌用于正常大鼠则可以引起肝脏组织病理损伤,肝功能损伤和炎症增强,说明何首乌对肝脏存在"有故无殒"现象,即何首乌在对病(证)用药时表现出保护和治疗作用,而非进一步损伤。同时,结果表明,低剂量何首乌对肝功能生化指标(ALT、AST和TBA)有显著改善作用,但对炎症因子无效;而高剂量何首乌对炎症因子有显著改善作用,但对肝功能生化指标改善效果反而不明显,提示何首乌仍然对肝脏功能有影响,只是这种影响在慢性肝病模型上不明显。需要说明的是,本文采用较高剂量在实验大鼠上模拟何首乌的肝损伤,与临床实际用药情况有差异。考虑到何首乌肝损伤具有特异质的特点[17],含首乌制剂用于敏感个体的慢性肝病治疗仍然可能是风险大于收益,应予以高度关注;但综合考虑大部分非特异质个体应用含有首乌制剂治疗慢性肝病时收益大于风险。
何首乌的"有故无殒"现象与其他含蒽醌类中药如大黄对肝脏的"有故无殒"现象是类似的[10, 11, 12]。"有故无殒"出自《黄帝内经·素问》,指出药物毒与不毒,不仅在于药物本身,更在于其是否对证(病)使用,通俗地说即是"有病则病当之,无病则体受之",是中药传统毒性理论的重要内容,也是最能反映中医辨证用药思想的理论认识之一。"有故无殒"是一个有趣的现象。一般认为,正常状态机体对外界药物毒性刺激的耐受力可能较高,而病理状态机体的耐受力可能较低。但"有故无殒"描述的现象却恰好与一般认知相反。前期通过实验研究和文献调研发现,"有故无殒"现象是客观存在的。如砷制剂可治疗急性白血病,大剂量附子可用于阳厥证患者,抗肿瘤化疗药可治疗癌症,但它们用于正常人或不对证(症)的患者就会产生严重的毒副作用,且其毒副作用与治疗对证(症)患者产生的收益相比,风险要大得多。这种机体状态对药物毒性应答的差异性现象,可用中医"有故无殒"思想进行概括。
就肝脏而言,药物的毒性损伤作用与肝脏的免疫微环境密切相关。国外文献[19]研究表明,处于慢性肝损伤(肝纤维化)病理状态下的小鼠对致死量的肝毒性物质如D-半乳糖苷、脂多糖、四氯化碳或对乙酰氨基酚均表现为很强的耐受性,未发生死亡且仅表现为轻度的肝损害;而正常组小鼠则大部分因急性肝衰竭死亡。其机制研究表明,在正常状态时接触药物(毒物),肝脏处于免疫应激状态的微环境,表现为I型枯否细胞大量激活,释放TNF-α、IL-1和HMGB-1等大量炎症因子,诱发急性肝炎引起肝脏损伤[20,21];而在肝纤维化时肝脏处于免疫抑制状态的微环境,表现为调节T细胞和II型枯否细胞大量产生,同时TNF-α、IL-1和HMGB-1等被显著抑制,因而机体对外部毒性刺激不敏感或不应答[20,21]。这与本文检测炎症因子的结果一致,即大剂量何首乌引起正常动物炎症因子含量增加,而在慢性肝损伤模型动物上大剂量何首乌反而表现出炎症因子降低。关于何首乌对肝脏"有故无殒"现象的机制,制首乌与生首乌的作用差异、含首乌制剂"有故无殒"的评价等问题,还需要更深入的研究阐明。
| [1] | China Pharmacopoeia Committee. Chinese Pharmacopoeia (中华人民共和国药典) [M]. Beijing: China Medical Science Press, 2010. |
| [2] | Kyoung AJ, Hyun JM, Seung SY, et al. Drug-induced liver injury: twenty five cases of acute hepatitis following ingestion of polygonum multiflorum thunb [J]. Gut Liver, 2011, 5: 493-499. |
| [3] | But PP, Tomlinson B, Lee KL. Hepatitis related to the Chinese medicine Shou-wu-pian manufactured from Polygonum multiflorum [J]. Vet Human Toxicol, 1996, 38: 280-282. |
| [4] | Park GJ, Mann SP, Ngu MC. Acute hepatitis induced by Shou Wu-Pian, a herbal product derived from Polygonum multiflorum [J]. J Gastroenterol Hepatol, 2001, 16: 115-117. |
| [5] | Mazzanti G, Batinelli L, Daniele C, et al. New case of acute hepatitis following the consumption of Shou Wu Pian, a Chinese herbal product derived from Polygonum multiflorum [J]. Ann Intern Med, 2004, 140: W30. |
| [6] | Ye QH. One case of toxic liver disease caused by Polygonum multiflorum [J]. Chin J Integr Med (中国中西医结合杂志), 1996, 16: 732. |
| [7] | Liu ZQ, Zhao GY. One case caused by taking over-dose fleece-flower root [J]. Chin J Postgraduates Med (中国医师进修杂志), 1988, 3: 31. |
| [8] | Wang JB, Xiao XH, Du XX, et al. Identification and early diagnosis for traditional Chinese medicine-induced liver injury based on translational toxicology [J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 5-9. |
| [9] | China Food and Drug Administration. Consideration of the risks of liver injury caused by Polygonum multiflorum [EB/OL]. http://www.sda.gov.cn/WS01/CL0051/102902.html. |
| [10] | Wang JB, Zhao HP, Zhao YL, et al. Hepatotoxicity or hepatoprotection? Pattern recognition for the paradoxical effect of the Chinese herb Rheum palmatum L. in treating rat liver injury [J]. PLoS One, 2011, 6: e24498. |
| [11] | Wang YH, Zhao HP, Wang JB, et al. Study on dosage-toxicity/efficacy relationship of prepared rhubarb on basis of symptom-based prescription theory [J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 2918-2923. |
| [12] | Qin LS, Zhao HP, Zhao YL, et al. Protection and bidirectional effect of Rhubarb Anthraquinone and Tannins for rats' liver [J]. Chin J Integr Med (中国中西医结合杂志), 2014, 34: 698-703. |
| [13] | Zeng LN, Ma ZJ, Zhao YL, et al. The protective and toxic effects of rhubarb tannins and anthraquinones in treating hexavalent chromium-injured rats: the Yin/Yang actions of rhubarb [J]. J Hazard Mat, 2013, 246-247: 1-9. |
| [14] | Li Q, Zhao QJ, Zhao YL, et al. High dosage administration of Polygonum multiflorum alcohol extract caused the multi-organ injury in rats [J]. Global Tradit Chin Med (环球中医药杂志), 2013, 6: 1-7. |
| [15] | Wang T, Wang JY, Jiang ZZ, et al. Study on hepatotoxicity of aqueous extracts of Polygonum multiflorum in rats after 28 play oral administration-analysis on correlation of cholestasis [J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 1445-1450. |
| [16] | Wang F. Comparison and application of principal component analysis & factor analysis [J]. Statist Edu (统计教育), 2003, 5: 14-17. |
| [17] | Chang Q, Zhao HJ, Li C, et al. Effects of Radix Polygoni Multiflori Preparata and quantitative exercise on rat liver microcirculation and liver function [J]. Chin J Pharmacovigilance (中国药物警戒), 2014, 11: 193-197. |
| [18] | Li CY, Li XF, Tu C, et al. The idiosyncratic hepatotoxicity of Polygonum multiflorum based on endotoxin model [J]. Acta Pharm Sin (药学学报), 2015, 50: 28-33. |
| [19] | Han YP. Lethal Injury Resistance in Liver Fibrosis is Mediated by Immune Suppression and MMP Silencing [C]. The 7th International Symposium for Alcohol, Viral Hepatitis and Pencreatitis Diseases, 2012. |
| [20] | Bourbonnais E, Raymond VA, Ethier C, et al. Liver fibrosis protects mice from acute hepatocellular injury [J]. Gastroenterology, 2012, 142: 130-139. |
| [21] | Wang XF, Sun R, Wei HM, et al. High-mobility group box 1 (HMGB1)-toll-like receptor (TLR) 4-interleukin (IL)-23-IL-17A axis in drug-induced damage-associated lethal hepatitis: interaction of γδ T cells with macrophages [J]. Hepatology, 2013, 57: 373-384. |
 2015, Vol. 50
2015, Vol. 50

 , 王伽伯1
, 王伽伯1