2. 暨南大学药学院, 广东 广州 510632
2. College of Pharmacy, Jinan University, Guangzhou 510632, China
流感病毒由于其宿主广泛, 易变异, 且可跨种传播, 其防控成为医学界的难题。近年来流感频繁爆 发, 2003年源于东南亚的H5N1亚型高致病性禽流感先后导致约400人死亡; 2009年源于北美的新型甲型H1N1流感导致全球上万人死亡, 目前, 该毒株已成为人与人传播的主要流行性毒株之一; 2013年在我国华东地区散发的H7N9高致病性禽流感也已导致逾100人死亡[1]。目前, 疫苗接种和抗病毒药物分别是预防和治疗流感的主要方法。但流感病毒的亚型多变 异频繁, 严重制约了疫苗的应用。临床用于防治流感的化学药物主要包括金刚烷胺和金刚乙胺等M2离子通道抑制剂、奥司他韦和扎那米韦等神经氨酸酶抑制剂以及利巴韦林等广谱抗病毒药物[2]。但金刚烷胺在临床上应用多年, 已导致普遍的严重耐药性[3]; 奥司他韦和扎那米韦耐药性的报道也日益增多[4, 5]。因此, 如何防控流感成为目前全球高度关注的重大课题。
抗流感病毒新药研究及联合用药防治流感是目前国际医药界的研究热点。联合用药具有提高疗效、减少用药剂量、降低药物不良反应和减缓耐药毒株的产生等优点[6, 7], 因此联合用药对流感的防治具有重要价值。利巴韦林 (ribavirin, 又名病毒唑、三氮唑核苷) 是一种广谱的抗病毒药物, 临床上常用于流感防治, 但利巴韦林长期或过量使用可引起白细胞减少和贫血等不良反应[8]。甘草酸是中药甘草的主要活性成分, 具有抗炎、免疫调节和抗病毒感染等多种生理活性, 临床上已被用于治疗病毒性肝炎[9]。本文应用新型甲型H1N1亚型流感病毒小鼠感染模型评价了甘草酸与利巴韦林单独应用及二者联用对感染小鼠的保护作用, 旨在为其临床应用提供实验依据。
材料与方法主要药物及试剂 甘草酸单铵盐购于四川省维克奇生物科技有限公司, 纯度≥98.0%; 利巴韦林盐酸盐, 广东肇庆星湖生物化学制药厂出品, 含量98.5%。甘草酸单铵盐和利巴韦林盐酸盐均溶于生理盐水, 供动物实验用。TNF-α、IL-6和IL-1β ELISA检测试剂盒购自北京四正柏生物科技有限公司。
动物及细胞6周龄SPF雌性BALB/c小鼠, 体质量18~20 g, 购自广东省医学实验动物中心, 动物合格证号SCXK(粤) 2012-0002。犬肾细胞传代细胞株 (MDCK) 购自中国科学院上海生命科学研究院细胞资源中心。
病毒株新型甲型流感病毒株A/Guangzhou/03/ 2009 (H1N1) 由广州医科大学呼吸疾病国家重点实验室杨子峰副教授惠赠。该病毒经本实验室SPF鸡胚传代扩增并保藏。
主要仪器D-63505生物光学倒置显微镜 (德国Leica公司), IVG-Ⅱ型独立送风隔离笼具 (苏州冯氏公司), HERA cell 150二氧化碳培养箱 (美国Thermo公司)。
小鼠生命保护实验BALB/c小鼠随机分成正常对照组、病毒对照组、实验药物组, 每组10只。小鼠在乙醚轻度麻醉后, 滴鼻感染5倍MLD50 H1N1流 感病毒稀释液, 正常对照组给予等量生理盐水, 每只50 µL。感染前4 h开始灌胃给药, 给药方案见表 1和2, 每天给药2次, 每次0.2 mL, 连续给药6天, 对照组给予等量生理盐水。逐日观察小鼠发病情况并记录其死亡数, 隔天称量小鼠体质量。观察21天, 根据观察结果计算每组小鼠存活率、平均存活时间和平均体质量变化。保护指数 (PI %) = 100 × (病毒对照组死亡率 / 药物组死亡率 - 1) / (病毒对照组死亡率 / 药物组死亡率)。
小鼠肺指数的测定小鼠随机分为正常对照组、病毒对照组、实验药物组, 每组5只, 小鼠在乙醚轻度麻醉后, 滴鼻感染5倍MLD50的病毒稀释液, 正 常对照组滴予等量生理盐水。感染前4 h开始灌胃 给药, 甘草酸给药剂量为50 mg·kg-1·d-1, 利巴韦林为40 mg·kg-1·d-1, 每天2次, 每次0.2 mL, 病毒对照组和正常对照组给予等量生理盐水, 连续给药至第5天处死。
肺指数测定: 攻毒后第5天进行肺指数测定。小鼠称体质量, 颈椎脱臼处死小鼠。取肺组织用0.9% 生理盐水洗2次, 用吸水纸吸干表面水分, 分析天平称肺质量。计算肺指数与肺指数抑制率。肺指数 (%) = 肺质量 / 体质量 × 100%; 肺指数抑制率 (%) = (病毒对照组平均肺指数 - 药物组平均肺指数) / (病毒对照组平均肺指数) × 100%。
小鼠肺病毒滴度测定按肺指数测定方法攻毒给药, 于攻毒后第5天处死小鼠, 取小鼠肺脏, 放入无菌匀浆器, 加入PBS 2 mL, 冰上研磨肺脏, 过滤, 4 ℃、3 000 r·min-1离心15 min, 制备肺组织上清液, 按照终点稀释法测定病毒滴度[10]。主要流程为: 肺组织上清液以DMEM基础培养液10倍系列稀释5个 稀释度, 每个稀释度3个重复, 接种至长满MDCK细胞的96孔板, 每孔0.1 mL, 于37 ℃、5% CO2培养箱中培养, 连续观察细胞凋亡情况, 以72 h时细胞凋亡率为依据, 按Reed-Muench法计算小鼠肺组织病毒滴度[11]。
小鼠血浆中炎症因子的测定按肺指数测定方法攻毒给药, 于攻毒后第5天处死小鼠, 腹腔动脉采血, 收集的血液离心取上部血浆, 置于 -80 ℃冻存待测。细胞因子TNF-α、IL-6和IL-1β的检测采用酶联免疫法 (双抗体夹心ELISA法), 按照试剂盒说明书进行。终止反应后, 选择450 nm波长进行检测, 记录结果。
数据分析所有数据均用统计软件SPSS 17.0进行统计学处理, 数据均以x± s表示, 小鼠存活率组间比较采用χ2检验, 其他参数组间比较采用t检验。联合用药实验结果用MacSynergy II软件进行统计, 分析药物相互作用的情况。MacSynergy II分析法是根据Prichard和Shipman的方法, 采用MacSynergy II数据分析与统计评价程序, 对联合用药的实验数据进行分析。该方法从各药物单独作用的量效关系计 算药物联合应用的理论相加值。正值则计为协同量(synergy volume), 负值则计为拮抗量 (antagonism volume)。在95% 的置信范围, 协同量 > 100定义为强协同效应, 协同量50~100之间为中等协同效应, 协同量25~50之间为弱协同效应, 协同量0~25之间定义为无协同效应 (相加作用)。如果协同量为负数, 则对应为拮抗效应[12]。
结果 1 甘草酸和利巴韦林联用对感染流感病毒小鼠的保护作用两种药物单独应用的体内药效实验结果见表 1。甘草酸 (100 mg·kg-1·d-1) 和利巴韦林 (80 mg·kg-1·d-1) 对感染小鼠的生命保护率分别为56% 和89%, 低于该浓度时两药有不同程度的保护作用, 但与病毒对照组比较差异不显著。甘草酸 (25和50 mg·kg-1·d-1) 分别与利巴韦林 (20和40 mg·kg-1·d-1) 联用评价其对感染H1N1流感病毒小鼠的保护作用, 结果见表 2。与甘草酸和利巴韦林单独用药相比, 两药联用后感染小鼠的存活率和死亡小鼠平均存活时间 (MDD) 均有不同程度的改善。甘草酸和利巴韦林联用对小鼠生命保护的协同值为112, 表明两药联用具有强协同效应。甘草酸 (50 mg·kg-1·d-1) 和利巴韦林 (40和20 mg·kg-1·d-1) 联用对小鼠生命保护的协同值分别为36和28, 甘草酸 (25 mg·kg-1·d-1) 与利巴韦林 (40和20 mg·kg-1·d-1) 联用对小鼠生命保护的协同值分别为22和26, 表明两药联用对防治小鼠流感具有协同效应。当甘草酸(50 mg·kg-1·d-1) 与利巴韦林 (40 mg·kg-1·d-1) 联用时, 对感染小鼠的保护率达到100% (图 1)。此外, 甘草酸和利巴韦林联用对感染小鼠的体重下降的抑制作用优于单用甘草酸和利巴韦林 (图 2)。
|
|
Table 1 Protection of glycyrrhizin (Gly) and ribavirin (Rib) used alone on influenza A H1N1 virus infected mice. n = 10, x± s. aProtection index; bMean day to death (MDD) of mice dying prior to day 21. *P < 0.05, **P < 0.01, ***P < 0.001 vs Placebo |
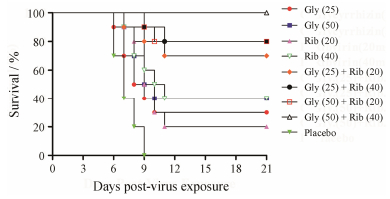 | Figure 1 Effects of glycyrrhizin and ribavirin used alone or in combination for treatment of an influenza A H1N1 virus infection in mice. BALB/c mice were infected 5MLD50 of influenza A H1N1 virus. Oral treatments were administered twice daily for a consecutive 6 d starting 4 h before virus exposure. n = 10, x± s |
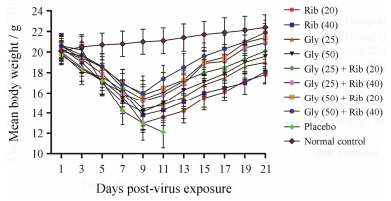 | Figure 2 Body weight changes during treatment of an influenza A H1N1 virus infection in mice with glycyrrhizin and ribavirin used alone or in combination. Oral treatments were administered twice daily for a consecutive 6 d starting 4 h before virus exposure. n = 10, x± s |
为进一步考察甘草酸和利巴韦林联合对感染H1N1流感病毒小鼠的肺炎是否有协同抑制作用, 作者测定了小鼠肺指数。根据表 2中的结果, 实验药物剂量设为50 mg·kg-1·d-1的甘草酸与40 mg·kg-1·d-1
|
|
Table 2 Protection of glycyrrhizin and ribavirin used alone or in combination on influenza A H1N1 virus infected mice. n = 10, x± s. P < 0.05, **P < 0.01, ***P < 0.001 vs Placebo; ΦP < 0.05, ΦΦP < 0.01 vs Rib (20) or Rib (40) used alone; ΨP < 0.05, ΨΨP < 0.01 vs Gly (25) or Gly (50) used alone |
的利巴韦林联用。正常小鼠肺指数在0.7%~0.8%内, 小鼠感染H1N1流感病毒后引发肺部炎症, 肺质量增加, 肺指数相应增加。表 3表明, 甘草酸和利巴韦林联用组小鼠肺指数显著低于病毒对照组 (P < 0.01), 也显著低于两药的单独应用(P < 0.05)。联合用药的肺指数抑制率为36%, 而甘草酸和利巴韦林单独用药组小鼠肺指数抑制率分别为19% 和21%。两药联用对感染H1N1流感病毒小鼠肺指数的拮抗值为 -0.84, 接近于0, 对肺炎的抑制表现为相加作用。
|
|
Table 3 Effects of glycyrrhizin and ribavirin used alone or in combination on lung parameters of mice infected with influenza A H1N1 virus. n = 5, x± s. *P < 0.05, **P < 0.01 vs Placebo; #P < 0.05 vs Rib (40) used alone; ΨP < 0.05 vs Gly (50) used alone |
根据文献[13]报道和预实验的结果, 流感病毒感染小鼠后第1天就开始在小鼠肺内增殖, 至第4~6天小鼠肺病毒滴度达到最高, 而后逐渐下降。因此, 本实验测定了感染后第5天小鼠的肺病毒滴度。图 3肺病毒滴度结果表明, 甘草酸和利巴韦林联用组小鼠肺内病毒滴度为101.87 TCID50/0.1 mL, 显著低于病毒对照组的病毒滴度 (103.38 TCID50/0.1 mL) (P < 0.01),同时也显著低于甘草酸 (102.87 TCID50/0.1 mL) 单独用药组 (P < 0.05)。甘草酸和利巴韦林联用对感染H1N1流感病毒小鼠肺部病毒抑制的协同值为4.39, 表现为相加作用。
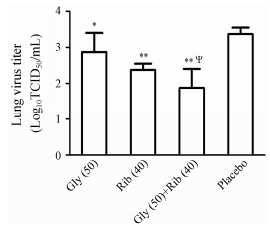 | Figure 3 Inhibition of glycyrrhizin (50 mg·kg−1·d−1) and ribavirin (40 mg·kg−1·d−1) used alone or in combination on mice lung virus titers on day 5 post influenza A H1N1 virus infection. Oral treatments were given twice a day starting 4 h before virus exposure, with the last treatment administered 4 h prior to sacrifice of the mice. n = 5, x±s. *P < 0.05, **P < 0.01 vs Placebo; ΨP < 0.05 vs glycyrrhizin used alone |
甘草酸和利巴韦林联用对感染病毒后第5天小鼠血浆中炎症因子TNF-α、IL-6和IL-1β表达的影 响结果 (图 4) 表明, 单用甘草酸 (50 mg·kg-1·d-1) 或利巴韦林 (40 mg·kg-1·d-1) 显著降低小鼠体内TNF-α和IL-6的含量; 两药联用显著降低小鼠体内TNF-α、IL-6和IL-1β的含量。同时, 两药联用对TNF-α和IL-6的抑制作用显著优于40 mg·kg-1·d-1利巴韦林单独用药。因此, 甘草酸与利巴韦林联用有利于减少病毒感染诱导的炎症因子的产生。
 | Figure 4 Effects of glycyrrhizin (50 mg·kg−1·d−1) and ribavirin (40 mg·kg−1·d−1) used alone or in combination on expression of TNF-α, IL-6 and IL-1β of mice on day 5 post infection of influenza A H1N1 virus. Concentratios of TNF-α, IL-6 and IL-1β in plasm collected from mice were determined by ELISA. P < 0.05, **P < 0.01 vs Placebo; #P < 0.05, ##P < 0.01 vs ribavirin used alone |
利巴韦林为嘌呤三氮唑化合物, 是一种广谱抗病毒药物, 作用机制是利巴韦林进入体细胞后迅速被磷酸化, 其产物对参与病毒合成的多种酶均有抑制作用, 其对流感病毒的抑制主要作用于病毒RNA聚合酶。1986年利巴韦林被美国FDA批准以喷雾吸入治疗流感病毒和呼吸道合胞病毒感染, 此后又被批准用于丙型肝炎的治疗。目前, 被批准可用于流感治疗的三类化学药物中, 金刚烷胺已有十分严重的耐药性, 奥司他韦等神经氨酸酶 (NA) 抑制剂的耐药性也日益普遍, 但目前还没有利巴韦林耐药的相关报道。鉴于近年来流感疫情的爆发日益频繁, 利巴韦林在流感防治上的研究及临床应用日益受到重视。高荣梅等[14]报道, 利巴韦林注射液在MDCK细胞中对A、B型流感病毒的增殖均有显著抑制活性; 对感染流感病毒小鼠, 利巴韦林注射液在低病毒量感染时与奥司他韦相当, 在高病毒量感染时明显优于奥司他韦对照组。但是利巴韦林存在一定的不良反应, 包括过敏反应、药疹、再生障碍性贫血等, 长期应用还可致畸胎。为减少利巴韦林的不良反应, 同时提高其药效, 本研究以甘草酸与利巴韦林联用, 考察了二者联用对感染H1N1亚型流感病毒小鼠的保护作用。结果表明, 二者联用可显著减少小鼠肺部病毒滴度及炎症, 提高小鼠存活率, 药效优于利巴韦林单用, 可显著降低利巴韦林的给药剂量, 为临床合理用药治疗流感提供了实验依据。
甘草是一种使用最为广泛的中药材, 其主要有效成分为五环三萜类皂苷甘草酸 (glycyrrhizinic acid) 及其苷元甘草次酸 (glycyrrhetinic acid)。许多研究 [15, 16, 17, 18, 19, 20]表明, 甘草酸和甘草次酸具有多种生物活性, 例如抗炎、抗氧化、抗病毒、抗肿瘤和抗菌等。Raphael等[21]报道甘草酸腹腔注射可显著提高小鼠血液中总的白细胞数量, 抑制绵羊红细胞诱导的脚趾肿胀。Takei等[22]报道甘草酸盐能抑制全身炎症反应综合征 (SIRS) 小鼠模型的多核中性粒细胞产生CC类趋化因子配体 (CCL2)。另一研究证实其还抑制了该途径引起的巨噬细胞聚集[23]。Bordbar等[24]证明甘草酸可以增加树突细胞的CD40, CD86和MHC-II的表达, 增强T细胞的增殖能力和活性, 促进细胞因子IFN-γ和IL-10的产生, 抑制IL-4的生成。这些研究表明甘草酸具有抗炎和增强机体非特异性细胞免疫功能。还有多篇文献报道了甘草酸的抗流感病毒作用。Wolkerstorfer等[25]证实甘草酸在A549细胞中显著抑制流感病毒的复制, 其机制并非直接抑制流感病毒, 也不是作用于细胞的病毒受体, 而是通过干预细胞膜对病毒的胞吞过程从而阻止病毒的侵入。Michaelis等[26]证明在人巨噬细胞中甘草酸抑制H5N1病毒诱导产生的IL-6、CXCL10和CCL5的表达, 抑制病毒诱导细胞凋亡, 但不干预病毒的复制。Michaelis等[27]还发现在A549细胞中甘草酸抑制H5N1病毒的复制及病毒诱导的促炎因子的表达, 其机制部分归因于甘草酸干预H5N1病毒诱导的活性氧生成进而减弱肺细胞p38、JNK和NF-κB炎症通路的活化。
本研究中甘草酸单用对感染H1N1病毒小鼠有显著保护作用, 但并不能完全保护感染小鼠。在剂量高达100 mg·kg-1·d-1时对感染小鼠的保护率只有60%。但甘草酸 (50 mg·kg-1·d-1) 与利巴韦林 (40 mg·kg-1·d-1) 联用使感染小鼠全部存活, 疗效显著优于二者单用, 显示出协同的抗流感病毒作用。根据人与小鼠给药剂量的换算系数 (0.11), 20 g体重小鼠的利巴韦林给药剂量是40 mg·kg-1·d-1, 相当于60 kg体重的人给药剂量4.4 mg·kg-1·d-1, 十分安全。
大量研究表明, 流感病毒感染的致病性取决于病毒的毒力及宿主的免疫反应。病毒一旦进入机体, 机体迅速启动免疫系统以清除病毒。但过度的免疫 反应会导致炎症发生, 严重损害机体组织器官。在病毒感染致病过程中, 若能在抗病毒治疗的同时应用抗炎及免疫调节药物干预肺炎进程, 最大限度地减少过度免疫反应导致的肺损害, 则可显著减缓病毒感染引起的症状, 减少人或动物的死亡。多个研究证明了免疫调节剂与抗病毒药物联用可获得显著提高的药效[28, 29]。Zheng等[30]应用NA抑制剂扎那米韦 (zanamivir) 和抗炎药塞来昔布 (celecoxib) 及美沙拉嗪 (mesalazine) 联合治疗感染高致病性H5N1流感病毒小鼠, 结果小鼠存活率显著提高。本研究结果显示甘草酸单用抑制了病毒感染诱导的小鼠炎症因子IL-6和TNF-α的表达, 使小鼠的肺部炎症减轻, 表明甘草酸对流感病毒感染性肺炎具有显著抑制活性。甘草酸与利巴韦林联用获得了对感染小鼠的完全保护, 再次证明抗炎药物与抗病毒药物的联用在流感疫情的防治上具有重要价值。
| [1] | WHO. Human infection with avian influenza A (H7N9) [EB/OL]. 2015-01-02. http://www.wpro.who.int/outbreaks_ emergencies/H7N9/en/. |
| [2] | Beigel J, Bray M. Current and future antiviral therapy of severe seasonal and avian influenza [J]. Antiviral Res, 2008, 78: 91-102. |
| [3] | Townsend MB, Smagala JA, Dawson ED, et al. Detection of amantadine-resistant influenza on microarray [J]. J Clin Virol, 2008, 42: 117-123. |
| [4] | Ujike M, Ejina M, Anraku A, et al. Monitoring and characterization of oseltamivir-resistant pandemic (H1N1) 2009 virus Japan [J]. Emerg Infect Dis, 2011, 17: 470-479. |
| [5] | Hurt AC, Holien JK, Parker M, et al. Zanamivir-resistant influenza viruses with a novel neuraminidase mutation [J]. J Virol, 2008, 83: 10366-10373. |
| [6] | Ilyushina NA, Hay A, Yilmaz N, et al. Oseltamivir-ribavirin combination therapy for highly pathogenic H5N1 influenza virus infection in mice [J]. Antimicrob Agents Chemother, 2008, 52: 3889-3897. |
| [7] | Kim, WY, Suh, GY. Triple-combination antiviral drug for pandemic H1N1 influenza virus infection in critically ill patients on mechanical ventilation [J]. Antimicrob Agents Chemother, 2011, 55: 5703-5709. |
| [8] | Ishihara T, Kaneko K, Ishihara T, et al. Development of biodegradable nanoparticles for liver-specific ribavirin delivery [J]. Pharmaceutics, 2014, 103: 4005-4011. |
| [9] | Han YD, Wang B, Wang ZY, et al. Recent research progress in pharmacological effects of glycyrrhizic acid [J]. Chin J New Drugs (中国新药杂志), 2012, 21: 2499-2505. |
| [10] | Scotti PD. End-point dilution and plaque assay methods for titration of cricket paralysis virus in cultured Drosophila cells [J]. J Gen Virol, 1977, 35: 393-396. |
| [11] | Reed LJ, Muench H. A simple method of estimating fifty percent endpoints [J]. Am J Hyg, 1938, 27: 493-497. |
| [12] | Prichard MN, Aseltine KR, Shipman CJ. MacSynergy II. Version 1.0. User's Manual [M]. Ann Arbor: University of Michigan, 1993. |
| [13] | Zhou XM, Lu CN. In vivo anti-avian influenza virus activity of Qingkailing and Shuanghuanglian orals [J]. Chin Tradit Herb Drugs (中草药), 2011, 42: 1351-1356. |
| [14] | Gao RM, Li XQ. In vitro and in vivo anti-influenza virus activity of ribavirin injection [J]. Acta Pharm Sin (药学学报), 2010, 45: 403-407. |
| [15] | Tang HF, Mao LG, Jiang RA, et al. Protective effect against monoammonium glycyrrhizinate on lipopolysaccharide-induced acute lung injury in mice [J]. Acta Pharm Sin (药学学报), 2007, 42: 954-958. |
| [16] | Yuan H, Ji WS, Wu KX, et al. Anti-inflammatory effect of diammonium glycyrrhizinate in a rat model of ulcerative colitis [J]. World J Gastroenterol, 2006, 12: 4578-4581. |
| [17] | Li XL, Zhou AG. Evaluation of the immunity activity of glycyrrhizin in AR mice [J]. Molecules, 2012, 17: 716-727. |
| [18] | Takei M, Kobayashi M, Li XD, et al. Glycyrrhizin inhibits R5 HIV replication in peripheral blood monocytes treated with 12-methyladeno sine [J]. Pathobiology, 2005, 72: 117-123. |
| [19] | Fiore C, Eisenhut M, Krausse R, et al. Antiviral effects of glycyrrhiza species [J]. Phytother Res, 2008, 22: 141- 148. |
| [20] | Abe M, Akbar SMF, Hasebe A, et al. Glycyrrhizin enhances interleukin-10 production by liver dendritic cells in mice with hepatitis [J]. J Gastroenterol 2003; 38: 962-967. |
| [21] | Raphael TJ, Kuttan G. Effect of naturally occurring triterpenoids glycyrrhizic acid, ursolic acid, oleanolic acid and nomilin on the immune system [J]. Phytomedicine, 2003, 10: 483-489. |
| [22] | Takei M, Kobayashi M, Herndon DN, et al. Glycyrrhizin inhibits the manifestations of anti-inflammatory responses that appear in association with systemic inflammatory response syndrome (SIRS)-like reactions [J]. Cytokine, 2006, 35: 295- 301. |
| [23] | Yoshida T, Tsuda Y, Takeuchi D, et al. Glycyrrhizin inhibits neutrophil-associated generation of alternatively activated macrophages [J]. Cytokine, 2006, 33: 317-322. |
| [24] | Bordbar N, Karimi MH, Amirghofran Z. The effect of glycyrrhizin on maturation and T cell stimulating activity of dendritic cells [J]. Cell Immunol, 2012, 280: 44-49. |
| [25] | Wolkerstorfer A, Kurz H, Bachhofner N, et al. Glycyrrhizin inhibits influenza A virus uptake into the cell [J]. Antiviral Res, 2009, 83: 171-178. |
| [26] | Michaelis M, Geiler J, Naczk P, et al. Glycyrrhizin inhibits highly pathogenic H5N1 influenza a virus-induced pro-inflammatory cytokine and chemokine expression in human macrophages [J]. Med Microbiol Immunol, 2010, 199: 291- 297. |
| [27] | Michaelis M, Geiler J, Naczk P, et al. Glycyrrhizin exerts antioxidative effects in H5N1 influenza A virus-infected cells and inhibits virus replication and pro-inflammatory gene expression [J]. PLos One, 2011, 6: 19705. |
| [28] | Ludwig S. Targeting cell signalling pathways to fight the flu: towards a paradigm change in anti-influenza therapy [J]. J Antimicrob Chemother, 2009, 64:1-4. |
| [29] | An SC, Xu LL, Li FD, et al. Triple combinations of neuraminidase inhibitors, statins and fibrates benefit the survival of patients with lethal avian influenza pandemic [J]. Med Hypotheses, 2011, 77: 1054-1057. |
| [30] | Zheng BJ, Chan KW, Lin YP, et al. Delayed antiviral plus immunomodulator treatment still reduces mortality in mice infected by high inoculum of influenza A/H5N1 virus [J]. Proc Natl Acad Sci USA, 2008, 105: 8091-8096 |
 2015, Vol. 50
2015, Vol. 50


