全蝎作为传统中药,具有多种药用功效,如抗肿瘤、抗血栓和镇痛等[1, 2]。蝎毒素是蝎尾毒腺分泌的多肽,是中药全蝎的主要活性成分。作为一种新型的多肽类药物,蝎毒素表现出较好的研究潜力和应用前景[3, 4, 5, 6, 7]。蝎毒镇痛活性肽BmK AngM1是从东亚钳蝎 (Buthusmartensii Karsch) 蝎毒中分离得到的一种新型长链蝎毒素,其镇痛活性强且毒性低,有望开发成镇痛新药[8]。但BmK AngM1在蝎毒中含量极低,难以得到足够量的纯品,这大大限制了其作用机制的深入研究及实际应用的推广。鉴于此,作者通过将BmK AngM1基因转入毕赤酵母,获得了能产生重组BmK AngM1的工程菌株。
毕赤酵母 (Pichia pastoris) 的重要生物学特性是能利用甲醇作为唯一的碳源和能源。根据代谢甲醇速率的不同,重组毕赤酵母分为甲醇利用缓慢型 (Muts) 和快速型 (Mut+) 两种表型。这两种甲醇利用表型是由重组载体在毕赤酵母中的重组方式决定的[9]。外源基因在毕赤酵母中的重组方式主要有两种[10]: 一是含有外源基因的重组载体通过双交换的方式整合到毕赤酵母基因组中,产生的重组菌株基因型为His+Muts。由于醇氧化酶基因1 (AOX1) 被外源基因置换,细胞只能通过具有微弱转录能力的醇氧化酶基因2 (AOX2) 表达的醇氧化酶来代谢甲醇,而AOX2的活性只有AOX1的1/10,因此细胞代谢甲醇速率很慢,一般只有Mut+重组子的1/4,甚至更慢; 二是含有外源基因的重组载体通过单交换的方式整合到毕赤酵母基因组中,产生的重组菌株基因型为His+Mut+。外源基因插入AOX1基因上游或下游,并且这一过程可重复发生,因此可获得含更多拷贝外源基因的转化子。由于Mut+重组子中AOX1基因仍能正常表达,在甲醇诱导下能产生大量的醇氧化酶,从而细胞代谢甲醇能力较强,通过甲醇完全氧化途径为细胞提供大量的能量,因此其利用甲醇能力与野生型相同[11]。Muts和Mut+重组子对甲醇代谢速率不同,这对重组菌株表达外源蛋白产生一定的影响,主要表现在外源蛋白表达产率和细胞比生长速率等方面。
本实验将BmK AngM1基因转入毕赤酵母,得到Muts和Mut+重组子,采用实时荧光定量PCR方法,筛选出均含单拷贝BmK AngM1基因的重组子,进而在基因转录和蛋白表达水平比较了这两种重组子在表达BmK AngM1水平上的差异。
材料与方法 菌株和质粒重组质粒pPIC9K-BmK AngM1由本实验室构建。BmK AngM1基因根据其cDNA序列 (GenBank: AF062563) 并结合毕赤酵母的密码子偏爱性人工合成。本研究使用的菌株和质粒见表 1。
|
|
Table 1 Strains andplasmids used in the research |
试剂:普通Taq聚合酶 (北京全式金生物技术有限公司); 质粒提取试剂盒和酵母基因组DNA提取试剂盒 (天根生化科技有限公司); 酵母RNA提取试剂盒和实时荧光定量PCR试剂盒 (康为世纪生物有限公司); 高效率逆转录试剂 (TOYOBO公司); 其他试剂均为国产分析纯。仪器: 3K18型低温高速离心机 (Sigma公司); HZQ-Q型振荡器 (哈尔滨东联电子技术开发有限公司); Mini 2D型电泳仪 (Bio-Rad公司);PCR仪 (Eppendorf公司); 实时荧光定量PCR仪(Roche公司)。
培养基YPD培养基 (1% 酵母提取物、2% 胰蛋白胨、2% 葡萄糖、固体培养基加1.5% 琼脂); LB培养基 (0.5% 酵母提取物、1% 胰蛋白胨、1% 氯化钠、固体培养基加1.5% 琼脂); BMGY培养基 (1% 酵母提取物、2% 胰蛋白胨、1% 甘油、0.1 mol·L-1磷酸钾缓冲液pH 6.0、1.34% YNB、4×10-5 % 生物素); MD平板 (2% 葡萄糖、1.34% YNB、4×10-5 % 生物素、1.5% 琼脂); MM平板 (2% 葡萄糖、0.5% 无水甲醇、1.34% YNB、4×10-5 % 生物素、1.5% 琼脂)。
毕赤酵母转化和重组子筛选参照ThePichia Expression Kit说明书,将重组质粒pPIC9K-BmK AngM1经Bgl II酶切线性化后,切胶回收带有目的基因的大片段,通过LiCl/SS Carrier DNA/PEG方法转化毕赤酵母[12],涂布MD平板,30 ℃培养2~3天。提取转化子基因组DNA,以5'AOX/3'AOX为引物 (表 2) 进行PCR扩增。PCR反应体系: Taq聚合酶 (2×) 7.5 μL、5'AOX引物 (10 μmol·L-1) 1 μL、3'AOX引物 (10 μmol·L-1) 1 μL、基因组DNA (20 ng) 1 μL、ddH2O4.5 μL。PCR反应程序: 94 ℃ 5 min,(94 ℃ 30 s,52 ℃ 30 s,72 ℃ 2 min) × 25循环,72 ℃ 10 min。通过PCR鉴定目的基因是否整合到毕赤酵母基因组中,并进一步验证其表型,获得含单拷贝BmK AngM1基因的Muts重组子。将重组质粒pPIC9K-BmKAngM1经Sac I酶切线性化后,转入毕赤酵母,通过PCR确证Mut+重组子。采用实时荧光定量PCR方法,确定Mut+重组子中BmK AngM1基因的拷贝数。
|
|
Table 2 List of primersequences |
将带有目的基因的基因组DNA (100 ng) 进行10、102、103、104和105倍稀释,并以稀释的基因组DNA为模板,分别以BmK AngM1-F/ BmK AngM1-R、actin-F/actin-R为引物 (表 2) 进行实时荧光定量PCR,得到各自的Ct值,通过Ct值与基因组DNA量之间存在的线性关系,获得BmK AngM1和actin基因标准曲线。
重组子中BmK AngM1基因拷贝数的测定基因拷贝数的测定采用实时荧光定量PCR方法: 以含单拷贝BmK AngM1基因的Muts重组子基因组DNA为模板作为对照,以Mut+重组子基因组DNA为模板,以BmK AngM1-F/BmK AngM1-R和actin-F/actin-R为引物 (表 2),进行实时荧光定量PCR反应,每个样品进行3次重复。反应体系: ultraSYBR Mixture (2×) 10 μL、PCR下游引物 (10 μmol·L-1) 0.5 μL、PCR上游引物 (10 μmol·L-1) 0.5 μL、基因组DNA (50 ng)2 μL、RNase-Free water 7 μL。反应程序 (两步法): 95 ℃ 10 min,(95 ℃ 15 s,60 ℃ 1 min) × 40循环。熔解曲线分析: 95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。通过上述方法进行实时荧光定量PCR反应,得到相应BmK AngM1基因的Ct值和actin基因的Ct值,根据2-ΔΔCt算法[13],即可计算出Mut+型重组子中BmK AngM1基因的拷贝数。
BmK AngM1 基因转录水平比较Mut+和Muts重组子在甲醇诱导培养12 h后,分别取适量菌液,参照酵母RNA提取试剂盒说明书,提取重组子总RNA。参照高效率逆转录试剂盒说明书,将总RNA进行反转录,得到cDNA第一链,以其作为实时荧 光定量PCR的模板。反转录条件: 37 ℃ 15 min,50 ℃ 5 min,98 ℃ 5 min。
采用实时荧光定量PCR方法,比较Mut+和Muts重组子中BmK AngM1基因转录水平。以cDNA为模板,以BmK AngM1-F/ BmK AngM1-R和actin-F/actin-R进行实时荧光定量PCR。实时荧光定量反应体系和程序同上。
重组BmK AngM1蛋白表达水平检测Mut+、Muts重组子和对照菌株 (转入pPIC9K质粒的重组子) 分别接种于BMGY培养基中,30 ℃,220 r·min-1,振荡培养48 h后,每24 h加1.2 % (v/v)甲醇诱导。诱导6天后,将发酵液12 000r·min-1离心5 min,收集上清液,取20μL进行SDS-PAGE电泳,银染,并用图像处理软件Quantity one对SDS-PAGE结果进行灰度定量,用统计分析软件SPSS对定量结果进行统计分析。
结果1 Mut+和Muts重组子的鉴定
质粒pPIC9K-BmK AngM1用Sac I酶切线性化,线性化的片段为9 500bp (图 1)。将其通过LiCl/SS Carrier DNA/PEG方法转化毕赤酵母,涂布MD平 板,30 ℃培养2~3天,然后在MM平板上进行筛选。任意挑取6个转化子,提取基因组DNA,以5'AOX/3'AOX为引物,利用PCR方法鉴定阳性转化子,结果见图 2。以转化子基因组DNA为模板进行PCR,同时扩增出含BmK AngM1基因片段 (750 bp) 和AOX1基因片段 (2 200bp),结果与理论值相符,表明外源BmK AngM1基因已整合到毕赤酵母基因组中,且转化子均为Mut+重组子。以GS115基因组DNA为模板进行PCR,只能扩增出AOX1基因。质粒pPIC9K- BmK AngM1用Bgl II酶切线性化,得到两个片段 (7 500 bp和2 000 bp),结果见图 1。切胶回收含有目的基因的大片段,通过LiCl/SS Carrier DNA/PEG方法转化毕赤酵母,在MD平板上培养,任意选取8个转化子提取基因组DNA,利用PCR方法筛选阳性重组子,结果见图 3。以转化子基因组DNA为模板时,以5'AOX/3'AOX为引物,均可扩增出含目的基因的条带 (750 bp),表明BmK AngM1基因已整合到毕赤酵母基因组DNA中,同时未扩增出AOX1基因,表明在转化过程中基因发生了双交换,AOX1基因已被BmK AngM1基因置换。因此,该阳性重组子的表型为Muts。
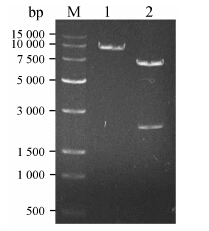
|
Figure 1 Analysisof pPIC9K-BmK AngM1 plasmid by single enzyme digestion. M: Marker;1: pPIC9K-BmK AngM1 plasmid digested by Sac I; 2: pPIC9K-BmKAngM1 plasmid digested by Bgl II |
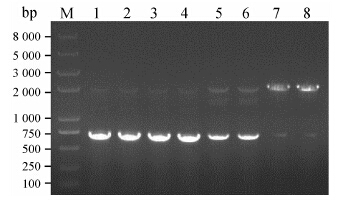
|
Figure 2 Identificationof Muts recombinants by PCR. M: Marker; 1-6: Mut+positive recombinants; 7,8: Negative control |
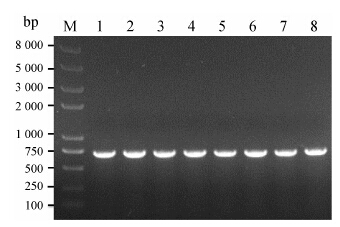
|
Figure 3 Identificationof Muts recombinants by PCR. M: Marker; 1-8: Mutspositive recombinants |
2 Mut+重组子中BmK AngM1基因拷贝数的测定
由于Muts重组子中BmK AngM1基因是通过双交换方式整合到毕赤酵母基因组中,AOX1基因已被BmK AngM1基因置换,因此Muts重组子为含单拷贝BmK AngM1基因的菌株,而Mut+重组子BmK AngM1基因是通过单交换方式插入酵母基因组中,在此过程中可发生多次单交换,因此产生了含多拷贝BmK AngM1基因的转化子。采用实时荧光定量PCR方法,筛选出含单拷贝BmK AngM1基因的Mut+重组子。应用相对定量实时荧光定量PCR方法计算基因拷贝数时,要求目的基因和内参基因的引物扩增的特异性好和扩增效率高。通过熔解曲线可判断引物扩增的特异性,通过标准曲线可判断引物的扩增效率。通过对BmK AngM1和actin两个基因的熔解曲线分析可以看出,两个基因的熔解曲线都是单峰,说明在PCR扩增过程中,没有出现非特异性扩增,由此推断定量PCR扩增所获得的数据是可靠的。通过实时荧光定量PCR得到BmK AngM1和actin的标准曲线,结果如图 4,根据其标准曲线的线性回归分析可计算出斜率 (slope),然后依据相对定量PCR扩增效率计算公式E = 10(-1/slope) - 1,计算得出BmK AngM1基因和actin基因的引物扩增效率分别为98.1% 和100.05%,此结果说明设计的引物扩增效率高。因此,使用2-ΔΔCt公式得到的拷贝数结果可信。

|
Figure 4 Thestandard curves of actin gene and BmK AngM1 gene |
Mut+重组子中BmK AngM1基因拷贝数的计算: 以Muts含单拷贝BmK AngM1基因重组子的基因组DNA作为对照,选取6个Mut+重组子,提取其基因组DNA,进行实时荧光定量PCR,每个样品进行3次重复。得到BmK AngM1基因的Ct值和actin基因的Ct值,根据2-ΔΔCt公式,计算出Mut+重组子的基因拷贝数,见表 3。结果表明,其中1#、2#、3#和6#重组子均为含单拷贝BmK AngM1基因的重组子。选取1#重组子进行后续实验。
|
|
Table 3 Copy numbers ofthe BmK AngM1 gene detected by real-time PCRusingSYBR Green |
3Muts和Mut+重组子中BmK AngM1基因转录水平比较
均含单拷贝BmK AngM1基因的Mut+和Muts重组子在甲醇诱导培养12 h后,取适量菌液,参照酵母RNA提取试剂盒说明书,提取重组子总RNA,以其为模板反转录得到cDNA。以Mut+重组子cDNA作为对照,以Muts重组子cDNA为模板,以引物BmK AngM1-F/BmK AngM1-R和actin-F/actin-R进行实时荧光定量PCR,结果表明,Muts重组子中BmK AngM1基因转录水平是Mut+重组子的2.7倍(图 5)。
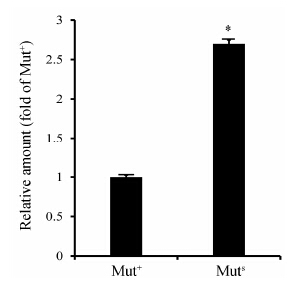
|
Figure 5 Comparison ofthe transcription level of BmK AngM1 gene in the Mut+ andMuts recombinants. *P < 0.05 |
4 Muts和Mut+重组子中BmK AngM1蛋白表达水平比较
取含单拷贝BmK AngM1基因的Mut+重组子、Muts重组子和转入空载体pPIC9K的重组子,接种 到BMGY培养基中,30 ℃振荡培养,甲醇诱导培养 6天后,进行SDS-PAGE鉴定。如图 6a所示,在发酵液上清中检测到10 kDa左右的蛋白,说明毕赤酵母成功表达了BmK AngM1。与Mut+重组子相比,Muts重组子中BmK AngM1的蛋白表达量明显提高。Quantity one软件分析重组蛋白条带灰度值,结果表明,Muts重组子表达BmK AngM1的水平是Mut+重组子的1.5倍(图 6b)。
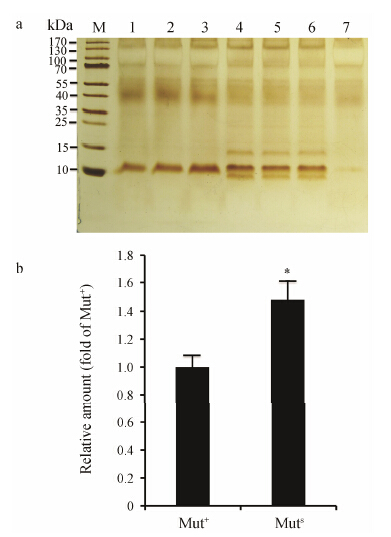
|
Figure 6 Comparison of BmKAngM1 yield in the Mut+ and Mutsrecombinants. 1-3: Muts recombinants; 4-6: Mut+ recombinants;7: Negative control. *P < 0.05 |
毕赤酵母系统已被广泛应用于表达生物活性蛋白,据目前文献报道,用于表达外源蛋白的重组子大部分为Mut+。当以甘油或葡萄糖为碳源时,Mut+和Muts菌株生长速度无显著差别; 当以甲醇为碳源时,Mut+菌株生长速度显著快于Muts菌株[14]。Brierley等[15]通过毕赤酵母表达牛溶菌酶时,Mut+重组子比Muts重组子的表达水平高6.5倍。但也有文献报道,Muts重组子在表达外源蛋白方面比Mut+重组子具有更高的效率。Orman等[16]研究Mut+和Muts重组子表达重组人生长激素时,发现尽管Muts重组子生长速度较Mut+重组子慢,但Muts重组子表达重组人生长激素水平是Mut+重组子的3倍。Cos等[17]通过采用分批补料方式比较了Muts和Mut+重组子表达米根霉
脂肪酶的能力,发现含单拷贝米根霉脂肪酶基因的Muts重组子表达的米根霉脂肪酶比活和单位菌体比产率分别是含单拷贝米根霉脂肪酶基因的Mut+重组子的1.8和2.3倍。Pla等[18]在10 L高密度发酵培养条件下,比较了Mut+和Muts重组子在表达A33scFv抗体水平方面的差异,结果表明,Muts重组子表达A33scFv抗体水平是Muts重组子的2倍。因此,采用毕赤酵母表达系统表达异源蛋白时,要考虑到重组菌株的表型可能影响外源蛋白表达这一重要因素。
本研究将BmK AngM1基因转入毕赤酵母,筛选出表型为甲醇利用缓慢型 (Muts) 和快速型 (Mut+) 重组子。通过实时荧光定量PCR方法,测定了Mut+转化子中BmK AngM1基因拷贝数。在相同培养条件下,比较了含单拷贝BmK AngM1基因的Muts和Mut+重组子表达BmK AngM1的水平,结果表明,Muts重组子的BmK AngM1基因转录水平和蛋白表达水平均高于Mut+重组子。因此,Muts重组子比Mut+重组子更适于表达BmK AngM1。
| [1] | Liu CM, Pei GQ. Analgesic effect of venom of Buthus martensii Karsch [J]. J Shenyang Coll Pharm (沈阳药学院学报), 1989, 6: 176-179. |
| [2] | Tan YH, Guo JS. Research advances in chemical component and analgesic effect of Buthus martensii Karsch [J]. Hunan Guiding J Tradit Chin Med Pharmacol (湖南中医药导报), 2001, 7: 210-212. |
| [3] | Wang C, St Leger RJ. A scorpion neurotoxin increases the potency of a fungal insecticide [J]. Nat Biotechnol, 2007, 25: 1455-1456. |
| [4] | Han S, Yi H, Yin SJ, et al. Structural basis of a potent peptide inhibitor designed for Kv1.3 channel, a therapeutic target of autoimmune disease [J]. J Biol Chem, 2008, 283: 19058-19065. |
| [5] | Hockaday DC, Shen S, Fiveash J, et al. Imaging glioma extent with 131I-TM-601 [J]. J Nucl Med, 2005, 46: 580-586. |
| [6] | Dai C, Ma Y, Zhao Z, et al. Mucroporin, the first cationic host defense peptide from the venom of Lychas mucronatus [J]. Antimicrob Agents Chemother, 2008, 52: 3967-3972. |
| [7] | Ma Y, Zhao R, He Y, et al. Transcriptome analysis of the venom gland of the scorpion Scorpiops jendeki: implication for the evolution of the scorpion venom arsenal [J]. BMC Genomics, 2009, 10: 290. |
| [8] | Cao ZY, Mi ZM, Cheng GF, et al. Purification and characterization of a new peptide with analgesic effect from the scorpion Buthus martensi Karch [J]. J Pept Res, 2004, 64: 33-41. |
| [9] | Li J, Peng YY. Expression of phytase gene in Pichia pastoris Muts and Mut+ recombinants and enzyme properties of phytase [J]. Boiotechnol Bull (生物技术通报), 2006, (03): 58-62. |
| [10] | Cregg JM, Barringer KJ, Hessler AY, et al. Pichia pastoris as a host system for transformations [J]. Mol Cell Biol, 1985, 5: 3376-3385. |
| [11] | Kupcsulik B, Sevella B, Ballagi A, et al. Evaluation of three methanol feed strategies for recombinant Pichia pastoris Muts fermentation [J]. Acta Aliment, 2001, 30: 99-111. |
| [12] | Vellanki RN, Potumarthi R, Mangamoori LN. Constitutive expression and optimization of nutrients for streptokinase production by Pichia pastoris using statistical methods [J]. Appl Biochem Biotechnol, 2009, 158: 25-40. |
| [13] | Shen Q, Wu M, Wang HB, et al. The effect of gene copy number and co-expression of chaperone on production of albumin fusion proteins in Pichia pastoris [J]. Appl Microbial Biotechnol, 2012, 96: 763-772. |
| [14] | Chiruvolu V, Cregg JM, Meagher MM. Recombinant protein production in an alcohol oxidase-defective strain of Pichia pastoris in fedbatch fermentations [J]. Enzyme Microbial Technol, 1997, 21: 277-283. |
| [15] | Brierley RA, Bussineau C, Kosson R, et al. Fermentation development of recombinant Pichia pastoris expressing the heterologous gene: bovine lysozyme [J]. Ann Acad Sci, 1990, 589: 350-362. |
| [16] | Orman MA, Çalık P, Özdamar TH. The influence of carbon sources on recombinant human growth hormone production by Pichia pastoris is dependent on phenotype: a comparison of Muts and Mut+ strains [J]. Biotechnol Appl Biochem, 2009, 52: 245-255. |
| [17] | Cos O, Serrano A, Montesinos JL, et al. Combined effect of the methanol utilization (Mut+) phenotype and gene dosage on recombinant protein production in Pichia pastoris fed-batch cultures [J]. J Biotechnol, 2005, 116: 321-335. |
| [18] | Pla IA, Damasceno LM, Vannelli T, et al. Evaluation of Mut+ and Muts Pichia pastoris phenotypes for high level extracellular scFv expression under feedback control of the methanol concentration [J]. Biotechnol Prog, 2006, 22: 881-888. |
 2015, Vol. 50
2015, Vol. 50


