自胰岛素发现以来,已有许多研究者致力于其口服给药途径的研究,胰岛素口服给药的实现能显著提高糖尿病患者的生活质量[1]。然而,胰岛素属蛋白多肽类药物,易受胃肠道酶、pH值等因素的影响,易于在胃肠道被破坏。同时,由于胰岛素亲水性较强,透过肠道生物膜的能力差[2]。 因此,口服胰岛素的生物利用度很低[3]。目前研究者们主要通过构建给药系统来提高其口服生物利用度。
壳聚糖 (chitosan,CS) 来源于甲壳类动物及昆虫外壳,相对无毒、生物相容好且生物可降解[4]。其所带正电荷能与黏蛋白所带负电荷相互作用,产生黏附性,从而延长药物在胃肠道的滞留时间[5]。同时壳聚糖还能可逆地打开上皮细胞间的紧密连接 (tight junctions,TJs),促进药物的细胞旁路转运[6]。近年来,研究者们通过各种化学修饰改善壳聚糖理化性质及生物学特性,以提高口服蛋白多肽类药物的生物利用度。常用方法主要有季铵化、巯基化、亲水/疏水修饰及配体修饰等。其中,配体修饰策略成为近年来口服蛋白多肽类药物传递系统研究的热点之一。
整合素为细胞膜上的一组跨膜糖蛋白,它是由α、β亚基经非共价键作用构成的异源二聚体[7],可表达于大量细胞表面,如血管内皮细胞、上皮细胞和肌细胞等,且一些细胞表面有多种整合素表达[8]。以αvβ3为代表的许多整合素受体具有一个共同特点: 能与胞外细胞基质蛋白通过精氨酸−甘氨酸−天冬氨酸 (rrginine-glycine-aspartic acid,RGD) 三个氨基酸序列相互识别作用[9],即含有RGD序列的多肽有整合素受体靶向作用。基于RGD的抗肿瘤策略在肿瘤的诊断和治疗领域已有广泛研究,然而,将RGD应用于蛋白多肽类药物口服领域目前鲜有报道。因此,作者设想能否将RGD肽连接于载体材料上,利用其与整合素受体的相互作用,使给药系统具有肠上皮细胞靶向性,以提高蛋白多肽类药物的口服吸收。其中cRGDyk是通过人工合成含RGD序列的环状五肽,有较高的整合素受体亲和力,且不易降解,是用于载体材料靶向性修饰的较优选择[10]。基于以上考虑,采用cRGDyk修饰的三甲基壳聚糖,构建具有整合素受体靶向性的纳米口服递药系统,以提高口服胰岛素的生物利用度。
材料与方法 仪器与试剂核磁共振仪 (UNITY INOVA-400,美国Varian公司); 即用型透析袋 (截留分子量: 8 000~14 000,美国Viskasa公司); 激光粒度分析仪 (Malvern Zetasize NanoZS90,英国Malvern Instrumens公司); 化学发光仪 (Varioskan flash,美国Thermo Scientific公司); 壳聚糖 (脱乙酰化度95%,分子质量400 kDa,上海伯奥生物有限公司); cRGDyk (CM-11-02092,杭州中肽生化有限公司); 胰岛素 (INS,效价: 28.3 U·mg−1,批号: 1306A04,江苏万邦生化医药股份有限公司); L-苯丙氨酸修饰的γ-聚谷氨酸 (γ-PGA-Phe,自制); 三聚磷酸钠 (sodium tripolyphosphate,TPP,武汉市天源兴有限公司); 硫酸镁 (MgSO4·7H2O,天津博迪化工有限公司); 泊洛沙姆 (F68,南京威尔化工有限公司); 异硫氰酸荧光素 (fluorescein isothiocyanate,FITC,美国Sigma公司); BCA (bicinchoninic acid) 蛋白浓度测定试剂盒 (增强型,碧云天生物技术研究所); 氯丙嗪、菲律平、阿米洛利 (美国Sigma-Aldrich公司); 其他试剂均为分析纯。
cRGDyk修饰的三甲基壳聚糖 (N-trimethyl chitosan,TMC) 的合成称取适量TMC、碳二亚胺盐酸盐 [l-ethyl-3-(3-dimethylaminopropyl)-carbodiimide hydrochlide,EDCI]、N-羟基琥珀酰亚胺 (N-hydroxysulfosuccinimide,NHS) 及cRGDyk ,按顺序加入纯水中,避光、室温反应3天。将反应液装入透析袋中,在4 ℃条件下用纯水透析3~4天,最后冷冻干燥得到类白色海绵状固体[11]。采用核磁共振及氨基酸检 测对其进行表征[12]。
荧光标记载胰岛素三甲基壳聚糖纳米粒 (FITC- INS TMC NPs) 及荧光标记载胰岛素靶向三甲基壳聚糖纳米粒 (FITC-INS C-TMC NPs) 的制备及表征以γ-PGA-Phe (65~85 µg·mL−1)、F68 (780~1 095 µg·mL−1)、MgSO4 (309~517 µg·mL−1)、TPP (0~219 µg·mL−1)、FITC-INS (727~770 µg·mL−1) 及TMC (184~191 µg·mL−1) 的用量为考察因素,以纳米粒的粒径、多分散系数 (polydispersity index,PDI)、zeta电位、包封率 (entrapment efficiency,EE %) 和载药量 (drug loading,DL %) 为指标,进行单因素筛选,得到纳米粒较优处方[13]。
纳米粒稳定性考察释放介质: 50、100、150、200、400和600 mmol·L−1 NaCl溶液。取纳米粒混悬液与各释放介质等体积混合,37 ℃、100 r·min−1条件下振摇45 min后,测定各样品溶液的FITC荧光强度和粒径。同时设置FITC-INS溶液作为空白对照组。按照以下公式计算各样品组的相对荧光强度:
| ${\rm{Relative F}}{\rm{.I (\% ) = }}\left( {\frac{{{I_{\rm{c}}}}}{{{I_{\rm{f}}}}}} \right) \times 100{\rm{\% }}$ |
Ic: 待测样品的荧光强度值; If: 游离FITC-INS溶液的荧光强度值。
浓度对细胞摄取影响的考察[14,15]实验前吸弃旧培养基,用磷酸盐缓冲液 (phosphate buffer saline,PBS) 润洗,分别加入100 μL FITC-INS、FITC-INS TMC NPs及FITC-INS C-TMC NPs的PBS混悬液 (FITC-INS质量浓度分别为50、100、150和200 µg·mL−1)。在孵育2 h后,测定FITC-INS荧光强度,同时用BCA试剂盒测定细胞内蛋白含量,利用t检验计算各组数据间显著性差异。
细胞摄取机制的考察[16,17,18]实验前吸弃旧培养基,按照表 1所示加入不同浓度的细胞抑制剂,孵育0.5 h后,吸出样品液,分别加入100 µL FITC-INS、FITC-INS TMC NPs及FITC-INS C-TMC NPs的PBS混悬液 (FITC-INS质量浓度为100 µg·mL−1),继续孵育2 h。其余操作同上。实验结果表示为各实验组药物摄取量占对照组摄取量的百分比,对照组为不加任何抑制剂,其摄取百分比记为100%。测定FITC- INS荧光强度,同时用BCA试剂盒测定细胞内蛋白含量,利用t检验计算各组数据间显著性差异。
|
|
Table 1 Inhibitors used in this study and their functions and concentrations |
实验前吸弃旧培养基,实验组预先加入含2.5 µmol·L−1 cRGDyk的PBS孵育30 min,吸出样品液,分别加入100 µL含2.5 µmol·L−1 cRGDyk的FITC-INS、FITC-INS TMC NPs及FITC-INS C-TMC NPs的PBS混悬液 (FITC- INS质量浓度为100 µg·mL−1),继续孵育2 h。同时设置不含cRGDyk的FITC-INS、FITC-INS TMC NPs及FITC-INS C-TMC NPs为对照组。测定FITC-INS荧光强度,同时用BCA试剂盒测定细胞内蛋白含量,利用t检验计算各组数据间显著性差异。
跨膜转运实验[21]实验前将Transwell®小室A室及B室中的培养基吸出,用预热的PBS润洗。随后将PBS移出,于B室加入PBS 600 µL,于A室加入100 μL FITC-INS、FITC-INS TMC NPs及FITC- INS C-TMC NPs的PBS分散液 (FITC-INS质量浓度为100 µg·mL−1),在37 ℃、95% 湿度、5% CO2条件下孵育。分别在0.5、1、2、3 h时,于B室取出液体200 μL,同时补加等体积PBS。测定各时间点B室药物浓度 (Ctn),计算药物累积透过量 (Q) 及累积渗透百分率 (P%),并利用t检验计算各组数据间显著性差异。
| $Q = 2.5{C_{tn}} + \sum\limits_{i = 1}^{n - 1} {0.1{C_{t(n - 1)}}} $ |
| $P\% = \frac{Q}{D} \times 100\% $ |
1H核磁共振分析图谱 (图 1) 中6.818和7.124处存在苯环的特征峰,cRGDyk多肽分子中具有酪氨 酸,表明cRGDyk已成功连接在TMC上。采用氨基酸分析仪测定TMC-cRGDyk中cRGDyk多肽含量为0.025 mmol·L−1·g−1。本研究采用酰化反应将cRGDyk连接于三甲基壳聚糖上。由于cRGDyk多肽分子中存在羧基,在催化剂作用下可以与TMC结构中的游离氨基发生酰化反应。水溶性EDC·HCl是碳二亚胺系列中活性较高的脱水剂,可在水中进行反应,具有效率高、易于操作等特点,且文献[22]报道,EDC·HCl在N-羟基琥珀酰亚胺 (NHS) 作用下,可大大提高缩合效率,有利于反应的进行。因而合成产物TMC-cRGDyk时,同时使用了EDC·HCl和NHS。由于cRGDyk分子中还存在氨基、酚羟基等亲核性基团,在催化剂作用下极有可能发生分子内或分子间的酰化反应,因此本研究采用TMC过量的方法增加TMC与cRGDyk多肽的结合率。

|
Figure 1 1H NMR spectrum of TMC-cRGDyk. TMC: Trimethyl chitosan |
经单因素筛选,当FITC-INS、MgSO4、γ-PGA- Phe、TPP、F68和TMC/C-TMC的质量浓度分别为187.5、412.5、75、218.75、937.5和750 µg·mL−1时,FITC-INS TMC NPs及FITC-INS C-TMC NPs具有较优的粒径、多分散系数、电位、包封率及载药量。按照该处方制备FITC-INS TMC NPs及FITC-INS C-TMC NPs,各项理化性质均为最优,具体性质见表 2。
|
|
Table 2 Characteristics of N-trimethyl chitosan nanoparticles (FITC-INS TMC NPs) and cRGDyk modified N-trimethyl chitosannanoparticles (FITC-INS C-TMC NPs) prepared by the optimized formation (n = 3,x± s). PDI: Polydispersity index; EE: Entrapment efficiency; DL: Drug loading |
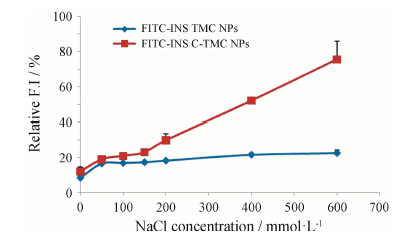
人体肠道内的消化液和黏液中含有各种盐,使其具有一定的离子强度。研究报道,人体胃液中的消化液离子强度为0.1~0.165 mmol·L−1,肠道内的胰酶消化液离子强度为0.119~0.190 mmol·L−1 [23]。因此,考察纳米粒在不同离子强度环境下纳米粒的稳定性尤为重要。
由图 2,3,4可知,在生理环境的NaCl浓度 (150 mmol·L−1) 及低于生理环境的NaCl浓度条件下,FITC-INS TMC NPs及FITC-INS C-TMC NPs荧光强度、粒径和粒子数变化较小,说明两种纳米粒在生理环境的离子强度中稳定性较好; 当NaCl浓度超过200 mmol·L−1后FITC-INS C-TMC NPs明显解体,而FITC-INS TMC NPs所受影响较小,仍相对稳定。
|
Figure 2 NaCl concentration-induced fluorescent intensity of FITC-INS TMC NPs and FITC-INS C-TMC NPs (n = 3,x± s) |

|
Figure 3 NaCl concentration-induced size of FITC-INS TMC NPs and FITC-INS C-TMC NPs (n = 3,x± s) |

|
Figure 4 NaCl concentration-induced count rate of FITC-INS TMC NPs and FITC-INS C-TMC NPs (n = 3,x± s) |
由图 5可知,FITC-INS、FITC-INS TMC NPs及FITC-INS C-TMC NPs的摄取呈浓度依赖性; 计算摄取效率可知,当质量浓度为100 µg·mL−1时两种纳米粒均具有最高细胞摄取效率。因此,选择后续考察给药浓度为100 µg·mL−1。当药物质量浓度大于100 µg·mL−1后,摄取效率降低可能是由于纳米粒主要通过主动转运,而单位时间内纳米粒转运量受能量及载体数量限制,因此纳米粒的摄取效率与浓度不呈线性关系。

|
Figure 5 Cellular uptake of FITC-INS in Caco-2 cells at 3 h from FITC-INS,FITC-INS TMC NPs and FITC-INS C-TMC NPs at different concentrations for 3 h (n = 3,x± s). $P < 0.05,$$P < 0.001 vs FITC-INS; **P < 0.001 vs FITC-INS; ^P < 0.05,^^P < 0.001 vs FITC-INS TMC NPs |
两种纳米粒均能显著提高药物在Caco-2细胞模型的摄取 (P < 0.001)。在FITC-INS质量浓度为100 µg·mL−1时,FITC-INS C-TMC NPs的摄取量是FITC- INS TMC NPs的1.98倍。经配体修饰的纳米粒能提高药物在Caco-2细胞模型的摄取。
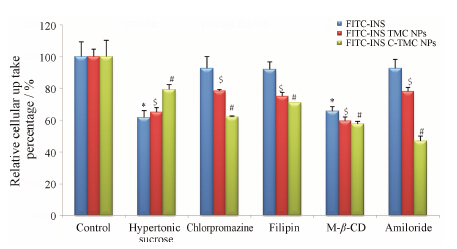
5 细胞摄取机制的研究胞外物质通过质膜的变性运动由胞外转运至胞内的过程称为内吞作用。根据转运机制,分为吞噬 作用、大胞饮作用、网格蛋白介导的内吞 (clathrin- mediated endocytosis,CME)、小窝蛋白介导的内吞 (caveolin-mediated endocytosis,CvME) 及不依赖动力蛋白的内吞等。本研究利用化学抑制剂在Caco-2细胞模型对FITC-INS、FITC-INS TMC NPs及FITC- INS C-TMC NPs摄取机制进行考察,结果见图 6。
|
Figure 6 Relative cellular uptake of FITC-INS at different conditions in the Caco-2 cells. n = 3,x± s. P < 0.05 vs FITC- INS; $P < 0.05 vs FITC-INS TMC NPs; #P < 0.05 vs FITC-INS C-TMC NPs |
大胞饮是一种非选择性内吞途径,常伴有肌动蛋白运动形成的膜凸起,但该凸起膜不含特殊蛋白,故大胞饮形成的囊泡无特殊的蛋白包被结构。阿米洛 利能选择性阻断Na+/H+ 离子交换通道导致细胞质酸化来抑制大胞饮,研究发现其能显著抑制FITC-INS TMC NPs (22%) 及FITC-INS C-TMC NPs (53%) 的内吞,说明两种纳米粒的入胞均涉及此内吞途径。
小窝蛋白是小窝主要组成蛋白,可参与物质的内吞。小窝蛋白介导内吞作用是一类胆固醇、肌动蛋白依赖和受体介导过程。菲律平可通过结合细胞膜 胆固醇来阻断小窝蛋白介导内吞,该抑制剂能显著抑制FITC-INS TMC NPs (25%) 及FITC-INS C-TMC NPs (29%) 的内吞。β-环糊精能非选择性的快速将胆固醇耗竭,从而抑制小窝蛋白介导内吞。该抑制剂能显著抑制FITC-INS (65%)、FITC-INS TMC NPs (41%) 及FITC-INS C-TMC NPs (43%) 的内吞。上述结果说明,两种纳米粒的细胞摄取途径均有小窝蛋白介导内吞。而cRGDyk修饰后对纳米粒经小窝蛋白介导的内吞亚途径改变不大。
网格蛋白介导内吞作用需要动力蛋白的参与,其是受体介导内吞的主要方式之一。氯丙嗪可通过将网格蛋白及其调控蛋白从细胞内囊泡反转运到细胞膜以抑制网格蛋白囊泡的形成,从而抑制网格蛋白介导内吞。该抑制剂能显著抑制FITC-INS TMC NPs (22%) 及FITC-INS C-TMC NPs (39%) 的内吞。高渗糖也能抑制网格蛋白介导内吞作用,该抑制剂能显著抑制FITC-INS (38%)、FITC-INS TMC NPs (35%) 及FITC-INS C-TMC NPs (21%) 的内吞。上述结果说明,两种纳米粒的细胞摄取途径均有网格蛋白介导内吞。而cRGDyk修饰后纳米粒经网格蛋白介导的内吞途径有较大改变,如氯丙嗪介导的内吞通路被上调,而高渗糖介导的内吞通路被下调。
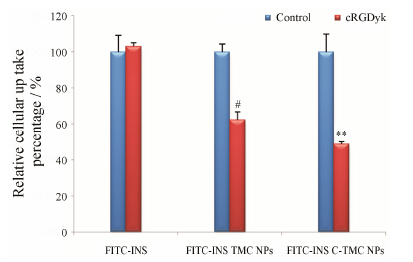
6 游离配体对细胞摄取影响的考察FITC-INS C-TMC NPs在Caco-2细胞模型的摄取能被cRGDyk游离肽抑制 (52%,P < 0.001,图 7)。说明CSK靶向修饰纳米粒的摄取由cRGDyk配体与Caco-2细胞相互作用介导。
|
Figure 7 Relative cellular uptake of FITC-INS after incubation with cRGDyk peptide. n = 3,x± s. #P < 0.05 vs FITC-INS TMC NPs; **P < 0.001 vs FITC-INS C-TMC NPs |
FITC-INS、FITC-INS TMC NPs及FITC-INS C-TMC NPs介导的药物跨膜转运呈时间依赖性 (图 8)。在各个时间点,FITC-INS C-TMC NPs介导的药 物跨膜转运量都显著高于FITC-INS及FITC-INS TMC NPs (P < 0.05)。在1 800、3 600、5 400和7 200 s时,FITC-INS C-TMC NPs的药物累积透过量分别是FITC-INS TMC NPs的1.79倍、2.18倍、2.65倍和2.84倍(P < 0.05)。上述结果说明,两种纳米粒均能显著提高药物在Caco-2细胞模型的跨膜转运,且配体修饰纳米粒能经受体配体介导作用进一步提高药物在Caco-2细胞模型的跨膜转运。

|
Figure 8 The percentage of cumulative permeation amount (P%) of FITC-INS after administration with FITC-INS,FITC-INS TMC NPs and FITC-INS C-TMC NPs on Caco-2 cells. n = 3,x± s. ^P < 0.05,^^P < 0.001 vs FITC-INS; #P < 0.05 vs FITC-INS; P < 0.05 vs FITC-INS TMC NPs |
本文构建了一种整合素受体靶向三甲基壳聚糖纳米给药系统。采用单因素筛选,以纳米粒的粒径、电位、包封率、载药量及体外释药行为作为考察因素,筛选出最优处方。以Caco-2细胞为模型考察了TMC NPs和C-TMC NPs的细胞摄取、跨膜及相关转运机制。结果显示,靶肽cRGDyk可通过受体配体间相互作用显著提高纳米粒细胞摄取及跨膜转运。在此基础上,将进行体内药动学研究,考察其提高药物口服生物利用度的性质。
| [1] | Pillai O, Panchagnula R. Insulin therapies — past, present and future [J]. Drug Discov Today, 2001, 6: 1056-1061. |
| [2] | Antosova Z, Mackova M, Kral V, et al. Therapeutic application of peptides and proteins: parenteral forever ? [J]. Trends Biotechnol, 2009, 27: 628-635. |
| [3] | Rieux A, Fievez V, Gariont M, et al. Nanoparticles as potential oral delivery systems of proteins and vaccines: a mechanistic approach [J]. J Control Release, 2006, 116: 1-27. |
| [4] | Kean T, Thanou M. Biodegradation, biodistribution and toxicity of chitosan [J]. Adv Drug Deliv Rev, 2010, 62: 3-11. |
| [5] | Lehr CM, Bouwstra JA, Schacht EH. In vitro evaluation of mucoadhesive properties of chitosan and some other natural polymers [J]. Int J Pharm, 1992, 78: 43-48. |
| [6] | Hsu LW, Lee PL, Chen CT, et al. Elucidating the signaling mechanism of an epithelial tight-junction opening induced by chitosan [J]. Biomaterials, 2012, 33: 6254-6263. |
| [7] | Alghisi GC, Ponsonnet L, Rüegg C, et al. The integrin antagonist cilengitide activates αvβ3, disrupts VE-cadherin localization at cell junctions and enhances permeability in endothelial cells [J]. PLoS One, 2009, 4: e4449. |
| [8] | Hynes RO. Integrins: versatility, modulation, and signaling in cell adhesion [J]. Cell, 1992, 69: 11-25. |
| [9] | Ruoslahti E. RGD and other recognition sequences for integrins [J]. Annu Rev Cell Devel Biol, 1996, 12: 697-715. |
| [10] | Dunehoo AL, Anderson M, Majumdar S, et al. Cell adhesion molecules for targeted drug delivery [J]. J Pharm Sci, 2006, 95: 1856-1872. |
| [11] | Yun J, Song YP, Zhu X, et al. Goblet cell-targeting nanoparticles for oral insulin delivery and the influence of mucus on insulin transport [J]. Biomaterials, 2012, 33: 1573-1582. |
| [12] | Sieval AB, Thanou M, Kotze AF, et al. Preparation and NMR characterization of highly substituted N-trimethyl chitosan chloride [J]. Carbohydr Polym, 1998, 36: 157-165. |
| [13] | Sadeghi AMM, Dorkoosh FA, Avadi MR, et al. Preparation, characterization and antibacterial activities of chitosan, N-trimethyl chitosan (TMC) and N-diethylmethyl chitosan (DEMC) nanoparticles loaded with insulin using both the ionotropic gelation and polyelectrolyte complexation methods [J]. Int J Pharm, 2008, 355: 299-306. |
| [14] | Hilgendorf C, Spahn-Langguth H, Regårdh CG, et al. Caco-2 versus Caco-2/HT29-MTX co-cultured cell lines: permeabilities via diffusion, inside-and outside-directed carrier-mediated transport [J]. J Pharm Sci, 2000, 89: 63-75. |
| [15] | Li XH, Chang MM, Wang Q, et al. Influence of cationic cyclopeptide on microstructure and permeability of Caco-2 cell membrane [J]. Acta Pharm Sin (药学学报), 2014, 49: 1062-1068. |
| [16] | Rejman J, Bragonzi A, Conese M, et al. Role of clathrin-and caveolae-mediated endocytosis in gene transfer mediated by lipo-and polyplexes[J]. Mol Ther, 2005, 12: 468-474. |
| [17] | Li CC, Zhang ZH, Zhang YL, et al. In situ rat intestine absorption of paclitaxel-loaded solid lipid nanoparticles modified with cell-penetrating peptides [J]. Acta Pharm Sin (药学学报), 2013, 48: 131-137. |
| [18] | Liu XL, Zhang WJ, Wei G, et al. Poly(arginine) 8 enhanced intestinal absorption of insulin-loaded nanoparticles [J]. Acta Pharm Sin (药学学报), 2012, 47: 512-516. |
| [19] | Huang X, Wang JY, Li F, et al. Biochemical characterization of the binding of cyclic RGDyk to hepatic stellate cells [J]. Biochem Pharmacol, 2010, 80: 136-143. |
| [20] | Kim EM, Jeong MH, Kim DW, et al. Iodine 125-labeled mesenchymal-epithelial transition factor binding peptide-click-cRGDyk heterodimer for glioma imaging [J]. Cancer Sci, 2011, 102: 1516-1521. |
| [21] | Walter E, Janich S, Roessler BJ, et al. HT29-MTX/Caco-2 cocultures as an in vitro model for the intestinal epithelium: in vitro-in vivo correlation with permeability data from rats and humans [J]. J Pharm Sci, 1996, 85: 1070-1076 |
| [22] | Damink LHHO, Dijkstra PJ, Van Luyn MJA, et al. In vitro degradation of dermal sheep collagen cross-linked using a water-soluble carbodiimide [J]. Biomaterials, 1996, 17: 679-684. |
| [23] | Lee Y, Ishii T, Cabral H, et al. Charge-conversional polyionic complex micelles-efficient nanocarriers for protein delivery into cytoplasm [J]. Angew Chem Int Ed, 2009, 48: 5309-5312. |
 2015, Vol. 50
2015, Vol. 50


