2. 中国中医科学院 医学实验中心, 北京 100700;
3. 广安门医院, 北京 100053
2. The Experimental Research Center, Beijing 100700, China;
3. Guang'anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053, China
小承气汤 (XCQT) 首载于《伤寒论》,厚朴三物汤 (HPSWT) 与厚朴大黄汤 (HPDHT) 载自《金匮要略》,三方均由大黄、枳实、厚朴组成,且都是张仲景所创经典方剂。但由于三方配伍及煎煮方法不同,三方在中医临床应用中也各有侧重。小承气汤主治阳明腑实证,厚朴大黄汤作用相似,适用于痰气结实,厚朴三物汤则重在行气除满[1,2]。临床上小承气汤类方可治疗肠梗阻、术后胃肠道紊乱、慢性肺源性心脏病等疾病[3,4]。已有研究表明,小承气汤的有效物质主要集中为大黄中的蒽醌类成分,厚朴中的厚朴酚、和厚朴酚,以及枳实中的黄酮类成分[5,6,7]。而近年来关于该三方的物质基础的研究仅停留在多成分定性分析[8]以及单个或单类成分的含量测定[9,10]的水平 上,较为系统的质量控制方法还尚未建立。本研究建立了HPLC同时测定小承气汤类方中18个成分含量的方法,比较分析了复方不同配伍及不同煎煮方法对这些成分含量的影响,旨在为控制小承气汤类方质量,保证其疗效的物质基础提供支持。
材料与方法 仪器岛津(SHIMADZU) LC-20A液相色谱仪,配有LC-20AT泵、SIL-20A样品室、CTO-20A柱温箱、SPD-M20A检测器; BS-210S电子天平、BP-211D电子分析天平 (STATORIUS,北京)。
药品与试剂没食子酸 (ZL20140322)、肉桂酸 (ZL20140329)、番泻苷A (ZL20140420)、番泻苷B (ZL20140425)、大黄酸 (ZL20140511)、大黄素 (ZL20140414)、芦荟大黄素 (ZL20140418)、大黄酚 (ZL20140418)、大黄素甲醚 (ZL20140414)、厚朴酚 (ZL20140515)、和厚朴酚 (ZL20140520)、芸香柚皮苷 (ZL20140519)、柚皮苷 (ZL20140525)、橙皮苷 (ZL20140422)、新陈皮苷 (ZL20140522)、橙皮素 (ZL20140912)、柚皮素 (ZL20140822) 和川陈皮素 (ZL20140430) 等对照品购自南京泽朗医药有限公 司,纯度均大于98%。
本方中使用大黄 (Rheum officinale) 为酒大黄、厚朴 (Mangnolia officinalis)为姜厚朴、枳实 (Citrus aurantium) 为麸炒枳实,购自北京仟草药材公司,产地分别为青海、四川、江西,经中国中医科学院周钟鸣研究员鉴定。甲醇 (Amethyst Chemicals,色谱纯)、乙腈 (Fisher Scitific,色谱纯)、甲醇 (北京化工厂,分析纯)、乙酸 (北京化工厂,分析纯),水为娃哈哈纯净水。
小承气汤类方水煎液的制备根据经方原始记载,小承气汤和厚朴大黄汤中大黄、厚朴、枳实分别加入10倍水浸泡30 min,按比例水煎煮1 h; 厚朴三物汤中先合并浸泡30 min的厚朴与枳实,合煎45 min,过滤弃药渣,再加入浸泡后的大黄,煎煮15 min。水煎液冷却,滤过,经水浴挥去水分,浓缩至相当于生药量1 g·mL−1的药液,−20 ℃冷藏备用。关于小承气汤、厚朴三物汤、厚朴大黄汤的煎煮药量、方法及主治证候,见表 1。
|
|
Table 1 Dosage,decocting method and indications of analogous formulas about Xiao-Cheng-Qi Tang. XCQT: Xiao-Cheng-Qi Tang; HPSWT: Hou-Po-San-Wu Tang; HPDHT: Hou-Po-Da-Huang Tang |
室温融化水煎液,涡旋2 min混匀,精密吸取1 mL,加入75% 甲醇溶液49 mL中,称重。80 ℃水浴热浸30 min,每隔15 min摇匀一次,冷却至室温后用纯甲醇补足所失重量。所得供试品溶液经0.22 μm滤膜过滤备用。
混合对照品溶液的制备分别精密称取没食子酸、肉桂酸、番泻苷A、番泻苷B、大黄酸、大黄素、芦荟大黄素、大黄酚、大黄素甲醚、厚朴酚、和厚朴酚、芸香柚皮苷、柚皮苷、橙皮苷、新陈皮苷、橙皮素、柚皮素与川陈皮素对照品适量,置于10 mL量瓶中,加甲醇溶解并稀释到刻度,摇匀,即得 (4 ℃冷藏备用)。
色谱条件色谱柱为Agilent Zorbax SB-C18 (4.6 mm × 250 mm,5 μm); 0.5% 乙酸 (A)−乙腈 (B) 梯度洗脱: 0~2 min,5% B; 2~7 min,5%~10% B; 7~23 min,10%~17% B; 23~33 min,17% B; 33~45 min,17%~22% B; 45~70 min,22%~50% B; 70~75 min,50%~55% B; 75~80 min,55% B; 80~90 min,55%~90% B; 90~95 min,90% B。流速为1.0 mL·min−1; 柱温为30 ℃; 进样量为10 μL; 紫外检测波长为254和294 nm。
方法学考察精密度 取同一混合对照品溶液,按上述色谱条件,当天连续进样5次和连续5天进样,记录各成分保留时间和峰面积,分别计算RSD值,即日内精密度和日间精密度。
重复性 取同一批小承气汤水煎液样品,按供试品溶液制备方法,平行制备5份供试品后进样,测定各成分峰面积。
稳定性 分别取小承气汤、厚朴三物汤、厚朴大黄汤的同一供试品溶液,于0、4、8、12和16 h共5个时间点取样,测定各成分峰面积。
回收率 取同一供试品溶液 (小承气汤水煎液) 分别加入适量的高、中、低浓度混合标准品溶液,按供试品溶液项制备方法处理,分别测定加样前后18个成分的含量,计算回收率。
结果 1 方法学考察 1.1 HPLC色谱图本实验选择254 nm和294 nm两个波长对18个成分进行定量,其中没食子酸、番泻苷A、番泻苷B、芦荟大黄素、大黄酸、川陈皮素、大黄素、和厚朴酚、大黄酚等9个成分选择254 nm定量,芸香柚皮苷、柚皮苷、橙皮苷、新陈皮苷、肉桂酸、橙皮素、柚皮素、厚朴酚、大黄素甲醚等9个成分选择294 nm定量。294 nm下混合对照品与各样品色谱图见图 1。结果表明,供试品溶液中18个 成分峰的分离度均大于1.772,理论塔板数大于7 722。所测各成分经紫外全波长扫描检测,峰纯度均大于98%,表明本方法对测定该18个成分特异性良好。
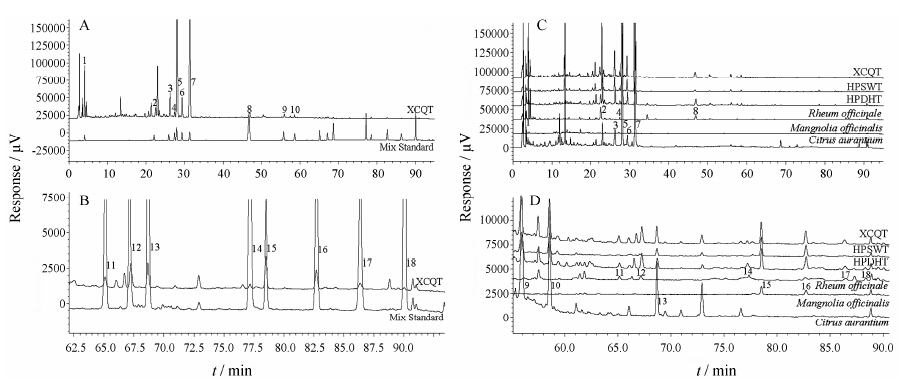
|
Figure 1 HPLC chromatograms (A) and partial enlarged chromatograms (B) of Xiao-Cheng-Qi Tang and mix standard,HPLC chromatograms (C) and partial enlarged chromatograms (D) of XCQT,HPSWT,HPDHT and each single herb at 294 nm. 1: Gallic acid; 2: Sennoside B; 3: Narirutin; 4: Sennoside A; 5: Naringin; 6: Hesperidin; 7: Neohesperidin; 8: Cinnamic acid; 9: Hesperetin; 10: Naringenin; 11: Aloe-emodin; 12: Rhein; 13: Nobiletin; 14: Emodin; 15: Honokiol; 16: Magnolol; 17: Chrysophanol; 18: Physcion |
分别以18个对照品浓度 (X,μg·mL−1) 与对应波长下的色谱峰面积 (Y) 做线性回归方程,结果见表 2。
|
|
Table 2 Regression equations and linear ranges of the eighteen compounds in analogous formulas about XCQT. LLOD: Lower limit of determination; LLOQ: Lower limit of quantification |
结果显示,18个成分日内精密度和日间精密度的RSD值为3.74%~4.19%,各成分重复性的RSD值均小于5.73%,表明检测方法准确可靠,重复可行。在16 h内,小承气汤、厚朴三物汤、厚朴大黄汤中18个成分的RSD值分别小于3.28%、4.35%、4.38%,表明样品在16 h内稳定性好。
1.4 回收率结果显示18个成分回收率为94.28%~99.89%,RSD值均小于5%。
2 样品含量测定分别精密吸取1 mL小承气汤、厚朴三物汤、厚朴大黄汤的水提物,平行5份进样分析,各成分按表 2中标准曲线计算含量,并最终折算成每克复方含量,类方中各成分含量见表 3。可见,同一成分在不同类方之间的含量有所不同,但基本在一个数量级上。不同成分在类方之间的含量差异较大,其中复方所含黄酮类成分较高,蒽醌类和木脂素类成分含量相对较低,且与黄酮不在同一个数量级上,例如小承气汤中含量最高的新陈皮苷 (11.35‰) 和最低的大黄素甲醚 (0.002 1‰) 之间相差了4个数量级之多。蒽醌类成分和黄酮类成分均属小承气汤含量最高,厚朴三物汤中厚朴酚与和厚朴酚含量最高。此外,厚朴三物汤中大黄素和大黄素甲醚低于检测限。
|
|
Table 3 Total content and actual extract content of eighteen constituents in analogous formulas about XCQT (n = 5). “−”: Undetected |
根据图 1中18个成分的单味药归属结果,按3方中各成分总含量 (total content,mg·g−1),即表 3中所算得的每克复方中的含量,除以各成分归属单味药所占复方药量 (g·g−1),即得3组类方中每克单味药的提取含量 (extract content,mg·g−1),结果见表 3。结果显示,复方中单味药用量的不同仍是大多成分含量差异的关键因素,但3方配伍对18个成分含量也均有不同程度的影响。厚朴三物汤中虽然厚朴比例最大,但厚朴酚、和厚朴酚的溶出率却明显低于小承气汤,经观察发现小承气汤与厚朴大黄汤中大黄用量基本相仿,而小承气汤枳实用量是厚朴大黄汤的1.5倍之多,而厚朴中木脂素类成分的提取率也基本和枳实用量成正相关,提示厚朴与枳实的配伍可能达到增溶木脂素的作用。 此外,“大黄后下”的煎煮方法大大降低了厚朴三物汤中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的提取效率。
讨论复方是中医用药的主要形式,研究类方配伍对物质基础乃至其适应证候的影响十分必要,现已有相关报道[11, 12]。本文遵循小承气汤类方原始记载的传统的制备方法,采用水煎煮的汤剂作为后期研究的供试品溶液。其中小承气汤和厚朴大黄汤将三味药浸泡合煎,厚朴三物汤参照《金匮要略》中“大黄后下”的原则进行煎煮。该提取方法更加符合现实中医临床指导患者用药的真实情况,对发现不同配伍及煎煮方法对起效物质的影响以及进一步实现药效的差异,有一定的指导意义。
本研究比较了有机相甲醇和乙腈分别加入0.1%、0.5%、1.0% 乙酸的分离效果,发现乙腈−0.5% 乙酸在保持基线基本平稳的情况下依然可以达到良好的分离效果; 对供试品溶液制备方法的选择也比较了50%、75%、100% 的甲醇和乙醇分别采用室温冷浸法、80 ℃热浸法、超声法提取15和30 min的制备效果,75% 甲醇热浸30 min明显对待测成分的提取效果最佳。在检测波长选择方面,本研究综合考虑所测成分实际含量、分离效果及杂峰干扰等因素,最终选择254 nm和294 nm作为检测波长。
经研究发现,水煎煮的提取方法明显有助于复方中黄酮类成分的提取,而对于极性相对较小的蒽醌类和木脂素类成分的提取效果相对较差。从提取率的角度来看,厚朴与枳实的配伍合煎可以使两味药中主要成分相互增溶,这与文献[5]报道的研究结果相符。此外,虽有文献[10]报道“大黄后下”的煎煮方法可能使蒽醌类成分更易溶出,但本研究发现提取时间的显著减少仍然是大黄中蒽醌提取率不高的首要因素,结果也是厚朴三物汤中的蒽醌类物质提取率也明显低于其他两方。从各类方间所含成分总量来看,小承气汤和厚朴大黄汤作用相似,主要取大黄中蒽醌和枳实中黄酮的泻热通便作用。厚朴三物汤则以厚朴为君,侧重于厚朴的行气除满作用。其中厚朴酚与和厚朴酚是厚朴中最主要的两个活性成分,有研究显示厚朴酚、和厚朴酚能通过清除自由基和抑制NF-κB等通路发挥抗炎和抗氧化的作用[13,14],在一定程度上恰好契合了厚朴三物汤调节内热之效。
本文建立了同时测定小承气汤类方中18个成分含量的方法,基本涵盖了有文献报道过的有效成分,方法简单、经济、可靠,可考虑作为小承气汤类方质量控制的分析方法。中药复方成分复杂,关于支撑其药效的物质基础研究是一个长期过程,需要经过类药成分筛选、不同病证下起效关键成分的鉴别以及相关成分体内药动学研究等过程[15,16]。本实验选择该18个已知确切疗效的成分进行定量,为小承气汤类方后期药代动力学研究和方剂配伍研究提供依据,同时为小承气汤类方质控以及体内代谢指标成分的发现奠定了基础。
| [1] | Deng ZJ. Formulas of Chinese Medicine (方剂学) [M]. Beijing: Chinese Medicine Press, 2007: 61. |
| [2] | Li J, Hu XY, Yun F. Inquiry of Xiaochengqi decoction and Houpodahuang decotion [J]. Liaoning J Tradit Chin Med (辽宁中医药杂志), 2005, 32: 999-1000. |
| [3] | Shen YH, Tong SH. Pharmacological activity analysis and clinical application comparison of Xiao-Cheng-Qi Tang and Hou-Po-San-Wu Tang [J]. China Pharm (中国药业), 2013, 22: 122-123. |
| [4] | Li GB. Modern pharmacology and clinical application of Xiao-Cheng-Qi Decoction [J]. Guide China Med (中国医药指南), 2008, 6: 136-137. |
| [5] | Kou JP, Liu Y, Zhu D, et al. Preliminary study on material basis of different laxative potency of Xiao Chengqi-Tang and other two prescriptions [J]. LiShiZhen Med Mater Med Res (时珍国医国药), 1999, 10: 401-403. |
| [6] | Kou JP, Xuan YY, Yan YQ. Preliminary studies on factors affecting content of magnolol in Magnolia bark three agents decoction [J]. Chin Tradit Pat Med (中成药), 2001, 23: 401-403. |
| [7] | Hu XJ. Studies on the Compatibility Mechanism, Therapeutic Basis, and Quality Control Methods of Xiao-Cheng-Qi decoction (小承气汤配伍机制、药效物质基础及质量控制研究) [D]. Shenyang: Shenyang Pharmaceutical University, 2006. |
| [8] | Fan MX, Wang HJ, Li XM. Studies on chemical constituents and volatile oil of Xiaochengqi decoction [J]. China J Chin Mater Med (中国中药杂志), 2008, 33: 1027-1031. |
| [9] | Li K, Zhou HT, Wang YY. Quality control of Xiaochengqi decoction [J]. Chin Tradit Herb Drugs (中草药), 2011, 42: 905-908. |
| [10] | Wang YS, Deng JH, Wei HZ. Study on determination of anthraquinones in Dachengqi Tang residues of Magnolia officinalis and Citrus aurantium removed in decoction process [J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 694-697. |
| [11] | Xie Z, Wang SL, Gao F, et al. Correlation of chemical compounds with pharmacological activities of Da Chengqi decoction with different ingredient combinations [J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2011, 22: 57-60. |
| [12] | Chen YR, Ma YM, Zhang N. Content change in categorized formulas about Guizhi decoction [J]. Chin Tradit Pat Med (中成药), 2010, 32: 996-1000. |
| [13] | Zhao C, Liu ZQ. Comparison of antioxidant abilities of magnolol and honokiol to scavenge radicals and to protect DNA [J]. Biochimie, 2011, 93: 1755-1760. |
| [14] | Murakami Y, Kawata A, Seki Y, et al. Comparative inhibitory effects of magnolol, honokiol, eugenol and bis-eugenol on cyclooxygenase-2 expression and nuclear factor-κB activation in RAW264.7 macrophage-like cells stimulated with fimbriae of Porphyromonas gingivalis [J]. In vivo (Athens, Greece), 2012, 26: 941-950. |
| [15] | Li T, Wang YW, Wang YL. Pharmacokinetics and pharmacodynamics of Huangqin Tang in febrile rats [J]. Acta Pharm Sin (药学学报), 2014, 49:1418-1425. |
| [16] | Li T, Wang YW, Wang YL. LC-MS quantification and pharmacokinetics of the multi-constituents of Huangqin Tang in rat plasma after different single oral doses [J]. Acta Pharm Sin (药学学报), 2013, 48: 917-924. |
 2015, Vol. 50
2015, Vol. 50


