糖尿病 (diabetes mellitus, DM) 是一种以持续高血糖为特征的慢性全身性代谢性疾病, 其危害主要是长期血糖过高导致的各种并发证[1]。DM患者90% 以上为2型糖尿病 (type 2 diabetes mellitus, T2DM)[2]。对2型糖尿病可用化学药物促使β细胞分泌更多胰岛素, 或改善靶组织对胰岛素的敏感性进行治疗[1]。但从血浆磷脂方面探讨2型糖尿病的发生、发展以及治疗的研究并不多见。
生物膜的许多特性如作为膜内外物质的通透性屏障、膜内外物质的交换、信息传递、神经脉冲的传导等均与磷脂有关[3,4,5,6]。2型糖尿病与脂质代谢的关系十分密切[7,8,9,10,11,12]。血浆磷脂是血浆的主要成分, 其分布与变化可以实时反映机体的整体状态。研究表明 血浆中磷脂结构和含量的变化与T2DM致病因素密切相关[13,14]。因此, 筛选病理血浆磷脂成分标志物对T2DM进行辅助治疗有积极意义。
为阐明血浆磷脂与2型糖尿病的关系, 本课题组在前期的研究[15]中已经建立了相关的血浆磷脂快速分析及鉴定方法, 并初步阐述了2型糖尿病大鼠血浆磷脂的代谢轮廓。本文运用UPLC-Q-TOF/MS分析方法, 分别对2型糖尿病模型 (MC) 组和正常对照 (NC) 组大鼠的血浆磷脂成分进行快速鉴定, 利用化学计量学方法以及R软件等对产生的大量数据信息进行分析, 筛选出与疾病相关的磷脂病理标记物, 并结合各类代谢数据库以及查阅文献, 阐明T2DM与血浆磷脂代谢之间的关系。
材料与方法 实验动物雄性SD大鼠, 7周龄, 180~200 g, 购于广州中医药大学实验动物中心和广东省医学实验动物中心, 合格证号: 0070435, SYXK (粤) 2008- 0002。大鼠饲养于SPF级动物室, 喂饲全价颗粒饲料。饲养条件: 12 h/12 h明暗循环, 温度21~23 ℃, 湿度50%~80%。本实验参照《广州中医药大学实验动物管理条例》, 得到广州中医药大学动物实验伦理委员会批准。
高脂饲料参照Research Diet公司D1249 (60% 高脂) 饲料配方作出适当调整, 委托广东省医学实验动物中心加工, 实际脂肪含量为53.5%。
主要仪器及试剂AQUITY UPLC/Q-TOF micro 液质联用仪和UPLC BEH-C18柱 (2.1 mm × 50 mm, 1.7 μm) 均为美国Waters产品; −86 ℃超低温冰箱 (中科美菱公司);KDC-220HR高速冷冻离心机 (科大创新股份有限公司中佳分公司); 2, 6-二叔丁基-4-甲基苯酚 (Dikma, 美国); 亮氨酸脑啡肽 (Sigma, 美国); PC (16∶0/18∶1)、PC (18∶0/18∶2)、PC (16∶0/ 0∶0)、PC (18∶1/0∶0)、PE (18∶0/0∶0) (Avanti polar lipids, 美国)。
分组、建模及给药SD大鼠适应环境1周后, 随机分为2组: 正常对照组 (NC) 和2型糖尿病模型组 (MC)。每组8~12只, NC组喂饲全价颗粒饲料, MC组喂饲53.5% 高脂饲料, 每周测体重及进食量各2次。灌胃给药, 每日1次, 高脂饮食实验连续给药13周。其中正常对照组与模型组灌服0.5% CMC-Na溶液。
生化指标模型组大鼠肝质量、体质量、附睾周围脂肪质量、不禁食血糖均相比正常对照组有显著升高 (P<0.05~0.01), 提示造模成功[16]。
溶液的配制0.04% BHT甲醇溶液: 取2, 6-二叔丁基-4-甲基苯酚 (BHT) 4 mg溶于100 mL甲醇溶液中, 放置在具塞棕色瓶中, 于4 ℃冰箱保存。色谱有机相配制: 乙腈和异丙醇以1∶1混合加入0.25% 超纯水。加入甲酸铵使浓度为10 mmol·L−1, 超声混匀。色谱水相配制: 超纯水中加入甲酸铵使浓度达到10 mmol·L−1, 超声混匀。磷脂对照品配制: 取磷脂对照品, 按照比例混合配制成10 μg·mL−1左右的溶液, 转移至微量进样瓶中, 备用。
样品采集于第12周禁食不禁水18 h后, 眼底静脉丛取血, 肝素抗凝离心取上清液得血浆样品。样品于 −80 ℃保存, 临用前室温放置使溶化, 取样后迅速放回。其中, 正常组得到8个血浆样品, 模型组得到12个血浆样品。
血浆磷脂的提取取血浆15 μL, 加氯仿−甲醇 (2∶1) 混合溶液600 μL, 其中甲醇含有BHT; 加超纯水120 μL使分层, 高速离心 (10 000 r·min−1) 10 min; 收集下层氯仿溶液 (约250 μL) 氮气吹干, 并用甲醇60 μL复溶, 转移至微量进样管中以备进样。
样品UPLC-Q-TOF/MS分析质谱条件 质谱以ESI为离子源实现与液相的串联, 并能在正离子模式下对样品进行信号采集。质量数采集范围设定: 400~1 200 Da。正离子质谱条件: 毛细管电压: 3 200 V; 样品锥孔电压: 30 V; 萃取锥孔电压: 2.0 V; 源温度: 100 ℃; 脱溶剂气温度: 350 ℃; 锥孔气流速: 50 L·h−1; 脱溶剂气流速: 350 L·h−1; 离子能量: 1 V; 碰撞能量: 10 V。二级质谱参数设定: 对化合物进行二级质谱信号测定需考察碰撞能量。其设置范围为20~30 V, 根据不同类别的磷脂采用不同的碰撞能量。
色谱条件 采用UPLC BEH-C18柱 (2.1 mm × 50 mm, 1.7 μm) 对样品进行分析, 色谱系统为: Waters Acquity UPLC-Q-TOF Micro MS, 进样量为: 5 μL; 流速: 0.3 mL·min−1; 柱温: 50 ℃。流动相A: 含10 mmol·L−1甲酸铵的水溶液; 流动相B: 含10 mmol·L−1甲酸铵的乙腈−异丙醇 (1∶1) 混合溶液。梯度洗脱条件: 0~4 min, 39%~18.6% A; 4~20 min, 18.6%~10% A; 20~21 min, 10%~0% A; 21~27 min, 100% B。
大鼠血浆磷脂成分的鉴定 将检测出的化合物 (正常组8个样品, 模型组12个样品) 精确分子量及元素组成与数据库 (Lipid Maps) 中的化合物进行对比, 各种加合离子均考虑在内, 并限定其误差 (仪器测量值与理论值的差值除以理论值所得的数值) 在 5 ppm以内; 各个化合物的保留时间以及同位素峰匹配作为辅助鉴定方式, 并通过二级质谱碎片信息, 得到大鼠血浆的磷脂成分。将鉴定得到的大鼠血浆磷脂成分, 再通过R软件对生物标记物进行筛选。
数据处理 通过以Centroid模式检测得到的总离子流图可通过Waters公司开发的Markerlynx软件进行数据转换, 得到以检测信号为变量和以信号强度积分值作为数据而整合出的数据矩阵。此数据矩阵可用于后续的数据处理。
在R软件 (公司) 中一软件包 (BioMark软件包) 能够实现对两组样品中特异性的标志物进行筛选。其基本原理是综合统计学方法如: Student t检验、主成分回归 (PCR)、偏最小二乘回归 (PLS)、重要变量法 (VIP) 等, 找出各个方法所筛选出的共同标志物, 并确定其为真正的生物标志物。
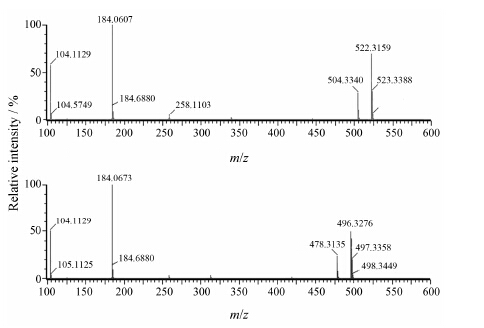
结果 1 磷脂对照品的二级质谱信息图 1和图 2显示了磷脂对照品PC (16∶0/18∶1)、PC (18∶0/18∶2)、PC (18∶1/0∶0) 和PC (16∶0/0∶0) 化合物在正离子模式下的二级裂解碎片。其碎片信 号中有一共有的特征峰m/z 184, 可推断其结构中含有磷酸胆碱极性头部。其中PC (18∶1/0∶0) 和PC (16∶0/0∶0) 又属于溶血PC即LPC, LPC化合物容易脱水, 形成 [M+H−H2O]+ 碎片, 即图 2中峰m/z 504和峰m/z 478。图 3显示了磷脂对照品PE (18∶0/0∶0) 在正、负离子模式下的二级裂解碎片, 正离子条件下PE主要通过丢失极性磷酸乙醇胺结构形成 [M+H−141]+碎片。中性丢失m/z 141是PE类化合物的特征碎片。

|
Figure 1 MS/MS fragment of PC (16∶0/18∶1) and PC (18∶ 0/18∶2) |
|
Figure 2 MS/MS fragment of PC (18∶1/0∶0) and PC (16∶0/ 0∶0) |

|
Figure 3 MS/MS fragment of PE (18∶0/0∶0) |
从总离子流图 (图 4) 上来看, 各组样品差异性并不大, 只是峰强度发生的微弱变化, 故需要借助数据处理来辨别两组样品之间的变化情况。
|
Figure 4 Two sets of samples in the positive ion mode of total ion flow diagram, bottom-up NC, MC group separately |
通过数据处理以及对大鼠血浆磷脂成分的鉴定, 再运用R软件对生物标记物进行筛选得到的大鼠血浆磷脂成分及其在正常组与模型组中的含量变化情况见表 1。从表 1中可看到病理标记物主要有磷脂酰胆碱类 (PC) 以及甘油三酯类 (TG), 而磷脂酰胆碱类又分为二酰基磷脂酰胆碱 [如分子式为PC (35∶4)] 和单酰基磷脂酰胆碱 [如分子式为PC (p-38∶0) 和PC (o-38∶0)]。在本次实验中主要发现的病理标志物是二酰基磷脂酰胆碱。在疾病模型组中二酰基PC类以及甘油三酯类 (TG) 与正常组比较, 有显著变化 (P < 0.05)。
|
|
Table 1 Information of biomarkers. NC: Normal control; MC: Model control. P < 0.05 vs NC group |
由以上结果可知除了TG , 其余的生物标志物均为含胆碱 (choline) 的磷脂类如二酰基PC类、溶血PC类, 而这些成分均与2型糖尿病的风险因子具有密切关系[17]。有研究[18]表明二酰基PC类对于机体的肝脏分泌富含甘油三酯的极低密度脂蛋白 (VLDL) 和高密度脂蛋白 (HDL) 的过程极其重要, 作为血清抗氧化剂以阻止脂蛋白的氧化。从实验结果可以看出, MC组中大鼠血浆二酰基PC类的含量明显比NC组大鼠低, 整个血浆中二酰基PC类成分都呈下降趋势, 由此可以推测病理状态下的大鼠代谢消耗了更多的二酰基PC类磷脂成分或者体内二酰基PC类的合成减少, 导致血清中的抗氧化剂减少, 从而使机体出现氧化损伤的状态。而机体长期处于氧化损伤状态也是导致2型糖尿病发病的病理基础之一[19]。此外, 由于肝脏中二酰基PC类生物合成效率的降低会导致体内血浆中TG类成分降低[20], 说明二酰基PC类的含量与TG类的含量成正比 (表 1)。
对于TG类而言, 表现出了与2型糖尿病的风险因子密切的相关性, 本研究预示着磷脂的头部与脂肪酸尾部的连接情况在脂质代谢组学中扮演着重要的角色。结果还发现, 在病理状态下表现为高碳数高不饱和度的TG类成分减少, 而在此推测病理状态下主要是由于高碳数高不饱和度的TG类成分的代谢的增强, 从而导致代谢产生的游离不饱和脂肪酸的增多。已有文献[21]表明血样中不饱和脂肪酸含量与糖尿病发病呈正相关, 这进一步证明了本实验的推断。
本研究发现, 2型糖尿病状态下, 大鼠血浆中的二酰基PC类磷脂和高碳数高不饱和的TG类磷脂的含量都呈下降趋势, 且这两类磷脂与2型糖尿病的发生发展密切相关。因此, 二酰基PC与高碳数高不饱和度的TG可以作为诊断2型糖尿病的潜在标志物, 对临床治疗2型糖尿病有一定的指导意义。
| [1] | Tang L, Yang YS, Ji RY. Progress in studies on antidiabetic agents [J]. Acta Pharm Sin (药学学报), 2001, 36: 711-715. |
| [2] | Landgraf R. Meglitinide analogues in the treatment of type 2 diabetes mellitus [J]. Drugs Aging, 2000, 17: 411-425. |
| [3] | Schernthaner G, Di Mario U, Drzewoski J, et al. Guide study: double-blind comparision of once-daily gliclazide MR and glimepiride in type 2 diabetic patients [J]. Eur J Clin Invest, 2004, 34: 535-542. |
| [4] | Donath MY, Shoelson SE. Type 2 diabetes as an inflammatory disease [J]. Nat Rev Immunol, 2011, 11: 98-107. |
| [5] | Brasaemle DL. DisseCCTing phospholipid function in lipid droplet dynamics [J]. Cell Metab, 2011, 14: 437-438. |
| [6] | Park SH, Das BB, Casagrande F, et al. Structure of the chemokine receptor CXCR1 in phospholipid bilayers [J]. Nature, 2012, 491: 779-783. |
| [7] | Gordon BR, Parker TS, Levine DM, et al. Neutralization of endotoxin by a phospholipid emulsion in healthy volunteers [J]. J Infect Dis, 2005, 191: 1515-1522. |
| [8] | Kendall DM. The dyslipidemia of diabetes mellitus: giving triglycerides and high-density lipoprotein cholesterol a higher priority? [J]. Endocrinol Metab Clin North Am, 2005, 34: 27-48. |
| [9] | Von Eckardstein A, Schulte H, Assmann G. Risk for diabetes mellitus in middle-aged Caucasian male participants of the PROCAM study: implications for the definition of impaired fasting glucose by the American Diabetes Association Prospective Cardiovascular Munster [J]. J Clin Endocrinol Metab, 2000, 85: 3101-3108. |
| [10] | Cnop M, Hannaert JC, Grupping AY, et al. Low density lipoprotein can cause death of islet β-cells by its cellular uptake and oxidative modification [J]. Endocrinology, 2002, 143: 3449-3453. |
| [11] | Abderrahmani A, Niederhauser G, Favre D, et al. Human high-density lipoprotein particles prevent activation of the JNK pathway induced by human oxidised low-density lipoprotein particles in pancreatic beta cells [J]. Diabetologia, 2007, 50: 1304-1314. |
| [12] | Drew BG, Duffy SJ, Formosa MF, et al. High-density lipoprotein modulates glucose metabolism in patients with type 2 diabetes mellitus [J]. Circulation, 2009, 119: 2103-2111. |
| [13] | Carpentier YA, Portois L, Sener A, et al. Correlation between liver and plasma fatty acid profile of phospholipids and triglycerides in rats [J]. Int J Mol Med, 2008, 22: 255-262. |
| [14] | Roehrich ME, Mooser V, Lenain V, et al. Insulin-secreting beta-cell dysfunction induced by human lipoproteins [J]. J Biol Chem, 2003, 278: 18368-18375. |
| [15] | Tian QL. Plasma Phospholipid Metabolic Profiling and Biomarkers of Type 2 Diabetes Mellitus Based on UPLC/Q-TOF MS (基于UPLC/Q-TOF MS的T2DM大鼠血浆中磷脂代谢轮廓分析及标志物识别) [D]. Guangzhou: Guangdong Pharmaceutical University, 2012. |
| [16] | Luo JY, Gao Y, Wang CY. Study on lipid regulation of Huangqi powder and Huangqi Gegen decoction [J]. Chin J New Drugs Clin Rem (中药新药与临床药理), 2013, 24: 221-226. |
| [17] | Huang M, Zhu C, Liang QL, et al. Effect of tangshen formula on phospholipids metabolism in diabetic nephropathy patients [J]. Acta Pharm Sin (药学学报), 2011, 46: 780-786. |
| [18] | Wallner S, Schmitz G. Plasmalogens the neglected regulatory and scavenging lipid species [J]. Chem Phys Lipids, 2011, 164: 573-589. |
| [19] | Li AQ, Lu H, Xu WJ, et al. The research development of oxidative stress and T2DM [J]. Prog Mod Biomed (现代生物医学进展), 2010, 10: 2371-2378. |
| [20] | Jacobs RL, Devlin C, Tabas I, et al. Targeted deletion of hepatic CTP: phosphocholine cytidylyltransferase α in mice decreases plasma high density and very low density lipoproteins [J]. J Biol Chem, 2004, 279: 47402-47410. |
| [21] | Yao M. Study on the Relationship Between PUFAs Disorder and Related Gene Polymorphism and Peroxisomal β Oxidation in Type 2 Diabetes (2型糖尿病PUFAs代谢异常与相关基因多态性及过氧化物酶体β-氧化关系的研究) [D]. Shijiazhuang: Hebei Medical University, 2014. |
 2015, Vol. 50
2015, Vol. 50


