2. 山东中医药大学附属医院, 山东 济南 250011
2. The Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250011, China
代谢组学 (metabonomics) 是对某一生物或细胞所有低相对分子质量 (相对分子质量 < 1 000) 代谢产物进行定性和定量分析的学科,通过考察生物体系受刺激或扰动后其代谢产物的变化或其随时间的变化,来研究生物体系的代谢途径的一种技术[1]。代谢组学作为一种新型系统生物学方法,可以研究代谢产物及其动力学、组成、相互作用和不同干预措施的反应[2]。与通过研究核酸、蛋白等生物大分子的结构与功能去阐释生命现象本质的分子生物学相比[3],代谢组学可以实现对特定生物组分所有代谢物的定性和定量研究,反映生物体自身病理状态和药物等外界刺激下的应答,并且识别未知代谢产物,可在找到底物、产物、中间体和关键酶的基础上,建立对整个代谢途径的描述[4, 5]。
原发性高血压 (essential hypertension,EH) 是最常见的慢性疾病,也是心脑血管病最主要的危险因素。随着对高血压病研究的深入,各种学说的不断提出,极大地丰富了对高血压病本质的认识,目前已知肾素−血管紧张素−醛固酮系统 (renin-angiotensin- aldosterone system,RAAS) 是机体重要的血压调节系统,其过度兴奋是造成原发性高血压的主要病理机制之一。血管紧张素Ⅱ (AngⅡ) 是已知最强的收缩血管的物质之一,具有收缩小动脉、兴奋交感神 经、刺激肾上腺皮质分泌醛固酮,并且可促进内皮细胞内活性氧自由基的生产,导致内皮功能障碍,从而引起血压升高作用[6,7]。因此对抑制AngⅡ可有效的控制血压。血管紧张素Ⅱ受体拮抗剂 (angiotensin receptor blocker,ARB) 的问世被认为是高血压药物治疗新的里程碑,已确立为抗高血压一线药物,具有降低血压、保护心脏血管和肾脏的作用。缬沙坦 (valsartan) 是目前临床上常用的ARB,具备长效、平稳、高效及低毒的良好药物特性。因此本文采用代谢组学的方法,通过研究缬沙坦干预自发性高血压大鼠后血清内源性代谢物的变化,检测并鉴定血清中的代谢产物和相关代谢途径,以期为阐述缬沙坦的作用机制做出有意的探索。
材料与方法 实验动物SPF级8周龄雄性自发性高血压大鼠 (SHR) 12只,SPF级雄性Wistar京都种大鼠 (WKY) 6只,购于北京维通利华实验动物技术有限公司,合格证书: SCXK (京) 2012-0001。
实验药物缬沙坦为北京诺华制药有限公司产品,批号: x1041,使用前生理盐水溶解,配制成含缬沙坦2.88 mg·mL−1的混悬液,置4 ℃冰箱保存备用。
仪器及试剂ALC-NIBP型清醒大鼠血压心率测定仪(上海奥尔科特生物科技有限公司); ALC-HTP动物恒温系统 (上海奥尔科特生物科技有限公司); ALC-NIBP无创血压测量分析系统 (上海奥尔科特生物科技有限公司); Agilent 1200系列高效液相色谱仪 (美国Agilent公司); Agilent 6220高分辨飞行时间质谱仪 (美国Agilent公司); 乙睛、甲醇 (Merck公司); 甲酸 (美国Tedia公司); 水为Milli-Q超纯水; 其他试剂均为国产分析纯。
分组及给药方法将SHR大鼠随机分成2组 (模型组和缬沙坦组),每组6只,并设WKY 6只作 为正常对照组。缬沙坦组给予缬沙坦混悬液2.88 mg/ (200 g·d)。正常组和模型组给予等量的生理盐水。按2 mL/200 g灌胃给药,每天下午定时给药,每周给药6天,连续给药4周。每周测量体重一次,并根据体重的变化调整给药量。
血压的检测及处理 采用无创性尾动脉脉搏间接测压法测量各组大鼠清醒状态下尾动脉收缩压,连续测量3次,取平均值作为应测血压值。分别测量记录连续干预后第1周末、第2周末、第3周末、第4周末各组大鼠的收缩压。血压数据采用SPSS17.0软件进行方差分析,计量资料用均数 ± 标准差 (![]() ± s) 表示,组内比较采用独立样本t检验,组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
± s) 表示,组内比较采用独立样本t检验,组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
连续给药4周后禁食不禁水12 h,麻醉动物,下腔静脉取血,2 500 r·min−1离心15 min,取血清,于 −80 ℃保存备用。用时室温解冻,摇匀; 精密移取血清1 mL,加入甲醇2 mL,涡旋2 min,冰箱4 ℃静置冷藏4 h,离心15 min,上清液微孔滤膜滤过,作为样品溶液。
血样的分离与图谱数据的采集色谱条件: 色谱柱为Zorbax SB-C18柱 (4.6 mm × 100 mm,3.5 μm)。流动相为: 0.1% 甲酸水 (A)−乙腈 (B),梯度洗脱,0~20 min,5%~80% B; 20~30 min,80%~90% B; 30~40 min,90%~95% B,柱平衡时间: 10 min; 进样量: 10 μL; 流速1.0 mL·min−1; 柱温: 25 ℃。质谱条件: 采用ESI源,正离子模式下: 毛细管电压4 kV,雾化气压力35 psi (1 psi ≈ 6.9 kPa),干燥气流速9 L·min−1,干燥气温度350 ℃,碎片电压140 V; 参比离子m/z 121.050 873和922.009 798。分流比2∶1,质量数扫描范围m/z 100~1 000。
数据分析通过安捷伦定性分析软件 (Qualitative Analysis,Agilent Masshunter workstation) 的Find by Molecular Feature功能查找未知化合物,归类,给出化合物的“Feature分子特征”。原始数据“.d”被转换为“.cef”,进一步用于MPP进行保留时间校准、峰对齐、基线校准、数据的归一化和对数转换,其中峰对齐中保留时间范围设为0.2 min,质量范围设为15 ppm ± 2 mDa。初始过滤器可以通过丰度、保留时间范围或质量范围进行滤噪,其中最小绝对丰度设为5 000 (去除噪音); 通过标记过滤可以剔除在多个样本中没有找到的化合物,其中过滤器被设置为剔除在所用样品中只出现一次的化合物,通过频度过滤,根据80% 规则,进一步去除在某一组中出现频率 (非零值) 低于80% 的化合物。通过MPP的统计分析功能,对于3组数据选用ANOVA分析,并采用Turkey post hoc检验进行多重比较 (P < 0.05)。P < 0.05的差异变量,再通过趋势分析−倍数变化过滤器,把模型组设为对照条件,即正常组与模型组或缬沙坦组与模型组对比,能有一组满足倍数变化 (FC = 2) 且有趋势变化的即为最终确定的可能标志物。经过MPP处理找到的变量,导入SIMCA-P软件 (version 11.5,Umetrics AB,Umea,Sweden) 进行偏最小二乘判别分析 (partial least squares discriminant analysis,PLS-DA)。根据PLS- DA分析的VIP (variable importance for the projection) 图,寻找对分类贡献较大的变量 (即保留时间),VIP > 1时的变量具有统计学意义,可作为候选差异变量。
代谢通路智能分析应用MetPA平台[8] (http:// metpa.metabolomics.ca./) 分析缬沙坦干预机体后显著影响的代谢通路。本次研究将筛选出的代谢产物的相对含量上传到MetPA平台,采用大鼠代谢物数据库进行代谢物匹配,之后进行代谢通路富集分析和拓扑分析。
结果 1 各组收缩压的比较与正常组相比,模型组收缩压明显升高,具有显著差异性 (P < 0.001),并且在干预期间血压保持在较为稳定的水平; 与干预前比较,给予缬沙坦1周后即有降压效应 (P < 0.05); 与模型组相比,缬沙坦组收缩压显著降低 (P < 0.05)。随着干预时间的延长,降压效果逐渐增强,干预4周后收缩压与干预前相比降低了23个mmHg (1 mmHg ≈ 133 Pa),效果显著。结果见图 1。

|
Figure 1 Change of systolic blood pressure in each group. P < 0.05,**P < 0.001 vs model group; #P < 0.05 vs the previous administration |
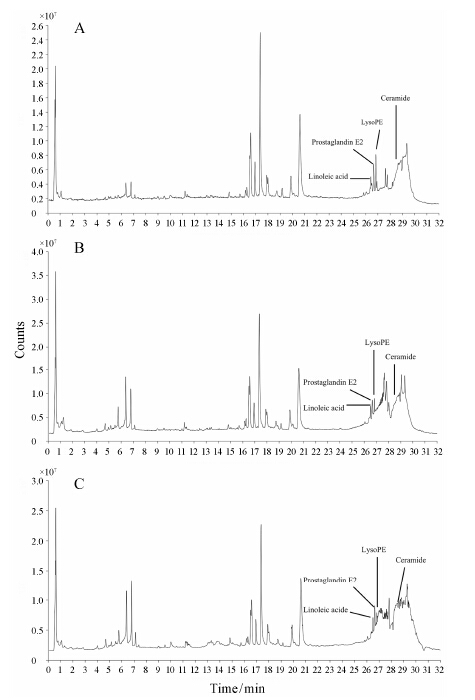
图 2为正常大鼠、SHR和经缬沙坦干预后的SHR血清总离子流图,在一个分析流程内可同时检测到多种不同的体内内源性代谢物,说明正常组和模型组大鼠的血清色谱峰总离子流有差异; 模型组与缬沙坦组在同一保留时间色谱峰大小、高低表达有差异, 说明经缬沙坦干预后内源性代谢物发生了变化。
|
Figure 2 Representative total ion current chromatograms of rat serum. A: Normal group; B: Model group; C: Valsartan group |
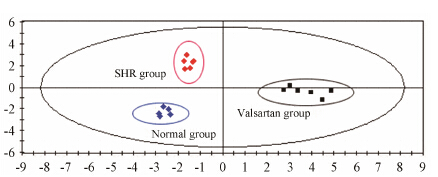
采用有监督模式识别方法PLS-DA对3组样本之间的差异进行分析。从PLS-DA散点图 (图 3) 可发现,模型组在空间上与正常组分离良好,无交叉和重叠,说明两组代谢模式存在明显的差异; 缬沙坦组在空间上与模型组较好区分,提示缬沙坦干预后SHR血清代谢模式出现改变,表明缬沙坦对SHR的代谢紊乱有一定的干预作用。所建模型变量的拟合能力指数(R2Y) 为0.977,模型的预测指数Q2cum为0.958,提示模型的拟合能力和预测能力均良好。
|
Figure 3 Score scattering plots of PLS-DA of metabonome of rat serum in normal group (blue),model group (red) and valsartan group (black) |
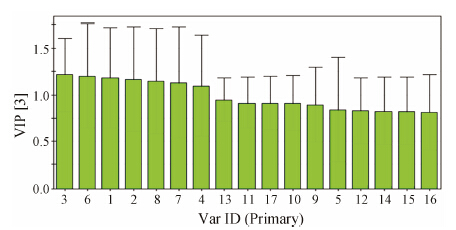
通过PLS-DA分析,正常组、模型组、缬沙坦组大鼠的血浆PLS-DA载荷图中的每一个点代表一个变量,变量对分类的重要程度由其VIP值的大小来衡量,并依据VIP对变量进行筛选。选择VIP > 1且具有统计学意义的变量作为潜在生物标志物的鉴别依据[9],如图 4。根据变量对应的保留时间,检索以下3个在线数据库: KEGG (http://www.kegg.com),METLIN (http://www.metlin.scipps.edu),HMDB (http://www. hmdb.ca),并与文献进行比较。最终鉴定了4个化合物的结构及其代谢途径 (表 1)。
|
Figure 4 VIP score chart of PLS-DA |
|
|
Table 1 Potential biomarkers in rat serum and metabolic pathway. aMetabolites identified by comparing with literatures and database resources; bLysophospholipid; cTrends of model group compared with normal group and valsartan group of metabolites. ↑: Up-regulated; ↓: Down-regulated. ***P < 0.001 vs normal group; △△△P < 0.001 vs model group |
为进一步比较缬沙坦对筛选出的潜在靶标代谢物的干预作用,比较了这4个代谢物的峰强度。如图 5所示,与正常组相比,模型组的神经酰胺、亚油酸、前列腺素E2与溶血卵磷脂均呈升高趋势,经缬沙坦干预后,各潜在代谢物明显下调,表明缬沙坦对SHR有调节作用。

|
Figure 5 Comparison of different potential biomarkers in rat serum of normal group,model group and valsartan group after intervention. P < 0.05,**P < 0.001 vs model group |
很多代谢物会涉及到多条代谢通路,这种现象意味着代谢通路分析方法对于代谢组学实验中的生物学解释具有很好的优势[10]。MetPA (metabolomics pathway analysis) 是全功能的、易于使用的、基于网络的代谢路径分析工具,它结合先进的通路富集分析与拓扑分析,帮助研究者确定实验条件下最可能的相关代谢通路[8]。因此,利用MetPA平台分析缬沙坦干预SHR过程中相关的代谢通路。将表 1中鉴定出来的内源性代谢物输入MetPA平台,构建分析代谢通路图。将代谢通路的重要值界定在0.05,当某一条代谢通路的重要值大于0.05时,被认为是潜在的靶标代谢通路。结果显示,SHR的代谢紊乱主要与亚油酸代谢、鞘脂代谢、磷脂代谢相关 (表 2)。图 6显示了使用MetPA平台进行的代谢通路总结图,图中圆圈代表了所有匹配的代谢通路。每一个圆圈的颜色和大小分别依据代谢通路的p值和通路重要值确定,图 6表明缬沙坦干预机体后最为相关的代谢通路是亚油酸代谢。
|
|
Table 2 Result of intelligent metabolic pathways with MetPA. aTotal number of compounds in the pathway; bActually matched number from the user uploaded data; cOriginal p value calculated from the enrichment analysis; dp value adjusted by Holm-Bonferroni method; ep value adjusted using false discovery rate; fPathway impact value calculated from pathway topology analysis |

|
Figure 6 Summary diagram of pathway analysis with MetPA. A: Linoleic acid metabolism; B: Sphingolipid metabolism; C: Glycerophospholipid metabolism |
缬沙坦是一种有效的非肽类AngII受体阻滞药,现普遍认为它通过与AngII受体亚型Ⅰ (AT1) 跨膜区的氨基酸相互作用,从而阻止AngII与AT1受体的结合,以达到受体水平阻断AngII的血管效应[11]。实验结果表明,通过连续给药4周,缬沙坦能够降低SHR清醒状态下的尾动脉收缩压,降压效果良好,作用缓和、持续。
AngII的生物效应主要是通过AT1受体实现的,Ang II与AT1受体结合可活化多条信号通路,其中AT1受体诱导血管收缩而引起血压升高的功能,主要是由经典的G蛋白偶联的信号传导通路介导的。AT1受体一旦被激活,便偶联Gαq/11、Gα12/13及Gβy复合体,随后激活下游的应答因子,如磷酸酯酶PLC、PLA2及PLD等[12],从而引发一系列生物学反应,最终导致血压的升高。本课题组通过比对鉴别出的代谢产物,联系相关的代谢通路,发现这些代谢产物与G蛋白偶联通路密切相关,并构建了相关代谢网络示意图,结果见图 7。

|
Figure 7 Signaling pathway of metabolites. G protein-coupled pathway is highlighted in blue and endogenous metabolites in red |
亚油酸作为一种功能性的多不饱和脂肪酸,是体内必须的脂肪酸。在体内,卵磷脂在磷脂酶A2 (phospholipase A2,PLA2) 的作用下,生成亚油酸,亚油酸在δ-6-脱氢酶的催化作用下转化成γ-亚麻酸,从而产生花生四烯酸 (arachidonic acid,AA)[13]。在高血压病理过程中RAAS被激活,体内大量AngⅡ与AT1受体结合,AT1受体激活后便偶联Gαq/11,随后激活下游的应答因子PLA2。PLA2的激活促进了γ-亚麻酸的生成,进而产生大量的AA,临床研究表明,大剂量AA增加了血栓素A2 (TXA2) 的含量,TXA2是一种促血管收缩和血小板聚集的生物活性物质,与血压变化成正相关[14, 15]。缬沙坦能够与AngⅡ竞争结合AT1受体,AT1受体被阻滞后其激活PLA2的作用受到限制,减少亚油酸的生成,进而影响AA的生成,舒张血管,降低血压。本实验研究中得到经缬沙坦干预后SHR血清中亚油酸的含量显著降低,这一结果与前期临床研究相吻合[16]。
前列腺素 (prostaglandins,PGs) 在体内主要由AA通过环氧化酶途径代谢而生成,而前列腺素E2 (PGE2) 则是体内产生最广泛作用、最多样化的PGs。一经合成即通过异化扩散移出细胞,通过与细胞膜上相应的受体 (eprostanoid,EP) 相结合,经G蛋白偶联产生第二信使,激活特异的信号通路从而引起一系列的生理或病理效应[17]。目前已知PGE2通过4种受体发挥生理作用,即EP1、EP2、EP3、EP4,其中EP1和EP3受体的激活可介导血管收缩,血压升高效应; 而EP2和EP4则介导血管舒张,血压降低作用[18]。实验所显示的血清中PGE2变化,从某种程度上表明缬沙坦对机体PGE2的代谢有密切的关系,但由于实验动物有限,并且PGE2的每种受体与特定的G蛋白偶联而传导各种细胞内信号,与血压的关系相对复杂,因而仍需要对其机制进行深入研究。
前瞻性研究显示[19],游离脂肪酸是高血压的独立危险因素,血浆游离脂肪酸浓度升高与高血压发病有明显相关性,并且在血脂异常与高血压病患者中,均可表现出血管功能异常[20]。溶血卵磷脂 (LPC) 是氧化型低密度脂蛋白 (oxidized low density lipoprotein,ox-LDL) 的主要活性成分,LPC是通过PLA2 或者是卵磷脂−胆固醇酰基转移酶 (LCAT) 水解磷脂酰胆碱 (PC) 而得到[21]。大量的研究表明,ox-LDL是致高血压的独立危险因子,而溶血卵磷脂是ox-LDL损伤血管内皮依赖性舒张功能的主要脂质成分[22],因此溶血卵磷脂影响血管内皮功能,促进了高血压的形成和发展。本实验中模型组大鼠血清LPC含量升高,游离脂肪酸的代谢水平升高,与文献[23]报道的“游离脂肪酸可能是高血压的潜在代谢标志物”相互印证,表明游离脂肪酸的水平以及其相关代谢在高血压的发生发展中发挥了重要作用。LPC的升高说明在高血压状态下AT1激活PLA2后,PLA2水解磷脂Sn-2位脂肪酸,释放LPC。缬沙坦可以拮抗AT1,使PLA2活性降低,一定程度上抑制了LPC的代谢水平,部分解释了经缬沙坦干预后游离脂肪酸水平下降的原因。本研究中经缬沙坦干预后大鼠游离脂肪水平的下降趋势与前期临床研究相一致[24,25]。有研究者对具有良好降压效果的人参皂苷深入研究发现[26],在有效抗高血压的同时人参皂苷同样也具有下调游离脂肪酸水平、调节机体代谢紊乱的作用。缬沙坦是否与人参皂苷存在共同的代谢调节机制有待于进一步研究,但不难发现一个良好的抗高血压药物其降压作用与调节游离脂肪酸代谢存在一定的关联性。
神经酰胺 (ceramide,CE) 属于鞘脂类一族,作为细胞内脂质第二信使,是信号传导途径中的枢纽,在细胞增殖、分化、生长抑制和凋亡等多种细胞活动中发挥调节功能,特别是在诱导细胞凋亡的过程中起着重要的作用[27]。当CE在体内含量增多时,可激活磷酸激酶C (PKC),兴奋c-Jun氨基末端激酶 (JNK),活化c-Jun而诱导凋亡[28]。血管内皮凋亡时,会造成血管收缩因子与舒张因子的失衡,造成血管收缩,血压升高。实验结果显示,经缬沙坦干预后CE含量降低,说明缬沙坦对其起到抑制作用。另一方面,在生物体内AT1激活下游应答因子磷脂酶C (PLC),随后产生的甘油二脂也可以激活PKC[29],因而,当缬沙坦抑制AT1的激活后,PKC活性降低,间接的抑制了CE诱导细胞凋亡的作用。
综上所述,本课题组通过代谢组学的方法,从整体出发对经缬沙坦干预后SHR产生的内源性应答的改变进行了系统分析,关注药物进入机体后的整体改变和微观转化,为阐明缬沙坦作用机制做出了积极的探索。本课题组将进一步通过实验验证潜在标志物,探寻缬沙坦作用机体后的信号传导机制,以明确降压机制。
| [1] | Nicholson JK, Connelly J, Lindon JC, et al. Metabonomics: a platform for studying drug toxicity and gene function [J]. Nat Rev Drug Discov, 2002, l: 153-161. |
| [2] | Oresic M. Metabolomics, a novel tool for studies of nutrition, metabolism and lipid dysfunction [J]. Nutr Metab Cardiovasc Dis, 2009, 19: 816-824. |
| [3] | Feng ZH. Medical molecular biology the first lecture: introduction of medical molecular biology [J]. Chin J Pract Intern Med (中国实用内科杂志), 1994, 14: 694-696. |
| [4] | Luo GA, Wang YM, Liang QQ, et al. Traditional Chinese Medicine Systems Biology (中医药系统生物学) [M]. Bengjing: Science Press, 2011: 224. |
| [5] | Xu Z, Cai XJ, Zeng S. Thoughts and exploration on pharmacokinetic study of herbal medicines based on metabonomics and complex network [J]. Acta Pharm Sin (药学学报), 2012, 47: 558-564. |
| [6] | Wang CY, Zhang SP, Xu Y, et al. Effect of safflor yellow B on vascular endothelial cells injury induced by angiotensin-II [J]. Acta Pharm Sin (药学学报), 2012, 47: 811-815. |
| [7] | Hata A, Namikawa C, Sasaki M, et al. Angiotensinogen as a risk factor for essential hypertension in Japan [J]. J Clin Invest, 1994, 93: 1285-1287. |
| [8] | Xia J, Wishart DS. MetPA: a web-based metabolomics tool for pathway analysis and visualization [J]. Bioinformatics, 2010, 26: 2342-2344. |
| [9] | Chong IG, Jun CH. Performance of some variable selection methods when multicollinearity is present [J]. Chemom Intell Lab Syst, 2005, 78: 103-112. |
| [10] | Sangster T, Major H, Plumb R, et al. A pragmatic and readily implemented quality control strategy for HPLC-MS and GC-MS-based metabonomic analysis [J]. Analyst, 2006, 131: 1075-1078. |
| [11] | Huang Y, Qiu XL. Effect of valsartan on plasma aldosterone endothelin and its antihypertension efficacy [J]. Acad J Guangzhou Med Coll (广州医学院学报), 2011, 29: 34-36. |
| [12] | Mehta PK, Griendling KK. Angiotensin II cell signaling: physiological and pathological effects in the cardiovascular system [J]. Am J Physiol Cell Physiol, 2007, 292: C82-97. |
| [13] | Zhou TY, Ren F, Deng L, et al. Research progress in physiological and biochemical function of linolenic acid [J]. Guizhou Agric Sci (贵州农业科学), 2011, 39: 53-58. |
| [14] | Rao ML, Tang M, He JY, et al. Effects of paeoniflorin on cerebral blood flow and the balance of PGI2/TXA2 of rats with focal cerebral ischemia-reperfusion injury [J]. Acta Pharm Sin (药学学报), 2014, 49: 55-60. |
| [15] | Zou BM, Jiang SS, Li JC, et al. Release of plasm a arachidonic acid concentration in hypertension and its effect of modulation [J]. Chin Crit Care Med (中国危重病急救医学), 1996, 8: 149-151. |
| [16] | Wang SZ. Research on Metabonomics with Syndrome Type of Hypertension and the Medical Intervention (高血压病中医证型及药物干预的代谢组学研究) [D]. Nanjing: Nanjing University of Chinese Medicine, 2010. |
| [17] | Xu HM. Effects of Prostaglandin E2 Receptors and G Protein Coupled Signal Transduction on Synoviocytes of Rats with Adjuvant Arthritis and the Effect of Total Glucosides of Paeony (前列腺素E2受体及其G蛋白偶联信号转导在佐剂性关节炎大鼠滑膜细胞功能中的作用和白芍总昔对其的影响) [D]. Hefei: Anhui Medical University, 2006. |
| [18] | Miao YF, Kang JH, Yang JC, et al. Prostagland in E receptors in regulation of blood pressure [J]. Chin Pharmacol Bull (中国药理学通报), 2010, 4: 424-427. |
| [19] | Fagot-Campagna A, Balkau B, Simon D, et al. High free fatty acid concentration: an independent risk factor for hypertension in the Paris prospective study [J]. Int J Epidemiol, 1998, 27:808-813. |
| [20] | Shimokawa H. Primary endothelial dysfunction: atherosclerosis [J]. J Mol Cell Cardiol, 1999, 31: 23-37. |
| [21] | Wu S. Metabonomic Studies of Essence of Hypothyroidism with Spleen and Kidney-yang Deficiency Syndrome and Therapeutical Effects of Sini Decoction (基于代谢组学的甲减脾肾阳虚证本质及四逆汤治疗作用研究) [D]. Shanghai: Second Military Medical University, 2013. |
| [22] | Deng HF, Lu JH, Luo JR, et al. Effect of puerarin on impaired endothelium-dependent relaxation Induced by Lysophosphatidylcholine in rabbit aorta [J]. J Xiangnan Univ Med Sci (湘南学院学报 医学版), 2007, 1: 17-19. |
| [23] | Lu Y, A J, Wang G, et al. Gas chromatography/time-of-flight mass spectrometry based metabonomic approach to differentiating hypertension-and age-related metabolic variation in spontaneously hypertensive rats [J]. Rapid Commun Mass Spectrom, 2008, 866: 64-76. |
| [24] | Xie ZH. The Influence of Combined Treatment Amlodipine and Valsartan on Plasma Free Fatty Acids and Adiponectin in Patient with Essential Hypertension (氨氯地平联合缬沙坦治疗对高血压病患者血浆脂联素和游离脂肪酸的影响) [D]. Nanchang: Second Affiliated Hospital of Nanchang University, 2008. |
| [25] | Quang YY. Action and Mechanism of Pioglitazone and Valsartan Treatment of Non-alcoholic Fatty Liver Disease (吡格列酮、缬沙坦治疗非酒精性脂肪肝病的作用机理研究) [D]. Changsha: Xiangya Hospital of Central South University, 2008. |
| [26] | A JY, Wang GJ, Hao HP, et al. Differential regulations of blood pressure and perturbed metabolism by total ginsenosides and conventional antihypertensive agents in spontaneously hypertensive rats [J]. Acta Pharmacol Sin, 2010, 31: 930-937. |
| [27] | Colombaioni L, Garcia-Gil M. Sphingolipid metabolites in neural signaling and function [J]. Brain Res Brain Res Rev, 2004, 46: 328-355. |
| [28] | Yu J, Novgorodov SA, Chudakova D, et al. JNK3 signaling pathway activates ceramide synthase leading to mitochondrial dysfunction [J]. J Biol Chem, 2007, 282: 25940-25949. |
| [29] | Cao CY. NMR Studies of Angiotensin Ⅱ Type 1 Receptor and the Interaction Between Valsartan and Mimetic Membranes (缬沙坦与类膜介质的相互作用及1型血管紧张素Ⅱ受体的NMR研究) [D]. Wuhan: Huazhong University of Science and Technology, 2012. |
 2015, Vol. 50
2015, Vol. 50


