寒热药性是传统中医学赋予中药的一种特殊属性,是在中医理论框架下潜方用药的核心和基础。基于其在中医药体系中的独特地位,诠释寒热药性的现代科学内涵已然成为这一领域中的关键科学问题之一。10年来,国家重点基础研究发展计划 (973计划) 先后多次立项以解析药性、尤其是寒热药性的客观属性和分子基础,但仍未取得突破性进展。针对中医学中的这一难点和重要议题,本课题组曾将现代生物学中的新发现——瞬变感受器电位离子通道 (transient receptor potential ion channel; TRP channels) 引入到寒热药性的研究中,并发现了规律性的联系[1,2],但以往的研究主要集中在对机体特定寒热感受通道 (Thermo-TRP) 的活性调节或表达调控的影响。本研究将热偶检测技术应用于中药寒热药性的分析中,揭示TRPV1通道介导中药寒热药性功能表征的科学实质。TRPV1通道蛋白是TRP通道蛋白家族中结构和功能研究最为清楚的家族成员之一,与机体的热觉和痛觉感受关系密切,在机体的背根神经节、三叉神经节等外周感觉神经上呈高丰度表达。本研究以 辛热性的温里中药辣椒 (已列入2010版中国药典)[3]为例,以其主要活性成分——辣椒碱 (已列入24版和25版《美国药典》[4,5]) 为研究对象,采用整体和离体相结合的研究模式,建立了辛热 (温) 类中药寒热属性的分子基础解析和生物评价方法,具有一定的普适性和内在规律性。本研究在实验工作的基础上提出激活TRPV1通道后影响机体热能的产生是辣椒等辛热 (温) 性中药表征药性的一种重要生物模式,为寒热药性的研究提供了一种新的研究思路,并为中药药性取得突破性进展奠定了基础。
材料与方法 动物和细胞新生SD大鼠乳鼠和成年昆明小鼠 [SCXK-(京) 2009-0017] 均购于北京维通利华养殖基地。乳鼠用于原代背根神经节(DRG) 神经元取材用; 小鼠饲养于标准笼内 [(22 ± 0.5) ℃; 湿度50%],自由饮水和饮食,适应1周后用于实验。动物实验操作严格按照中国实验动物保护和使用指导原则进行。HEK293细胞株购于协和医学院基础医学研究所。
主要试剂Leibovitz’s L15培养基、Neurobasal 培养基、胎牛血清 (FBS)、葡萄糖、B27添加剂、胶原酶均购自Gibco公司; 神经生长因子 (NGF)、多聚赖氨酸 (PLL)、层粘连蛋白 (LN)、胰蛋白酶 (trypsin) 均购自Sigma公司; 兔神经生长相关蛋白 (GAP)-43多克隆抗体购于Abcam公司; 兔抗鼠二抗购于Santa Cruz公司。Fluo-4和F-127为Invitrogen产品; 辣椒素 (capsaicin,≥ 98%) 和辣椒平 (capsazepine,≥ 98%) 购于Sigma公司; 辣椒平的终浓度为10 μmol·L-1,辣椒素使用浓度分别为0.1和1 μmol·L-1; TRPV1慢病毒载体、EndoFectinTM-Plus转染试剂和G418购于广州复能基因公司。
主要仪器解剖显微镜、OLYMPUS-CK光学显微镜、共聚焦显微成像系统 (奥林巴斯公司); BB16型CO2培养箱 (德国Heraeus公司); Eppendorf-5402F低温离心机 (美国基因仪器公司); 热活性检测分析仪 (美国Physitemp Instruments公司)。
DRG原代神经元的培养按照本室建立的常规方法[6]稍加改进。 乳鼠置于75% 乙醇消毒后剪除头部,在解剖显微镜下用眼科剪从背部剖开皮肤并沿脊椎将髓腔打开,暴露椎管内的脊髓,用显微镊小心从脊髓两侧的将椎管内背根神经节 (DRG) 取出,剔除神经根和包膜后,置于L15培养基中备用。将DRG自L15培养基移入胶原酶 (1 g·L-1) 中,37 ℃消化15 min后,用吸管小心吸除胶原酶,再换胰蛋白酶 (trypsin,25 g·L-1),37 ℃消化40 min。1 000 r·min-1离心5 min,小心吸去胰酶消化液,加入FBS中止消化,1 000 r·min-1离心5 min,吸除FBS换入常规培养基,并用细头吸管反复吹打制成单细胞悬液。细胞计数后接种于预先已包被PLL和LN的35 mm细胞培养皿内,37 ℃、5% CO2条件下培养,每周换液2次。
TRPV1异源表达体系的建立[7,8]HEK293细 胞转染前24 h,用0.125% 胰酶消化对数生长期的HEK293细胞,用无双抗的DMEM培养基吹打细胞成悬液,以细胞数6×105/mL铺于6孔板中培养。将旧培养基弃去,在各孔中加入2 mL新鲜DMEM培 养基培养; 在1.5 mL的EP管中加入无血清无双抗的DMEM培养基500 µL,然后加入质粒38 µL; 在另 一个EP管中加入DMEM培养基500 µL,然后加入EndoFectinTM-Plus转染试剂45 µL,室温孵育5 min; 将稀释好的质粒和EndoFectinTM-Plus混合,制成转染复合物,室温孵育20 min取出,将转染复合物加 入板中,培养3 h后,添加含30% DMEM生长培养基,FBS终浓度为10%; 转染24 h后,换上新鲜培养基,继续培养48 h后,将细胞按1∶5稀释比例传代; 培养24 h后,加G418筛选,10天后,挑取状态良好的细胞集落至24孔板培养,改用G418维持浓度培养; 细胞长满后,铺于96孔板,继续筛选; 96孔板的细胞培养1周后,选择生长良好的抗性克隆再次稀释筛选,将筛选出的抗性克隆进行扩增或冻存。
共聚焦显微成像法观察TRPV1通道的激活作用按照本室建立的常规方法[9, 10]。DRG神经细胞漂洗3次后,放在激光共聚焦显微镜载物台上,选定荧光显色好的细胞视野,再用氩离子激光预扫描,设置条件: 激光波长488 nm,发射波长516 nm; 扫描方式xyt (时间扫描); 扫描密度: 512×512 (分辨率); 物镜倍数: 40; 电子放大倍数 (zoom): 1; 激光功率: 1.4%; 时间间隔: 5 s。再根据预扫描的结果选取最清晰的焦平面进行扫描,对细胞进行动态观察,同步记录背景荧光值。细胞内Ca2+ 浓度变化以荧光强度值表示,此数值与细胞 [Ca2+]i变化成正相关。胞内Ca2+ 浓度变化程度 (Δ[Ca2+]i) 以给药前后荧光强度变化值 (F) 与给药前荧光强度值 (F0) 的百分比值来表示,即: Δ[Ca2+]i = (F - F0) / F0× 100%。测定前,先用PBS冲洗3次,然后加入终浓度为5 μmol·L-1 Fluo-4 AM荧光染料 (含0.1% F-127),在25 ℃避光负载30 min,冲洗3次,以除去多余的染料,再换入Hanks缓冲体系中,分别加入终浓度为1 μmol·L-1辣椒素进行胞内Ca2+ 浓度检测。
热偶检测仪分析小鼠机体能量代谢变化适应1周后的小鼠禁食2 h,用乌拉坦麻醉 (1.4 g·kg-1体重)。将检测仪中一个探头放置在小鼠尾根部用以检 测尾部皮肤温度; 小鼠专用探头插入肛门2 cm用以检测小鼠机体深部的核心温度 (core body temperature); 另一探头放在小鼠背部肩胛之间检测棕色脂肪组织 (BAT) 的产热。在测试过程中,动物放置在固定的加热毯上维持机体温度的相对恒定,并使环境温度保持在30 ℃~32 ℃。选取给药前肛温在36 ℃~37 ℃的小鼠用于实验。辣椒素用含80% 盐水、10% Tween 80和10% 乙醇的溶液溶解后,按照1.5 mg·kg-1剂量,皮下注射给药; 另设溶液 (含80% 盐水、10% Tween 80和10% 乙醇) 对照。每只动物在给药前测试30 min。
统计学方法 实验数据以x± s表示,用SPSS 19.0软件统计分析,多组间比较采用单因素方差分析 (one-way ANOVA),两组间比较采用t检验,P < 0.05差异具有统计学意义。
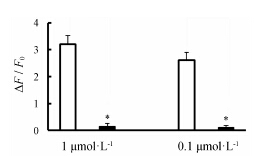
结果 1 辣椒素对DRG神经元中原位TRPV1通道的影响DRG神经元体外培养4天后,镜下可见神经元神经突起和圆形光滑的胞体,胞内可见较大的细胞核和明显的核仁,细胞密度低的区域尚可见细胞的神经突出较长,表明DRG神经元状态良好,适于进一步的通道功能实验研究。辣椒素 (1或0.1 μmol·L-1) 加入含有DRG神经元的培养皿中,共聚焦显微镜下可见胞内荧光强度明显增强,在20 s左右达到最高峰,然后开始下降,约2 min左右回到加药前的基线点。另一组中,在给予辣椒素前加入TRPV1通道阻断剂辣椒平,则可见DRG神经元胞内荧光强度的变化幅度明显减小 (P < 0.01)。结果提示,辣椒素能够激活TRPV1通道,进而引起胞内钙离子浓度的增高 (图 1、2)。

|
Figure 1 Changes of intracellular fluorescence observed under confocal laser scanning microscope after activation of TRPV1 channels with capsaicin. A: Resting state of HEK293 cells before drug administration; B: Evoked intracellular fluorescence increase after drug administration; C: Intracellular fluorescence back to the rest state gradually |
|
Figure 2 Activation of TRPV1 channel on dorsal root ganglion (DRG) neurons by capsaicin. □: Capsaicin-evoked increased ratio of intracellular fluorescence (control). ■: Capsaicin- evoked increased ratio of intracellular fluorescence of the DRG neurons pretreated with capsazepine before drug administration. n = 6,x± s. P < 0.01 vs control group |
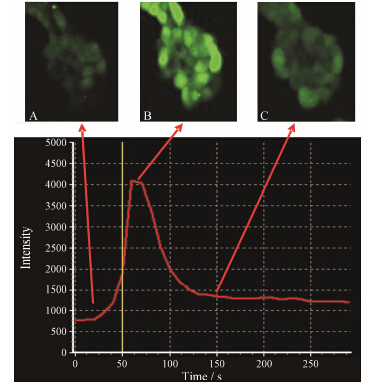
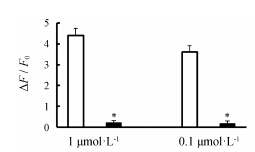
转染后的HEK293细胞,加入G418作用10天后,镜下可见大部分未成功转染的细胞均已死亡,挑选转染成功的克隆,G418的浓度减半继续培养10天后进行实验。与DRG神经元类似,1 μmol·L-1辣椒素给药后,共聚焦显微镜下即可见HEK293细胞胞内荧光强度开始增强,约70 s后达到荧光强度的最高点,然后开始下降,给药后150 s左右回到给药前的基线状态。对照组中没有转染TRPV1基因的HEK293细胞受到辣椒素刺激后,胞内的荧光强度未见明显变化。结果表明,辣椒素能够特异性激活TRPV1通道,并通过胞内钙信号的变化启动特定的生物学效应 (图 3、4)。
|
Figure 3 Changes in intracellular fluorescence after activation of TRPV1 channels with capsaicin. A: Resting state of HEK293 cells before drug administration; B: Increased intracellular fluorescence after drug administration; C: Intracellular fluorescence back to the resting state after drug administration |
|
Figure 4 Activation of TRPV1 channels on HEK293 cells by capsaicin. □: Capsaicin-evoked increased ratio of intracellular fluorescence of the TRPV1-transfected HEK 293 cells (control). ■: Capsaicin-evoked increased ratio of intracellular fluorescence of the non-transfected HEK 293 cells. n = 6,x± s. P < 0.01 vs control group |
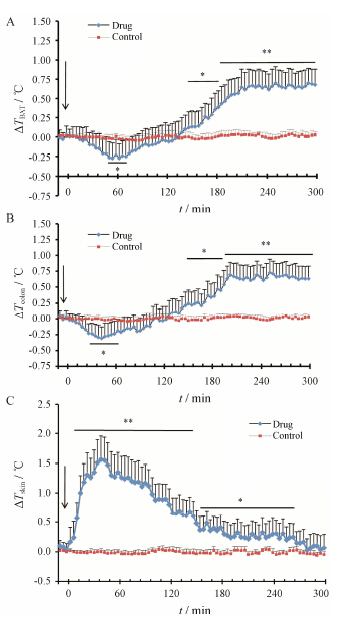
辣椒素皮下注射后,小鼠的肩胛间区BAT温度 (TBAT) 和肛温 (Tcolon) 即开始下降,约在48 min时与溶剂对照组相比有显著性差异 (P < 0.05),至60 min左右时下降至最低点,然后开始上升,约145 min时,与溶剂对照组有显著性差异 (P < 0.05 或P < 0.01); 给药后120 min时回到基线温度,并在给药后约200 min时达到温度的最高点,一直稳定至记录结束时 (给药后300 min); 小鼠尾部的皮肤温度 (Tskin) 给药后开始上升,给药5 min后与溶剂对照组相比差异显著 (P < 0.05或P < 0.01),约35 min后达到温度的最高点,然后开始下降,并逐渐回到基线温度。溶剂对照注射后,温度未见明显变化 (图 5)。
|
Figure 5 Changes of temperature of mouse brown adipose tissue (BAT) (TBAT,A),mouse colon (Tcolon,B) and mouse tail skin (Tskin,C) after administration of capsaicin. The arrowhead indicates the time of administration of capsaicin. P < 0.05,**P < 0.01 vs control group (n = 6,x± s) |
2009年文献[11,12]报道BAT对成人机体热能的产生起着关键的调节作用,颠覆了以往“BAT只在哺乳动物和人类婴幼儿时期存在”的普遍认识。TBAT是机体非颤栗性产热的一个主要评价指标,Tcolon代表机体的中心温度,Tskin是机体热扩散的观察指标。本研究结果显示,辣椒素进入体内后小鼠TBAT和Tcolon先有小幅下降,而Tskin升高,提示小鼠体温的下降可能是由于机体散热的增加或散热占优所致; 随后小鼠TBAT和Tcolon开始升高,表明此时机体的产热和散热相比占有优势,而且小鼠体温的升高幅度和持续时间显著大于小鼠体温的下降,结果进一步表明: 在测试时间内辣椒素给药后主要增加了小鼠的产热过程和产热量。作者对此热学变化现象进行了重复性验证,结果基本一致。可见小鼠机体特定部位的热学信号的变化与辣椒素影响机体能量代谢之间存在着规律性的联系。这种关联性和关联特征能够通过同步检测分析小动物肩胛区棕色脂肪组织、尾根背侧以及直肠 (三位一体) 的热学信号的变化得以体现。该方法操作简单、灵敏、重现性好,能够客观反映中药对机体能量代谢的影响,适于中药寒热属性和寒热程度的评价和描述。
TRPs是近年来发现存在于细胞膜或胞内细胞器膜上的一类非选择性阳离子通道,其编码的蛋白质广泛分布于包括人类在内的哺乳动物不同组织中[13]。在TRP通道家族中,现已发现至少6个家族成员 (TRPV1、TRPV2、TRPV3、TRPV4、TRPM8和TRPA1) 与机体的寒热感知有关,这些通道蛋白在感觉神经上均呈多量表达。其中,TRPV1通道是这些通道中功能研究最为清楚的成员之一,可被热 ( > 43 ℃) 或其他内源性和外源性化学物质激活,将寒热的生物学信息传递到中枢,调节着机体的产热和散热过程[14,15]。在本研究离体实验中,辣椒素能够激活TRPV1通道,在原代细胞体系中TRPV1通道选择性阻断剂辣椒平能够有效抑制辣椒素对该通道的激活作用,在TRPV1异源性表达体系HEK293细胞中,TRPV1表达阴性的对照细胞对辣椒素的刺激未见明显反应。这些实验现象表明: 除TRPV1通道外,辣椒素可能不存在明显的靶外效应,即激活TRPV1通道可能是辣椒素作用于DRG神经元执行特定的生物学效应的唯一靶点。结合整体的动物实验研究结果,似能得出如下结论: 辣椒所含的活性成分通过激活TRPV1通道进而增加机体BAT的产热量是辣椒表征辛热 (温) 药性的生物学基础。
毋庸置疑,药性的客观物质基础是中药中所含的化学活性成分。多数情况下,不止一种成分参与中药的“四性”或“五味”属性的生物学表征。“四性”成分和“五味”成分的组成可以是相互独立的不同类别,亦可有部分共有组分,甚至活性成分完全一致。传统中医学认为: “入口则知味,入腹则知性”。辣椒的辛味源于其口服后所含的辣味成分——辣椒素激活了口腔黏膜中外周感觉神经的TRPV1通道 (辣椒素受体) 所获得的味觉感知。本次研究中发现,辣椒作为一种药性特征明显的药食两用植物,其辛味的化学物质基础——辣椒素,亦是其热性属性的主要活性成分,二者具有一定的物质统一性。此现象在中药中可能具有一定普适性,如辛味中药大多具有温热药性,而苦味中药则多具有寒凉药性,其客观实质可能与其表征“性”与“味”的化学物质属于同一类别或是相同的化学成分有关。
总之,本研究基于寒热感受环节的关键节点—— TRP通道蛋白,搭建了通道后的能量代谢生物效应评价的热偶检测平台,并以药性特征突出、药效明确和药食兼用的辣椒为例,在科研实证的基础上,提出了激活TRPV1通道 (辛热感受) ——产生热能 (生物效应),应是辛热 (温) 中药药性输入和药性表征的一种基本模式,是具有辛热 (温) 药性的温里中药所起到的温中散寒、温里止痛作用的客观基础之一,本研究为中药药性的科学诠释提供了一种新的研究思路和研究领域,亦为中药药性的客观评价提供了新的技术和方法学基础。
| [1] | Sui F, Jiang TL. Exploration of the scientific significance of the four natures of the Chinese herbs based on the thermosensory TRP channels [J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 2501-2504. |
| [2] | Sui F, Zhang CB, Du XL, et al. Effects of the ingredients from the Chinese herbs with hot or cold natures on the function of TRPV1 channels [J]. Pharm Clin Chin Mater Med (中药药理与临床), 2009, 25: 18-20. |
| [3] | Chinese Pharmcopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) Part 1. [S]. 2010 Ed. Beijing: China Medical Science Press, 2010. |
| [4] | The Pharmacopeia of the United States of America (USP) [S]. 24th ed, New York: USP. |
| [5] | The Pharmacopeia of the United States of America (USP) [S]. 25th ed, New York: USP. |
| [6] | Sui F, Du XL, Zhang CB, et al. A novel way to culture primary rat DRG neurons [J]. Chin Pharmacol Bull (中国药理学通报), 2009, 25: 971-973. |
| [7] | Liao M, Cao E, Julius D. Structure of the TRPV1 ion channel determined by electron cryo-microscopy [J]. Nature, 2013, 504: 107-112. |
| [8] | Alpizar YA, Sanchez A, Radwan A, et al. Lack of correlation between the amplitudes of TRP channel-mediated responses to weak and strong stimuli in intracellular Ca2+ imaging experiments [J]. Cell Calcium, 2013, 54: 362-374. |
| [9] | Sui F, Zhang CB, Yang N, et al. Anti-nociceptive mechanism of baicalin involved in intervention of TRPV1 in DRG neurons in vitro [J]. J Ethnopharmacol, 2010, 129: 361-366. |
| [10] | Sui F, Lin N, Guo JY, et al. Cinnamaldehyde up-regulates the mRNA expression level of TRPV1 receptor potential ion channel protein and its function in primary rat DRG neurons in vitro [J]. J Asian Nat Prod Res, 2009, 12: 76-87. |
| [11] | Virtanen KA, Lidell ME, Orava J, et al. Functional brown adipose tissue in healthy adults [J]. N Engl J Med, 2009, 360: 1518-1525. |
| [12] | van Marken Lichtenbelt WD, Vanhommerig JW, Smulders NM, et al. Cold-activated brown adipose tissue in healthy men [J]. N Engl J Med, 2009, 360: 1500-1508. |
| [13] | Pan Z, Yang H, Reinach PS. Transient receptor potential (TRP) gene superfamily encoding cation channels [J]. Hum Genomics, 2011, 5: 108-116. |
| [14] | Vay L, Gu C, McNaughton PA. The thermo-TRP ion channel family: properties and therapeutic implications [J]. Br J Pharmacol, 2012, 165: 787-801. |
| [15] | Marics I, Malapert P, Reynders A, et al. Acute heat-evoked temperature sensation is impaired but not abolished in mice lacking TRPV1 and TRPV3 channels [J]. PLoS One, 2014, 9: e99828. |
 2015, Vol. 50
2015, Vol. 50


