2. 河北医科大学 基础医学院, 河北 石家庄 050017
2. School of Basic Medical Sciences, Hebei Medical University, Shijiazhuang 050017, China
肺动脉血管平滑肌细胞 (PASMCs) 位于血管中膜,其异常增殖是肺血管构型重建的关键环节[1,2],也是肺动脉高压的病理特征之一。病理条件下,各种恶性刺激因素如缺氧、炎性介质及各类生长因子等 均参与肺血管重建,5-羟色胺 (5-HT) 是其中较为重要的一种。5-HT作为重要的血管活性物质,与相应受体结合后可依次激活小GTPase结合蛋白、Rac-1、NADPH氧化酶以及细胞外信号调节激酶ERK1/2等,调节PASMCs的增殖与凋亡,诱导肺动脉高压[3]。有研究表明,小GTPase RhoA及其作用底物Rho激酶(ROCK) 在细胞增殖及周期变化中发挥重要作用[4]。作者前期研究[5]也表明ROCK参与了5-HT诱导的大鼠PASMCs增殖。ROCK是一种丝氨酸/苏氨酸蛋白激酶,RhoA激活后活化ROCK,并进一步磷酸化其下游底物肌球蛋白磷酸酶目标亚单位1 (MYPT1),从而调节细胞许多生物学功能,在肺血管重建中起重要作用。
既然RhoA/ROCK在细胞增殖中发挥重要作用,那么RhoA是如何被激活的呢?经典途径认为一些受体激动剂通过激活G12/13蛋白偶联受体可以将RhoA活化,进一步激活ROCK。研究[6]表明,一些受体激动剂诱导的RhoA激活在很大程度上依赖于胞浆Ca2+浓度及钙调蛋白 (CaM),提出在血管平滑肌Gq蛋白及它的下游信号分子Ca2+ 和蛋白激酶C诱导了RhoA的激活。另有研究[7]表明,在血管平滑肌,高浓度的Ca2+ (30 μmol·L-1) 明显诱导RhoA向膜移位。间尼索地平(m-Nis) 是我校药学院合成的二氢吡啶类钙拮抗剂,前期研究[8]发现其对野百合碱诱导的大鼠肺动脉高压有一定的保护作用,还明显抑制了5-HT诱导的大鼠PASMCs增殖。那么,这种抑制作用是否与抑制Rho/ROCK通路有关?因此,本实验观察了Rho/ ROCK通路在5-HT诱导的PASMCs增殖中的变化及m-Nis对此的影响,深入探讨其抗PASMCs增殖的作用机制。
材料与方法
实验材料 原代培养的大鼠PASMCs,Wistar大鼠由河北医科大学实验动物中心提供 (合格证号: No.711047)。DMEM/F12培养基和胎牛血清购自美 国GIBCO公司。m-Nis由河北医科大学药学院提供。MTT购自德国Serva公司。胰蛋白酶购自Amersco公司。5-HT购自美国Sigma公司。BCA蛋白定量试剂盒购自美国PIERCE公司。MYPT1和p-MYPT1抗体购自美国Upstate公司。RhoA、ROCK1及β-actin PCR反应引物由上海捷瑞生物工程公司合成。其他试剂均为国产分析纯。
PASMCs培养与鉴定采用组织贴块法原代培养大鼠PASMCs[7]: 取体重180 g左右的Wistar雄性 大鼠,麻醉后无菌取出心肺,于冷D-Hanks中迅速分离肺动脉主干及左右肺动脉,剥除外膜及内皮,将剩余的中膜剪成0.5 mm × 1 mm的小块,均匀分布于培养瓶底部,加入含20% 胎牛血清的DMEM-F12培养液,置于37 ℃、CO2培养箱中静置培养。当大部分组织块长出细胞晕,去除组织块,用0.125% 胰蛋白酶 + 0.01% EDTA消化分散细胞,传代培养。3~6代细胞用于后续实验。细胞培养过程中,在倒置显微镜下对细胞形态进行观察,并采用α-actin免疫细胞化学染色法对PASMCs进行鉴定。
细胞处理选择第3~6代生长良好的PASMCs,消化并制备细胞悬液,接种于培养板或培养瓶中,用含10% 胎牛血清的DMEM-F12培养液培养1或2天至细胞融合达80%左右时,换低浓度 (0.1%) 胎牛血清培养液培养24 h,使细胞生长同步化。然后根据不同实验随机分组。
MTT法检测PASMCs增殖取对数生长期的PASMCs,制备细胞悬液并计数,以每毫升2×104个 细胞数接种于96孔板中,每孔200 μL,培养24 h使细胞贴壁。在5-HT作用不同时间对PASMCs影响的实验中,将同步化的细胞随机分为5-HT (1 μmol·L-1) 处理0、6、12、24、48和72 h组; 在观察m-Nis对5-HT诱导的PASMCs增殖的影响实验中,将同步化的细胞随机分为对照组、5-HT (1 μmol·L-1) 处理24 h组、m-Nis (1×10-5、1×10-6、1×10-7和1×10-8 mol·L-1) 预处理组 (同步化的细胞先加入不同浓度的m-Nis预处理,20 min后加入终浓度为1 μmol·L-1的5-HT处理细胞24 h)。每组设6个平行孔。各组处理时间结束后,每孔加入MTT溶液 (5 g·L-1) 20 μL,置培养 箱中继续培养4 h,吸弃各孔上清液,每孔加入二甲基亚砜 (DMSO) 200 μL溶解紫色结晶,室温振荡 10 min,置自动酶标仪上于490 nm波长条件下测定各孔吸光度值。
RT-PCR检测RhoA和ROCK1 mRNA表达取培养瓶中生长良好的PASMCs同步化处理后,随机分为5-HT (1 μmol·L-1) 处理0、5、15、30、60、120和180 min组; 在观察m-Nis对5-HT诱导的RhoA和ROCK1 mRNA表达的影响时,将同步化的细胞随机分为对照组、5-HT (1 μmol·L-1) 处理30 min组、m-Nis (1×10-5、1×10-6、1×10-7和1×10-8 mol·L-1) 预处理组
(同步化的细胞先加入不同浓度的m-Nis预处理,20 min后加入终浓度为1 μmol·L-1的5-HT处理细胞 30 min)。各组细胞在5-HT作用结束后消化分离,按照总RNA提取试剂盒和反转录试剂盒操作步骤提取纯化RNA,并反转录成cDNA,进行PCR反应。反应引物如表 1所示,扩增条件: 95 ℃预变性5 min,94 ℃变性40 s,53 ℃退火40 s,72 ℃延伸90 s,72 ℃延伸10 min,共35个循环。实验重复3次。扩增产物进行15 g·L-1琼脂糖电泳,Gold view显色,紫外透射反射仪观察扩增产物条带的大小及亮度,凝胶成像系统拍照,Bio1D软件进行图象分析,测定产物条带的灰度值,计算目标产物与β-actin的比值,作为各扩增产物mRNA的相对表达量。
|
|
Table 1 Primers used for PCR analysis |
取培养瓶中生长良好的PASMCs同步化处理后,随机分为5-HT (1 μmol·L-1) 处理0、5、15、30、60、120和180 min组; 在观察m-Nis对5-HT诱导的MYPT1磷酸化水平的影响时,将同步化的细胞随机分为对照组、5-HT (1 μmol·L-1) 处理15 min组、m-Nis (1×10-5、1×10-6、1×10-7和1×10-8 mol·L-1) 预处理组 (先加入不同浓度的m-Nis预处理,20 min后加入终浓度为 1 μmol·L-1的5-HT处理细胞15 min)。各组经5-HT刺激后,收集细胞,RIPA液裂解细胞,超声2 min,冰上放置1 h,使细胞充分裂解,BCA法蛋白定量。等 量蛋白 (60 μg) 上样,SDS聚丙烯酰胺凝胶电泳分 离,电转至PVDF膜上 (4 ℃,2 h),室温下含50 g·L-1脱脂奶粉的TBST封闭1 h,加入一抗 (MYPT1、p-MYPT1 1∶200稀释),4 ℃过夜,次日TBST洗膜3次,每次10 min,然后加入相应辣根过氧化物酶标记的二抗 (1∶5 000稀释),37 ℃,1 h。TBST洗膜3次,Odyssey 9120双色红外激光成像系统扫描PVDF膜并成像。MYPT1的磷酸化水平用p-MYPT1/MYPT1来表示。
统计方法采用Adobe Photoshop软件进行图像处理; SPSS 15.0,Origin 7.5软件进行数据统计分析及作图。实验数据以x±s表示,多组比较采用方差分 析,如方差齐,采用Dunnet t检验进行组间比较; 如方差不齐,采用秩和检验,以P < 0.05为有统计学差异。
结果1 m-Nis抑制5-HT诱导的大鼠PASMCs增殖
1 μmol·L-1 5-HT作用不同时间对大鼠PASMCs增殖的影响结果如图 1A所示,5-HT作用12 h即明 显诱导大鼠PASMCs增殖(P < 0.05),随着作用时间的延长,在5-HT作用24、48和72 h时,细胞增殖与0 h相比均明显增加 (P < 0.01)。不同浓度m-Nis预处理对5-HT诱导的PASMCs增殖的影响结果如图 1B所示,不同浓度m-Nis均明显抑制了5-HT作用24 h诱导的大鼠PASMCs增殖(P < 0.05或P < 0.01),且呈现一定的浓度依赖性。

|
Figure 1 Effects of m-Nis on 5-HT-induced proliferation of rat PASMCs evaluated by MTT assay. n = 3,x± s. A: The changes of rat PASMCs proliferation after 5-HT (1 μmol·L-1) treatment for indicated durations. P < 0.05,**P < 0.01 vs control group (5-HT 0 h). B: Effects of m-Nis on 5-HT-induced proliferation of rat PASMCs. ##P < 0.01 vs control group; P < 0.05,**P < 0.01 vs 5-HT group |
RT-PCR结果如图 2所示,与对照组 (5-HT 0 min) 相比,1 μmol·L-1 5-HT作用5 min即明显诱导大鼠PASMCs中RhoA (P < 0.01) 和ROCK1 (P < 0.05) mRNA表达,随着作用时间的延长,二者mRNA的表达逐渐升高,在5-HT作用30 min时表达均达最高水平 (P < 0.01)。随后,RhoA和ROCK1 mRNA的表达虽有不同程度的下降,但直到180 min仍显著高于对照组 (P < 0.05或P < 0.01)。
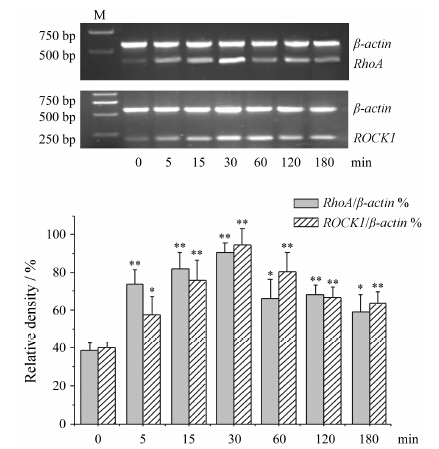
|
Figure 2 Effects of 5-HT on the mRNA expression of RhoA and ROCK1 in rat PASMCs. Growth-arrested PASMCs were stimulated by 5-HT (1 μmol·L-1) for indicated durations,then the mRNA expression of RhoA and ROCK1 were detected by RT-PCR. Intensity of RhoA and ROCK1 were standardized to that of β-actin separately. M: Marker. n = 3,x± s. *P < 0.05,**P < 0.01 vs control group (5-HT 0 min) |
不同浓度m-Nis预处理对5-HT作用30 min诱 导的PASMCs中RhoA和ROCK1 mRNA表达的影响,结果如图 3所示,与对照组相比,5-HT作用30 min明显诱导了大鼠PASMCs中RhoA和ROCK1 mRNA表达增加 (P < 0.01),m-Nis (1×10-5、1×10-6和1×10-7 mol·L-1) 预处理,不同程度地降低了5-HT诱导的RhoA和ROCK1 mRNA表达升高 (P < 0.05或P < 0.01),1×10-8 mol·L-1 m-Nis还明显降低ROCK1 mRNA的表达 (P < 0.05)。

|
Figure 3 Effects of m-Nis on 5-HT-induced mRNA expression of RhoA and ROCK1 in rat PASMCs. Growth-arrested PASMCs were preincubated with m-Nis for 20 min,followed by stimulation with 5-HT (1 μmol·L-1) for 30 min. Intensities of RhoA and ROCK1 were standardized to that of β-actin separately. n = 3,x± s. ##P < 0.01 vs control group; P < 0.05,**P < 0.01 vs 5-HT group |
活化状态的ROCK会进一步磷酸化其下游底物MYPT1,故MYPT1磷酸化水平的高低反映了ROCK的活化程度。采用Western blot方法检测PASMCs中p-MYPT1的表达随5-HT作用时间的变化以及m-Nis对此的干预作用,结果显示,1 μmol·L-1 5-HT在作用5 min即明显诱导了大鼠PASMCs中p-MYPT1的表达 (P < 0.05),且在15 min时MYPT1磷酸化水平达到最高 (P < 0.01)。随后,p-MYPT1的表达有不同程度地下降,但直到180 min仍显著高于对照组 (5-HT 0 min) (P < 0.05,图 4A)。而m-Nis (1×10-5、1×10-6和1×10-7 mol·L-1) 预处理均不同程度地抑制了5-HT诱导的p-MYPT1表达水平 (P < 0.05或P < 0.01,图 4B)。
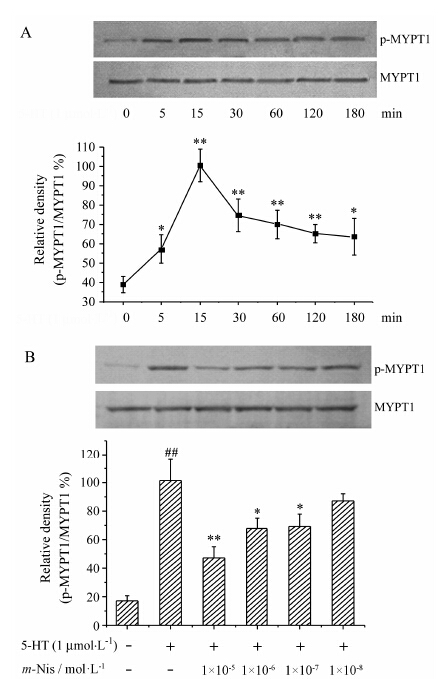
|
Figure 4 Effects of m-Nis on 5-HT-induced ROCK activation as measured by p-MYPT1 expression. A: Growth-arrested PASMCs were stimulated by 5-HT (1 μmol·L-1) for indicated durations. B: m-Nis reduced 5-HT-induced p-MYPT1 expression. Growth- arrested PASMCs were preincubated with m-Nis for 20 min,and then stimulated with 5-HT for 15 min. The extent of ROCK activation was quantified by density of p-MYPT1/MYPT1. n = 3,x± s. ##P < 0.01 vs control group; *P < 0.05,**P < 0.01 vs 5-HT group |
PASMCs既是肺血管收缩的效应细胞,也是增殖和迁移引起肺血管构型重建的细胞基础。5-HT作为一种重要的血管活性物质,不仅刺激PASMCs收缩,造成其增生和肥大,还能与多种细胞生长因子发生协同作用。而且,作者前期实验也表明在野百合碱诱导的肺动脉高压大鼠肺组织中有5-HT的阳性表达[8]。
研究[9]表明,5-HT与受体结合后,促使细胞内Ca2+ 浓度升高是触发细胞增殖相关信号转导的始动因素。由此推断,作为钙拮抗剂的m-Nis可能是通过抑制细胞内的游离Ca2+ 浓度的增高而抑制PASMCs增殖。本实验采用MTT法观察了m-Nis对5-HT诱导的大鼠PASMCs增殖的影响。结果表明,m-Nis明显抑制了5-HT诱导的大鼠PASMCs增殖。但详细机制仍需进一步探讨。近年来研究发现,ROCK在血管紧张素Ⅱ (Ang- Ⅱ)、5-HT等诱导的血管平滑肌细胞增殖中发挥重要作用[10,11]。然而,5-HT诱导的大鼠PASMCs增殖过程中RhoA/ROCK的激活及活化机制还未完全阐明。有研究[4]表明,RhoA的激活在很大程度上依赖于胞浆Ca2+ 浓度及钙调蛋白,在血管平滑肌Gq蛋白及其
下游信号分子Ca2+ 和蛋白激酶C诱导了RhoA的激活。因此,本实验观察了m-Nis对RhoA/ROCK通路的影响。结果发现,作为二氢吡啶类钙拮抗剂,m-Nis明显降低了5-HT诱导的RhoA和ROCK1 mRNA的表达,说明m-Nis对RhoA/ROCK通路有一定抑制作用。那么,m-Nis抗5-HT诱导的PASMCs增殖作用是否与抑制RhoA/ROCK通路有关?关于此问题,作者[12]曾观察了Rho激酶抑制剂法舒地尔对5-HT诱导的PASMCs增殖的作用。结果表明,法舒地尔浓度 依赖性地抑制了5-HT诱导的PASMCs的增殖,也降低了PCNA的蛋白表达。综合这些结果,说明RhoA/ ROCK通路在5-HT诱导的PASMCs增殖中发挥重要作用,m-Nis抗5-HT诱导的PASMCs增殖作用与抑制RhoA/ROCK通路有关。
RhoA是Ras单体GTP酶超家族的一员,能结合并水解鸟苷酸,使其在活性型 (GTP结合) 与失活型 (GDP结合) 之间循环。ROCK属于丝氨酸/苏氨酸蛋白激酶家族成员,是RhoA的下游靶效应分子。ROCK活化后,进一步磷酸化其下游底物肌球蛋白磷酸酶目标亚单位1 (MYPT1),使其失活,失活的肌球蛋白磷酸酶不能将肌球蛋白轻链 (MLC) 脱磷酸化,使得细胞浆内磷酸化MLC水平提升,肌动-肌球蛋白交联增加,从而促进肌动蛋白微丝骨架的聚合,影响细胞的收缩、黏附、增殖、凋亡、迁移等生物学行为和功能[13],因此,p-MYPT1的表达水平代表了ROCK的活化程度。本实验中,5-HT不仅明显诱导了RhoA和ROCK1 mRNA的表达,还明显提高了MYPT1的磷酸化水平,诱导了ROCK的活化,而不同浓度的m-Nis不同程度地降低了5-HT诱导的MYPT1的磷酸化水平,抑制了ROCK的活化。进一步说明RhoA/ ROCK通路在5-HT诱导的PASMCs增殖中发挥重要作用,m-Nis抗5-HT诱导的PASMCs增殖的作用与抑制RhoA/ROCK通路有关。
| [1] | Suzuki YJ, Day RM, Tan CC, et al. Activation of GATA-4 by serotonin in pulmonary artery smooth muscle cells [J]. J Biol Chem, 2003, 278: 17525-17531. |
| [2] | Wang CC, Gurevich I, Draznin B. Insulin affects vascular smooth muscle cell phenotype and migration via distinct signaling pathways [J]. Diabetes, 2003, 52: 2562-2569. |
| [3] | Lee SL, Simon AR, Wang WW, et al. H2O2 signals 5-HT-induced ERK MAP kinase activation and mitogenesis of smooth muscle cells [J]. Am J Physiol Lung Cell Mol Physiol, 2001, 281: L646-L652. |
| [4] | Brown JH, Del Re DP, Sussman MA. The Rac and Rho hall of fame: a decade of hypertrophic signaling hits [J]. Circ Res, 2006, 98: 730-742. |
| [5] | Chen XY, Liu HL, Pan ZH, et al. Rho/ROCK signal pathway in 5-HT-induced proliferation of rat pulmonary artery smooth muscle cells [J]. Chin J Cell Biol (细胞生物学杂志), 2009, 31: 853-858. |
| [6] | Sakurada S, Takuwa N, Sugimoto N, et al. Ca2+-dependent activation of Rho and Rho kinase in membrane depolarization-induced and receptor stimulation-induced vascular smooth muscle contraction [J]. Circ Res, 2003, 93: 548-556. |
| [7] | Gong MC, Fujihara H, Somlyo AV, et al. Translocation of RhoA associated with Ca2+ sensitization of smooth muscle [J]. J Biol Chem, 1997, 272: 10704-10709. |
| [8] | Chen XY, Zhang W, Miao QF, et al. m-Nisoldipine attenuates monocrotaline-induced pulmonary hypertension by suppressing 5-HT/ERK MAPK pathway [J]. Acta Pharm Sin (药学学报), 2008, 43: 1011-1018. |
| [9] | Mukai K, Matsushima H, Ishii Y, et al. Effects of calcium on lens epithelial cells in rabbits [J]. Nippon Ganka Gakkai Zasshi, 2006, 110: 361-369. |
| [10] | Liu Y, Suzuki YJ, Day RM, et al. Rho kinase-induced nuclear translocation of ERK1/ERK2 in smooth muscle cell mitogenesis caused by serotonin [J]. Circ Res, 2004, 95: 579-586. |
| [11] | Ohtsu H, Mifune M, Frank GD, et al. Signal-crosstalk between Rho/ROCK and c-Jun NH2-terminal kinase mediates migration of vascular smooth muscle cells stimulated by angiotensin II [J]. Arterioscler Thromb Vasc Biol, 2005, 25: 1831-1836. |
| [12] | Chen XY, Dun JN, Miao QF, et al. Fasudil hydrochloride hydrate, a Rho-kinase inhibitor, suppresses 5-hydroxytryptamine-induced pulmonary artery smooth muscle cell proliferation via JNK and ERK1/2 pathway [J]. Pharmacology, 2009, 83: 67-79. |
| [13] | Ito M, Nakano T, Erdodi F, et al. Myosin phosphatase: structure, regulation and function [J]. Mol Cell Biochem, 2004, 259: 197-209. |
 2015, Vol. 50
2015, Vol. 50


