由于抗体具有高特异性、高亲和力,在人体免疫体系中起重要作用,广泛用于药物开发,同时,治疗性抗体的市场潜力巨大。2013年,单克隆抗体药物全球销售收入接近750亿美元,其中销售额超过50亿美元的治疗性抗体药物有: 阿达木单抗 (adalimumab,Humira®) 106亿美元、英夫利昔单抗 (infliximab,Remicade®) 89亿美元、依那西普 (etanercept,Enbrel®) 83亿美元、利妥昔单抗 (rituximab,Rituxan®) 75亿美元、贝伐单抗 (bevacizumab,Avastin®) 67亿美元、曲妥珠单抗 (trastuzumab,Herceptin®) 65亿美元。当前已批准的单克隆抗体药物销售额持续攀升,正在开发的候选单克隆抗体药物已超过了300种,这将继续推动生物药物产品销售额的增长[1]。
治疗性抗体可通过多种方式发挥它们的功能,包括靶标调控、中和可溶性靶标 (如细胞因子)、破坏配体-受体互作以及影响细胞信号转导、与免疫效应功能衔接等,例如,抗体依赖的细胞毒作用 (ADCC) 和补体依赖的细胞毒作用 (CDC)。治疗性抗体的作用机制有力地影响着它的临床应用及开发潜能[2]。
根据人抗体的重链恒定区进行分类,抗体类型可分为IgA、IgD、IgE、IgG和IgM等5种。其中,IgG可分为IgG1、IgG2、IgG3和IgG4等4种亚型,IgA可分为IgA1和IgA2两种亚型。但是,目前在抗体工程中基于实用性和功能上的考虑,使得现在临床使用的治疗性抗体均为IgG类型[3,4]。
1 抗体工程中的亚型选择
在人类血清所有免疫球蛋白中,IgG的血清半衰期最长。因此,目前开发的重组单克隆抗体均是以IgG为框架开发的。IgG有4种亚型,它们的恒定区序列高度同源[3]。人类IgG中各亚型的含量比例分别为: IgG1约60%、IgG2约25%、IgG3约10%、IgG4约5%。它们在宿主中的生物功能也各有侧重,IgG1和IgG3主要结合蛋白质抗原,IgG2结合糖类抗原,IgG4则响应慢性刺激并且具有抗炎的活性[4]。
此外,IgG的4种亚型中,触发效应功能的能力也明显不同,用于治疗用途的亚型则更需要小心选择。为达到期望的治疗效果并且避免不良反应,抗体亚型的选择首先由所需的效应功能决定[3]。对于不同的IgG类型,效应功能与其和Fc受体的亲和力相关,IgG1 > IgG3 > IgG4 > IgG2[5]。IgG1和IgG3与IgG2和IgG4相比,具有更强的激活抗体依赖的细胞毒性以及补体依赖的细胞毒性的能力[3,4,6]。假如需要效应功能消除靶点 (如在肿瘤学应用中的摧毁肿瘤细胞),则应使用IgG1或IgG3[3]。然而,在实践中,IgG3亚型未被用作治疗候选,主要是由于其相对较长的铰链区使得它对蛋白水解作用敏感,它的半衰期比其他亚型短的缘故[3,4]。而在中和性抗体中效应功能不是该类抗体药物的必需,如果使用IgG1亚型则在特殊情况下有触发效应功能的可能,从而引起细胞因子风暴这样的潜在风险。此时有两种方案可供选择,一种是更换抗体亚型为IgG2、IgG4或两者混合构建的抗体框架,一种是进行抗体框架的突变。由于人们对IgG各亚型框架功能研究比抗体框架突变更透彻一些,因而根据抗体药物的适应证选择合适的抗体亚型,似乎是更为简便的开发策略[3,4,6]。
大部分目前已批准的治疗性抗体属于IgG1亚型,仅有少数几个IgG2和IgG4抗体进入市场[7]。然而,由于IgG2和IgG4亚型的阻碍或抑制功能,它们已越来越多地用于开发治疗性抗体[4]。因此,在治疗性抗体的开发中,考虑抗体亚型的选择显得越来越重要[3,4]。
1.1 IgG框架对单克隆抗体理化性质的影响P epinsky等[8] 采用抗体亚型转换、互补决定区残基的靶向突变、以及糖基化位点插入突变等3种策略,解决了抗LINGO-1单克隆抗体Li33的Fab改装入IgG1框架组成全抗体后溶解度偏低的问题。LINGO-1是一种在CNS中的神经元和少突细胞中选择性表达的表面糖蛋白。在不同IgG框架对Li33溶解度影响的研究中,他们将抗LINGO-1的Li33 Fab改造为3种不同IgG框架 (IgG1、IgG2和IgG4) 的全人源抗体,并在哺乳动物细胞中表达,同时均以野生型和无糖基化形式分别进行评估。此外,对于IgG2框架,V234A/ G237A突变是剔除FcRIIa结合的糖基化位点突变,作为一种备选结构同时进行评估。这7种Li33单克隆抗体中,最显著的特征是它们在4 ℃、20 mmol·L-1 NaH2PO4和150 mmol·L-1 NaCl (PBS) pH 7.0中的 溶解度有差异。所有3种非糖基化抗体的溶解度均很低,IgG1 agly和IgG4 agly均为0.3 mg·mL-1,IgG2 agly为0.2 mg·mL-1,当其浓度 > 0.3 mg·mL-1时单 克隆抗体均产生大量沉淀。3种野生型中,IgG1 wt的溶解度为0.9 mg·mL-1,IgG2 wt和IgG4 wt则分别为 > 50 mg·mL-1和 > 30 mg·mL-1,IgG2 wt单克隆抗体的溶解度超过IgG1 wt 50余倍。IgG2 V234A/G237A突变体在溶解度方面居中,为5.6 mg·mL-1。由此可见,IgG框架和糖基化程度共同影响Li33抗体的溶解度,以IgG框架的影响更为显著。作者认为,空间因素在其中可能起了重要作用,促进或限制蛋白质互作有可能导致自联[8]。
在抗体的物理化学性质中,均一性和稳定性是特别重要的问题,有可能会制约治疗性抗体的成功开发。因此,日本科学家对IgG亚型在抗体的构象和物理化学稳定性上变化的影响也进行了关注。Ito等[3]对3类 (嵌合、人源化以及人源的)、4种抗体使用排阻色谱法 (size-exclusion chromatography,SEC)、差示扫描量热法 (differential scanning calorimetry,DSC)、圆二色谱 (circular dichroism,CD) 以及用宝石橙 (SYPRO orange) 作为染色探针进行差示扫描荧光法 (differential scanning fluoroscopy,DSF) 分析,在热胁迫下分析它们的结构稳定性,而且每种抗体均分别使用3种亚型进行构建。该实验中所使用的每种抗体轻链和VH区的氨基酸序列是一致的,只是亚型不同 (IgG1、IgG2 或IgG2AAAS、IgG4或IgG4PE),也就是说,这些分子具有相同的可变区但是恒定区不同,此外它们的等电点范围在pH 8~9之间。其中,IgG2AAAS的IgG2重链含有可降低效应功能的氨基酸点突变。IgG4PE的IgG4重链含有可阻止IgG4半分子交换形成的氨基酸点突变[3]。他们的SEC和SDS-PAGE实验结果显示,所有抗体在pH 5.5时均非常稳定。在低pH条件下,IgG1与IgG2和IgG4相比,对非酶促蛋白质水解更敏感,因此更易降解。在低pH下IgG2和IgG4比IgG1更易形成聚体,聚体形成随pH降低而增加,聚体总量在pH 4.0~7.0的顺序为IgG1 < IgG2 < IgG4。结果与文献[9, 10, 11, 12, 13]报道一致。此外,评价抗体亚型改变的结构稳定性显示,每种亚型的Fc区控制该分子的物理化学性质。所有4种分子显示相同的结构稳定性趋势,顺序为IgG1 > IgG2 > IgG4。CH2区与各亚型抗体的结构稳定性和在酸性条件下的聚合趋势密切相关,与可变区关系不密切。此外,该实验使用4种方法成功地交叉验证了变换亚型在热胁迫下对抗体结构稳定性的影响。结果表明,可变区控制结构稳定性方面的变化,抗体的理化性质与亚型相关,与可变区无关。即使更换其他IgG的可变区,抗体的理化性质仍可因此而保留,有助于选择合适的亚型,特别是通过合理预测抗体在理化性质上的变化更换IgG亚型。同时,对于使用合适的亚型进行抗体设计,以及根据不同亚型的理化性质进行抗体生产都有很好的指导意义[3]。
以上实例表明,IgG框架能够影响抗体的理化性质,在抗体药物开发中需要考虑框架的性质,并根据需要进行选择。关于抗体开发研究、开发的思路及方法对于其他抗体或者蛋白质具有启发和指导作用,并可较容易地应用到其他抗体及蛋白质类药物的开发中。
1.2 IgG框架对单克隆抗体生物活性的影响Varshney等[14]在小鼠中使用不同抗体亚型对抗体中和葡萄球菌肠毒素B (Staphylococcal enterotoxin B,SEB) 活 性的影响进行了研究。作者之前已证明鼠源抗-SEB IgG1单克隆抗体20B1,可成功地治疗SEB诱导的致死性休克 (SEB-induced lethal shock,SEBILS)[15]及由S. aureu产生的SEB诱导的菌血症[16]。本研究构建了IgG1单克隆抗体20B1的两种亚型转换变体IgG2a和IgG2b,它们分别拥有相同的可变区序列,并且在体内和体外分析中的中和与保护活性相当。然而在小鼠SEB中毒和S. aureu败血症模型中,IgG2a亚型变体展示出比IgG1或IgG2b更高的保护力。这表明,对已具有保护性的单克隆抗体改变亚型,可提高其保护力而不影响其抗原特异性或敏感性,这样在治疗中使用较低剂量的抗体即可达到满意的治疗效果。因此,作者认为有必要在毒素中和单克隆抗体开发及治疗性抗体设计中,从抗体生物活性方面认真考虑亚型选择。
对于用于人的治疗性抗体4种IgG亚型选择,可根据是否需要效应功能等方面进行选择。假如目标是中和可溶性抗原,效应功能较少相关,则可使用IgG1、突变的IgG1、IgG2或IgG4。例如,在CDP571的实例中,IgG1和IgG4变体体内比较的结果是选择IgG4同型[4,17]。再如,灵长源抗人CD4抗体,clenoliximab (一种稳定化且突变的IgG4,也称作IgG4-PE) 是作为一种非T细胞耗尽IgG1框架keliximab变体而开发的[18]。在keliximab的恒定区中用人源IgG4替换人源IgG1,并且对两种变体 (IgG4-E和IgG4-PE) 进行检测。两种变体都共有IgG4的CH2区中亮氨酸换成谷氨酸的突变,其目的在于进一步减少效应功能。此外,IgG4-PE具有额外的IgG4-稳定化,即在IgG4核心铰链中丝氨酸替换为脯氨酸。结果显示,IgG4-E批含有9%~28% 的半分子,与此相比IgG4-PE批 < 1%。此外,稳定化的IgG4-PE体内半衰期是9天,而未稳定化的IgG4-E半衰期仅4天。基于这些研究结果,挑选IgG4-PE用作临床开发[4]。
Beenhouwer等[19]比较了在新型隐球菌 (Cryptococcus neoformans) 感染模型中,一种抗葡糖醛酸木糖甘露聚糖(glucuronoxylomannan,GXM) 抗体的4种人类同型IgG1、IgG2、IgG3和IgG4抗GXM的功效。这些抗体具有完全相同的可变区,但它们与IgG的3种类型Fc受体 (FcγR) 结合能力、激活补体的能力以及半衰期均不同。结果显示,IgG2和IgG4抗GXM组延长了已感染的BALB/c小鼠的生存时间,IgG3抗GXM组没有感染动物存活,而使用IgG1抗GXM治疗的小鼠比使用磷酸盐缓冲盐水或无关同型单克隆抗体处理的小鼠生存时间短。因此,本实验中IgG2或IgG4是最理想的,而IgG1则有害。在感染动物中,所有单克隆抗体均降低了血清GXM含量。一般认为效应通路在防御细菌过程中很重要,例如调理吞噬和补体结合,与抗体功效负相关。对于治疗感染用途,人们通常认为IgG1是效应功能最偏爱的组合[20]。而该研究结果的发现,对于在目前临床试验用于隐球菌性脑膜炎治疗的人源化鼠IgG1有重大启示,并且对用于治疗其他感染性疾病设计治疗性抗体也一样。同时,这也进一步证明了对于抗体同型选择可能没有通用标准,需要更深刻地理解和应用抗体介导的保护机制并与具体实验相结合,从而考察治疗性抗体的全部潜力[4,19]。
Lee等[21]为了解决IgG1框架的TNF-α阻断剂 (如etanercept) 潜在的效应功能风险,他们采用TNF受体和与一种混合框架的Fc段融合,构建出一种类似于etanercept的TNF-α阻断剂TNFR-hyFc。混合框 架的Fc包括IgG4的CH2和CH3区以及IgD具有高度灵活性的铰链区,这些组分的ADCC和CDC活性均很低。他们将TNFR-hyFc与etanercept进行了多种生物化学特征的比较,如TNF-α中和活性、分子量、N端氨基酸测序、肽图等等,结果显示TNFR-hyFc在TNF-α中和活性体外检测中比etanercept高约1.5倍,其余各项均与etanercept相似。因此,该种TNF-α阻断剂具有进一步开发为药物的潜力。
2 IgG4 Fab臂交换与抗体药物开发
IgG4在人IgG亚型中含量最少,约占血清中全部IgG的5%[22],具有一些独特的生物学特性[23]。IgG4是一种具有两个铰链区半胱氨酸的四聚物分子 (H2L2),结构上与IgG1相似[5,24]。它可以进行重链交换,又称Fab臂交换 (Fab-arm exchange),可导致形成单价 (半抗体分子) 或者进一步形成双特异性抗体[23],IgG4半抗体分子由IgG4的HL二聚物组成[5]。在功能上,IgG4对于大多数FcγR受体具有较弱的亲和力[22],如FcγRII和FcγRIII[23]; 而且它还缺乏激活补体的能力[22],比如IgG4对于C1q的亲和力比其他亚型偏低[5]。在体内,由于Fab臂交换使得IgG4典型特征是单价有效,导致阻止抗体形成免疫复合体。因此,在治疗过程中,IgG4可被选择作为阻断抗体,大大地避免了效应机制的触发[22]。这些性质使得IgG4呈现相对“非炎症性的”特征,更适合用于治疗性单克隆抗体生产[23]。
2.1 IgG4与Fab臂交换与其他IgG亚型一样,每个IgG4分子含有12对链内二硫键,它的铰链区含有两对链间二硫键将两条重链连接在一起[24]。IgG4抗体具有交换由一条重链和一条轻链组成的“半抗体”的独特能力,这种交换过程称作“Fab臂交换”[25]。结合之前的研究,对于两种不同的IgG4分子Fab臂交换的过程包括: ① 铰链二硫键的还原/重排; ② 非共价键结合IgG4分离变为半分子; ③ 重新组合形成 (异质二聚体) 铰链还原的IgG4分子; ④ 恢复铰链二硫键平衡。已通过实验证明,Fab臂交换后形成的共价结合的双特异性抗体可通过质谱分析检测到[26,27]。
在IgG4的Fab臂交换过程中,核心铰链区残 基S228和CH3区的R409对于Fab臂交换是重要 位点[22, 28, 29, 30]。在IgG4中,将核心铰链区228位Ser替换为Pro (S228P) 可增强核心铰链区内的二硫键连接[5,29,30],从而阻止IgG4 Fab臂交换,大大减少了半分子抗体的形成,目前已用于一些IgG4框架治疗性抗体的开发[29, 31, 32, 33]。IgG4的CH3区409位是Arg,在IgG1、IgG2和IgG3中这个位点是Lys[23],这个位点的差异使CH3区结构稳定性在这4种亚型之间产生显著不同,研究结果显示将R409替换为K409可促进IgG4 CH3区结构稳定,阻止Fab臂交换[23,28,34]。值得注意的是,在人IgG1中通过引入P228S和K409R两种突变,可诱导IgG1发生Fab臂交换[28]。IgG4亚型中Fab臂交换过程、关键位点及链间、链内二硫键的形成,参见图 1。
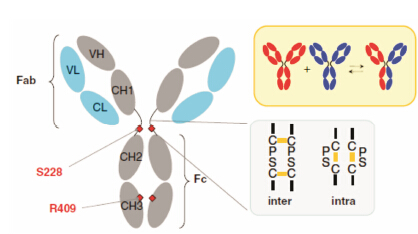
|
Figure 1 Features in IgG4 that relate to Fab arm exchange[34] |
此外,研究结果还表明,IgG4发生Fab臂交换需要在氧化还原条件下进行,在体外通常使用0.5 mmol·L-1 GSH来进行研究,也有使用5 mmol·L-1 GSH作为较极端的条件进行研究[26,29,35]; 在体内Fab臂交换反应也是在氧化还原过程控制下,并且取决于反应局部的氧化还原条件[35]。
在已开发的IgG4治疗性抗体药物中,natalizumab是IgG4野生型框架,可与内源IgG4发生Fab臂交 换[29]。虽然目前尚无直接证据证明natalizumab与内源IgG4发生Fab臂交换后会降低治疗效果或产生不良反应[29]。但对同样是IgG4野生型框架的抗体药物TGN1412研究中显示,在TeGenero公司的临床研究中,所有治疗个体由于TGN1412诱导均迅速发生不良反应,与用动力学研究中检测到的Fab臂交换发生时间一致,但是TGN1412 Fab臂交换诱导这些不良反应的机制尚不清楚,也许IgG4野生型治疗性抗体在应用中具有潜在风险[29]。关于此观点,也有学者认为IgG4治疗性抗体在体内与内源IgG4发生Fab臂交换,不是TGN1412引起相关细胞因子风暴的直接原因,他们更倾向归因于TGN1412特异性CD28靶点的生物学特性,不支持Fab臂交换是野生型未稳 定化治疗性IgG4抗体不良反应的原因,并担心会误导科学研究方向[32]。尽管在此领域尚存争议,但是在IgG4治疗性抗体药物开发的策略中,人们似乎更倾向于将IgG4框架稳定化的策略[4,29,31]。
2.2 IgG4框架的抗体药物开发目前在治疗性抗 体工程中,IgG4亚型已用于一些不需要效应功能的治疗性抗体的开发。比如natalizumab (Tysabri®),它是鼠源单克隆抗体通过互补决定区人源化嫁接入人IgG4框架的一种重组IgG4抗体,可中和α4-整合素 (α4-integrin) 用于治疗多发性硬化 (multiple sclerosis,MS)[5,24]。Natalizumab选择性抑制α4-整合素介导的淋巴细胞对内皮受体的黏附 (血管细胞黏附分子1和黏膜地址素细胞黏附分子1),从而阻止通过血脑屏障迁移进入中枢神经系统[22]。在针对PD-1靶点开发的单克隆抗体中,pembrolizumab (Keytruda®) 是人源IgG4单克隆抗体,nivolumab (Opdivo®) 为全人源IgG4单克隆抗体,两者均是抗PD-1受体的抗体[36,37],通过阻止PD-1介导的T-细胞抑制增加T-细胞的活化作用,均可用于黑色素瘤的治疗[37]。以上是目前仅有的几种已经上市的IgG4框架治疗性抗体,处于临床研究阶段的IgG4抗体药物参见表 1[38,39]。
|
|
Table 1 Clinical stage of IgG4 antibody drug. ahttp://clinicaltrial. gov/show/NCT01728207; bhttp://clinicaltrials.gov/ct2/show/ NCT01665391 |
此外,通过混合亚型IgG分子可设计缺乏效应功能的抗体,模拟所需组分亚型的属性,也是一种抗体开发策略。例如,2007年上市的补体成分C5-特异性抗体eculizumab (Soliris®) 使用了一种混合的IgG2- IgG4恒定区,是将人IgG2的CH1区和铰链区融合到人IgG4的CH2和CH3区组成的。Eculizumab缺乏结合FcγRs以及激活补体的能力,而这分别是人IgG2和IgG4的一般属性[40]。
3 结语
根据现有的研究结果,在治疗性抗体开发过程中,抗体框架的变更除了可影响治疗性抗体的理化性质,如溶解度、热稳定性等,还可影响治疗性抗体的功能和治疗效果。IgG4亚型在抗体工程中独特的性质已受到科学家们极大的关注,被认为具有巨大的开发潜力[4],目前已有IgG4框架的治疗性抗体上市,并且还有一些IgG4框架的治疗性抗体已经处于前期开发或临床试验阶段[7,31,37,40,41]。此外,由于全人源抗体可大大降低治疗性抗体的免疫原性,降低不良反应发生的可能,因此已成为治疗性抗体的开发趋势。在这种背景下,抗体工程中根据治疗的需要进行抗体亚型的选择,通过突变或糖基化工程增加或降低抗体介导的细胞毒作用或补体激活等[42],则显得更为重要。
| [1] | Ecker DM, Jones SD, Levine HL. The therapeutic monoclonal antibody market [J]. MAbs, 2015, 7: 9-14. |
| [2] | Ruuls SR, Lammerts van Bueren JJ, van de Winkel JG, et al. Novel human antibody therapeutics: the age of the Umabs [J]. Biotechnol J, 2008, 3: 1157-1171. |
| [3] | Ito T, Tsumoto K. Effects of subclass change on the structural stability of chimeric, humanized, and human antibodies under thermal stress [J]. Protein Sci, 2013, 2: 1542-1551. |
| [4] | Salfeld JG. Isotype selection in antibody engineering [J]. Nat Biotechnol, 2007, 25: 1369-1372. |
| [5] | Correia IR. Stability of IgG isotypes in serum [J]. MAbs, 2010, 2: 221-232. |
| [6] | Vidarsson G, Dekkers G, Rispens T. IgG subclasses and allotypes: from structure to effector functions [J]. Front Immunol, 2014, 5: 520. doi: 10.3389/fimmu.2014.00520. |
| [7] | Reichert JM. Marketed therapeutic antibodies compendium [J]. MAbs, 2012, 4: 413-415. |
| [8] | Pepinsky RB, Silvian L, Berkowitz SA, et al. Improving the solubility of anti-LINGO-1 monoclonal antibody Li33 by isotype switching and targeted mutagenesis [J]. Protein Sci, 2010, 19: 954-966. |
| [9] | Ejima D, Tsumoto K, Fukuda H, et al. Effects of acid exposure on the conformation, stability, and aggregation of monoclonal antibodies [J]. Proteins, 2007, 66: 954-962. |
| [10] | Hari SB, Lau H, Razinkov VI, et al. Acid-induced aggregation of human monoclonal IgG1 and IgG2: molecular mechanism and the effect of solution composition [J]. Biochemistry, 2010, 49: 9328-9338. |
| [11] | Latypov RF, Hogan S, Lau H, et al. Elucidation of acid-induced unfolding and aggregation of human immunoglobulin IgG1 and IgG2 Fc [J]. J Biol Chem, 2012, 287: 1381-1396. |
| [12] | Ishikawa T, Ito T, Endo R, et al. Influence of pH on heat-induced aggregation and degradation of therapeutic monoclonal antibodies [J]. Biol Pharm Bull, 2010, 33: 1413-1417. |
| [13] | Franey H, Brych SR, Kolvenbach CG, et al. Increased aggregation propensity of IgG2 subclass over IgG1: role of conformational change and covalent character in isolated aggregates [J]. Protein Sci, 2010, 19: 1601-1615. |
| [14] | Varshney AK, Wang X, Aguilar JL, et al. Isotype switching increases efficacy of antibody protection against staphylococcal enterotoxin B-induced lethal shock and Staphylococcus aureus sepsis in mice [J]. MBio, 2014, 5: e01007-14. doi: 10.1128/mBio.01007-14. |
| [15] | Varshney AK, Wang X, Cook E, et al. Generation, characterization, and epitope mapping of neutralizing and protective monoclonal antibodies against staphylococcal enterotoxin B-induced lethal shock [J]. J Biol Chem, 2011, 286: 9737-9747. |
| [16] | Varshney AK, Wang X, Scharff MD, et al. Staphylococcal enterotoxin B-specific monoclonal antibody 20B1 successfully treats diverse Staphylococcus aureus infections [J]. J Infect Dis, 2013, 208: 2058-2066. |
| [17] | Suitters AJ, Foulkes R, Opal SM, et al. Differential effect of isotype on efficacy of anti-tumor necrosis factor α chimeric antibodies in experimental septic shock [J]. J Exp Med, 1994, 179: 849-856. |
| [18] | Reddy MP, Kinney CA, Chaikin MA, et al. Elimination of Fc receptor-dependent effector functions of a modified IgG4 monoclonal antibody to human CD4 [J]. J Immunol, 2000, 164: 1925-1933. |
| [19] | Beenhouwer DO, Yoo EM, Lai CW, et al. Human immunoglobulin G2 (IgG2) and IgG4, but not IgG1 or IgG3, protect mice against Cryptococcus neoformans infection [J]. Infect Immun, 2007, 75: 1424-1435. |
| [20] | Jefferis R. Isotype and glycoform selection for antibody therapeutics [J]. Arch Biochem Biophys, 2012, 526: 159-166. |
| [21] | Lee JH, Yeo J, Park HS, et al. Biochemical characterization of a new recombinant TNF receptor-hyFc fusion protein expressed in CHO cells [J]. Protein Expr Purif, 2013, 87: 17-26. |
| [22] | Rispens T, Leeuwen Av, Vennegoor A, et al. Measurement of serum levels of natalizumab, an immunoglobulin G4 therapeutic monoclonal antibody [J]. Anal Biochem, 2011, 411: 271-276. |
| [23] | Davies AM, Rispens T, Ooijevaar-de Heer P, et al. Structural determinants of unique properties of human IgG4-Fc [J]. J Mol Biol, 2014, 426: 630-644. |
| [24] | Liu H, May K. Disulfide bond structures of IgG molecules [J]. MAbs, 2012, 4: 17-23. |
| [25] | Ahmad M, Mahajan VS, Mattoo H, et al. Individuals with IgG4-related disease do not have an increased frequency of the K409 variant of IgG4 that compromises Fab-arm exchange [J]. J Rheumatol, 2014, 41: 185-187. |
| [26] | van der Neut Kolfschoten M, Schuurman J, Losen M, et al. Anti-inflammatory activity of human IgG4 antibodies by dynamic Fab arm exchange [J]. Science, 2007, 317: 1554-1557. |
| [27] | Rose RJ, Labrijn AF, van den Bremer ET, et al. Quantitative analysis of the interaction strength and dynamics of human IgG4 half molecules by native mass spectrometry [J]. Structure, 2011, 19: 1274-1282. |
| [28] | Labrijn AF, Rispens T, Meesters J, et al. Species-specific determinants in the IgG CH3 domain enable Fab-arm exchange by affecting the noncovalent CH3-CH3 interaction strength [J]. J Immunol, 2011, 187: 3238-3246. |
| [29] | Labrijn AF, Buijsse AO, van den Bremer ET, et al. Therapeutic IgG4 antibodies engage in Fab-arm exchange with endogenous human IgG4 in vivo [J]. Nat Biotechnol, 2009, 27: 767-771. |
| [30] | Silva JP, Vetterlein O, Jose J, et al. The S228P mutation prevents in vivo and in vitro IgG4 Fab-arm exchange as demonstrated using a combination of novel quantitative immunoassays and physiological matrix preparation [J]. J Biol Chem, 2015, 290: 5462-5469. |
| [31] | Beck A, Wurch T, Bailly C, et al. Strategies and challenges for the next generation of therapeutic antibodies [J]. Nat Rev Immunol, 2010, 10: 345-352. |
| [32] | Broug E, Bland-Ward PA, Powell J, et al. Fab-arm exchange [J]. Nat Biotechnol, 2010, 28: 123-125. |
| [33] | Lewis KB, Meengs B, Bondensgaard K, et al. Comparison of the ability of wild type and stabilized human IgG4 to undergo Fab arm exchange with endogenous IgG4 in vitro and in vivo [J]. Mol Immunol, 2009, 46: 3488-3494. |
| [34] | Rispens T, Davies AM, Ooijevaar-de Heer P, et al. Dynamics of inter-heavy chain interactions in human immunoglobulin G (IgG) subclasses studied by kinetic Fab arm exchange [J]. J Biol Chem, 2014, 289: 6098-6109. |
| [35] | Rispens T, Ooijevaar-de Heer P, Bende O, et al. Mechanism of immunoglobulin G4 Fab-arm exchange [J]. J Am Chem Soc, 2011, 133: 10302-10311. |
| [36] | Zitvogel L, Kroemer G. Targeting PD-1/PD-L1 interactions for cancer immunotherapy [J]. Oncoimmunology, 2012, 1: 1223-1225. |
| [37] | Maverakis E, Cornelius LA, Bowen GM, et al. Metastatic melanoma – a review of current and future treatment options [J]. Acta Derm Venereol, 2015, 95: 516-524. |
| [38] | Korde N, Carlsten M, Lee MJ, et al. A phase II trial of pan-KIR2D blockade with IPH2101 in smoldering multiple myeloma [J]. Haematologica, 2014, 99: e81-83. |
| [39] | Debaene F, Wagner-Rousset E, Colas O, et al. Time resolved native ion-mobility mass spectrometry to monitor dynamics of IgG4 Fab arm exchange and "bispecific" monoclonal antibody formation [J]. Anal Chem, 2013, 85: 9785-9792. |
| [40] | Chan AC, Carter PJ. Therapeutic antibodies for autoimmunity and inflammation [J]. Nat Rev Immunol, 2010, 10: 301-316. |
| [41] | Elvin JG, Couston RG, van der Walle CF. Therapeutic antibodies: market considerations, disease targets and bioprocessing [J]. Int J Pharm, 2013, 440: 83-98. |
| [42] | Vincent KJ, Zurini M. Current strategies in antibody engineering Fc engineering and pH-dependent antigen binding, bispecific antibodies and antibody drug conjugates [J]. Biotechnol J, 2012, 7: 1444-1450. |
 2015, Vol. 50
2015, Vol. 50


