前列腺癌是男性常见的恶性肿瘤,在西方国家中其发病率排名第一,致死率排名第二,仅次于肺癌及支气管癌 [1]。在我国前列腺癌的发病率相对较低,但由于环境、生活方式等因素的改变,前列腺癌 的发病率在近年来呈现持续快速增长趋势,正威胁着越来越多男性的身体健康。
目前对于前列腺癌的治疗主要有三方面: 外科手术切除、放射性治疗和药物治疗。外科手术切除会影响前列腺上皮细 胞的生长; 放射性治疗会对正常组织产生较大的损害; 药物治疗既可以达到疗效,还可以通过改造来降低药物的不良反应 ,因而药物治疗依然是极具前景的治疗手段。但目前药物治疗最大障碍之一是肿瘤细胞对药物产生耐药性的问题。
为了更好地克服前列腺癌的耐药问题,本文就前列腺癌的耐药机制进行综述,为前列腺癌的药物治疗提供新的思路和靶 标。
1 雄激素及雄激素受体水平的增加
雄激素受体信号通路在维持前列腺功能和促进前列腺癌形成的过程中发挥着重要的作用 [2]。雄激素与雄激素受体 (androgen receptor,AR) 结合后,AR被激活并二聚化磷酸化, 进入细胞核中,与特异的DNA部位 (AR response element,ARE) 结合,募集RNA聚合酶等转录元件,调控靶基因的转录表达, 如前列腺特异性抗原 (PSA)、TMPRSS2、FKBP5等基因 (图 1)。正常情况下雄激素受体信号通路促进前列腺上皮细胞的分化,而异常的信号通路则会调节细胞周期、存活、 增殖[3],从而使得肿瘤恶化。
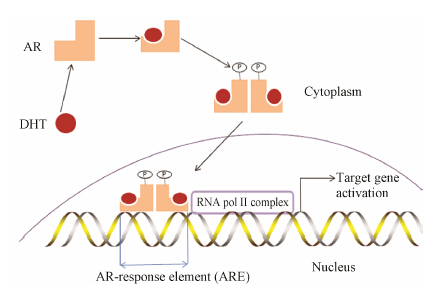
|
Figure 1 The androgen receptor signal pathway. AR: Androgen receptor; DHT: Dihydrotestosterone |
雄激素水平的增加,是前列腺癌耐药的机制之一。有研究发现,雄激素水平在一些去势抵抗性前 列腺癌患者中比初级 前列腺癌患者中要高[4],说明在难治疗的前列腺癌中,雄激素依然发挥着重要作用 。
2012年FDA批准的抗前列腺癌药物——阿比特龙,在Ⅰ、Ⅱ期的临床试验中显示: 30% 去势抵抗性的前列腺癌患者能够 持续降低血清PSA的浓度[5]。阿比特龙是细胞色素P450-17 (CYP17) 不可逆的抑制 剂,而CYP17可使胆固醇转化为脱氢表雄酮(DHEA),进而生成二氢睾酮 (DHT) (图 2),是雄激素生物合成中的关键酶之一[6,7,8]。但是,目前前列腺癌治疗过程 中也出现了阿比特龙的耐药性问题。羟基类固醇3β脱氢酶1 (3βHSD1) 是脱氢表雄酮转化为DHT的限速 酶,其丙氨酸 (A) → 半胱氨酸 (C) 的突变,可使3βHSD1的半衰期由2.1 h增加到2.7 h [9],从而使得更多的DHT生成,激活AR有关的信号通路,促进前列腺癌细胞的增殖和增加前 列腺癌的治疗难度。
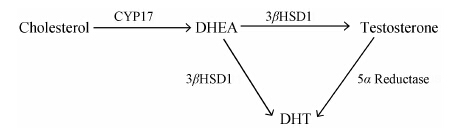
|
Figure 2 Biosynthesis of androgen. DHEA: Dehydroepiandrosterone |
雄激素受体AR水平的增加,可以使激素敏感型前列腺癌转化为激素难治性的前列腺癌,从而对抗前列腺癌药物的产生耐 药性[10]。Cai等[11]发现在前 列腺癌细胞 中,存在雄激素调控的反馈机制,在雄激素高水平下,会抑制AR信号,而在雄激素低水平下,则会增强AR信号。在去势抵抗性 的前列腺癌细胞 中,雄激素的水平很低,但是这足以激活AR并结合到AR第2个内含子的增强子上,从而可增加AR的表达及其 他相关蛋白 (如AKR1C3、HSD17B6等) 的表达,使得前列腺癌细胞继续增殖。因而前列腺癌患者,即使是通过手术切除或使 用抗雄激素的药物,并不能得到很好的长期疗效,也会产生一定的抗性。
此外,有研究发现AR水平的增加,与募集辅激活因子、辅抑制因子到AR靶基因的平衡改变有关。Culig等 [12]发现,在前列腺癌中有些辅激活因子表达上调甚至过表达,如TIF-2在前列腺癌中过表 达,它可以在没有激素的情况下,协同激活AR; P300在没有雄激素情况下过表达,它可以通过IL-6来激活配体非依赖性的 AR; Tip6可以调节PSA的表达等。因而,即使在雄激素受体拮抗剂的存在下,某些前列腺癌细胞依然能够调控AR靶基因的转 录表达,增加AR的水平,对药物产生耐药性。
2 雄激素受体氨基酸突变
氨基酸突变是雄激素受体拮抗剂产生耐药性 的重要机制。通常受体的氨基酸突变,可以增加配体的亲和性,有些则可 以使得药物由拮抗剂变成激动剂[13]。目前,一系列AR关键位点的突变已经确认,包 括877位苏氨酸 (T) → 丙氨酸 (A),741位色氨酸 (W) → 亮氨酸 (L) 或者半胱氨酸 (C) [14, 15],876位苯丙氨酸 (F) → 亮氨酸 (L) [13]。
雄激素受体不同位点的氨基酸突变,对应不同的药物产生耐药性。W741L或者W741C的突变针对比卡鲁胺 (bicalutamide,BIC) 产生耐药性[14]; T877A突变针对的是羟基氟他胺 (hydroxyflutamide,OHF) 耐药[16]; F876L针对恩杂鲁胺 (enzalutamide,MDV3100) 产生耐药性[13]。AR的877位氨基酸突变是在前列腺癌中 最早发现的。T877A的突变,使得羟基氟他胺具有激动剂活性[17, 18]。877位苏氨酸 (T) → 丙氨酸 (A),消除了羟基和氟他胺两个甲基之间的空间位阻,同时为 两个甲基提供了有利的疏水环境。目前已经有AR- DHT和AR W741L-BIC复合物的晶体结构 (图 3)。Osguthorpe等[19]研究发现,从晶体结构上看,二者 的Helix 12 (H12) 构象基本相同,这说明了AR发生W741L突变,可以使比卡鲁胺由拮抗剂变成激动剂。741位色氨酸 (W) → 亮氨酸 (L) 或半胱氨酸 (C),比卡鲁胺在分子作用力下构象改变,使得H12可以正确定位形成AF2 (activation function 2),发挥比卡鲁胺激动剂的作用。Balbas等[13]发现AR的876位氨 基酸突 变后,恩杂鲁胺不仅可以使H12正确定位形成AF2,还能诱导AR F876L的核定位、募集AR F876L结合到靶基因的增强子上。 他们设计了恩杂鲁胺的类似物——DR103,它可以有效地克服针对F876L突变引起的耐药性问题。

|
Figure 3 Crystal structure of human androgen receptor ligand binding domain with compound. Left: The AR-W741L in complex with bicalutamide; Right: The wild type AR in complex with DHT |
在前列腺癌细胞中,除了AR的单突变,还有少数是双突变的。研究[17]发现,在前 列腺癌细胞中存在W741C + T877A的双突变,它可以使羟基氟他胺和比卡鲁胺均由拮抗剂变成激动剂。同时,他们还发现了 另一个拮抗剂——尼鲁卡胺 (nilutamide),对这种双突变的AR具有一定程度的抑制作用,从而可以克服双突变带来的耐药 性问题。
3 雄激素受体可变剪接体的产生
雄激素受体可变剪接体 (androgen receptor splice variants,AR-Vs),也是前列腺癌产生耐药性的一个重要因素。 由于基因重排作用,目前已经鉴定出许多不具备LBD (ligand binding domain) 的AR-Vs [20, 21]。AR-Vs主要有AR-V7 (也叫做AR3) 和 ARv567es两大类,它们可以在没有全长AR (AR-FL) 时调节相关基因的表达 [22, 23]。大多数去势抵抗性前列腺癌患者的 样本中,可以检 测到AR-Vs和AR-FL的表达,并且与雄激素非依赖性的患者样本相比,AR-Vs的表达明显上调 [24]。
有研究发现,AR-Vs可以独立地促使AR转录,从而对恩杂鲁胺产生耐药性。此外Li等 [25]发现,选择性地敲除AR-Vs会抑制雄激素非依赖性的前列腺癌细胞的增殖,并且可以恢 复雄激素、雄激素受体拮抗剂的抑制作用。Cao等[26]进一步研究了AR-Vs使恩杂鲁 胺产生耐药性的机制,发现AR-Vs在没有AR-FL时,可以结合在特异靶基因的启动子上进行调控基因表达,但是,当有AR-FL时 ,则会以相互依赖的方式共同结合到AR传统的靶标上。
目前关于克服AR-Vs产生的耐药问题也有研究。Zhan等[27]发现甲硒醇作为前药 ,可以下调AR-Vs和AR-FL的表达及其活性。这种下调不依赖于雄激素作用,并且可以抑制AR基因的转录,因而可以 克服AR-Vs产生的耐药问题。此外Liu等[28]发现,治疗绦虫的药物氯硝柳胺 (niclosamide) 是AR-V7的抑制剂,它可以显著地抑制AR-V7的转录活性和蛋白表达,减少AR-V7募集到PSA的启动子上。氯 硝柳胺和恩杂鲁胺联合用药,可以显著抑制前列腺癌肿瘤的增长。
4 雄激素受体信号通路阻断旁路
Arora等[29]发现,在前列腺癌细胞中,诱导糖皮质激素受体 (glucocorticoid receptor,GR) 表达是其产生耐药的一个新机制。在一些前列腺癌细胞中,高强度地抑制AR可以导致GR的表达上调。GR和 AR的结合位点有很多的重叠,因而它可以替代AR来激活一系列相似但可识别的靶基因,这些靶基因对维持耐药性表型是必 需的。此外,GR的激动剂——地塞米松,它可以增强前列腺癌细胞对恩杂鲁胺的耐药性,而GR的拮抗剂则可以恢复癌细胞对 恩杂鲁胺的敏感性。因而GR可以通过AR信号通路的旁路来发挥作用,使得前列腺癌细胞对恩杂鲁胺产生耐药性。
5 其他耐药机制
在前列腺癌中,主要起作用的是AR信号通路,此外还有PI3K/AKT、NF-κB等信号通路 [30, 31]。正常情况下,AR转录表达的FKBP5蛋白,可以抑制AKT 的活性,而AKT信号通路下游的mTOR可以抑制AR信号通路的受体酪氨酸激酶 (RTKs)[32] ,这两条信号通路相互制约。因而PI3K/AKT信号通路的活化是许多恶性前列腺癌的特征 [33]。研究[34]发现,在雄激素去势抵抗性的前列 腺癌中AKT信号通路表达上调,对雄激素去除的治疗产生耐药性。Toren等[35]研究 发现,AKT抑制剂AZD5363作为单一的治疗药物,在体外以及恩杂鲁胺耐药的异种移植模型中,均具有很好的抗前列腺癌活性 ; 将AZD5363和恩杂鲁胺联合使用,则可以延缓前列腺癌细胞对恩杂鲁胺的耐药。
NF-κB信号通路与前列腺癌耐药性的产生密切相关。有研究发现NF-κB能够与AR信号通路发生交叉作 用,过表达NF-κB主要因子p65/Rel会增加AR蛋白的水平,从而促进前列腺癌的恶化 [36]。Nadiminty等[37]研究发现,在恩杂鲁胺处理 的LNCaP细胞中稳定表达NF-κB2/p52后,会提高细胞的存活率,在C4-2B和CWR22Rv1细胞中长期用恩杂鲁胺处理后 NF-κB2/p52水平增加; NF-κB2/p52介导的前列腺癌细胞耐药,是由于NF-κB2/p52活化了AR和 AR-Vs。Jin等[38]也研究发现,激活传统的NF-κB信号通路,会使得雄激素 敏感型的前列腺癌细胞转变成雄激素不敏感型,从而对抗雄激素的药物产生耐药性; 将NF-κB的抑制剂和抗雄激 素的药物联合使用,可达到很好的治疗效果。
miRNA是维持细胞内稳态的小分子调节RNA,通常在肿瘤组织中表达发生改变[39, 40]。Ottman等[41] 研究发现,miRNA表达的动态变化通常 发生在雄激素去除和AR阻断作用的早期,上调miRNA会抑制TP53、BRCA、Toll样受体、IRAK1、STAT1、CHUK和FADD蛋白的 表达,下调miRNA会增加EGFR、NFkB1/RelA、E2F家族成员、BCL2L2、ZBTB7A、EGO2 (EIF2C2) 和ZEB2的合成,从而使得雄 激素非依赖性的前列腺癌细胞增殖。因而miRNA表达的改变,与前列腺癌的耐药机制相关。
6 总结
药物的耐药性问题是药物发现、发展过程中面临的巨大挑战之一。本文从AR的水平增加、突变、可变剪接体以及AR信 号通路的旁路GR等方面,阐述了目前前列腺癌耐药的机制。前列腺癌耐药的特点 有: ① AR的信号通路依然发挥极其重要 的作用; ② 引起耐药性因素较为复杂,往往多因素、多通路联合作用,需要从系统生物学角度研究; ③ 耐药性具有较强 的个体差异,治疗过程中需要考虑个性化治疗。针对这些不同的耐药机制,需研发出新的药物及治疗手段,从而治疗前列腺 癌。首先,仍需要重视新一代AR拮抗剂的开发,克服由于AR过表达及突变引起的耐药性问题; 其次,可采用多靶点联合用药 的方式对多因素耐药性前列腺癌进行更好的治疗; 此外,寻找治疗前列腺癌的新靶标,也是克服前列腺癌耐药的一种有效 方法,但新靶标也可能产生新的耐药性问题; 最后,前列腺癌的耐药性机制仍需更深入、更全面研究。
| [1] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014 [J]. CA Cancer J Clin, 2014, 64: 9-29. |
| [2] | Dong Y, Zhang H, Gao AC, et al. Androgen receptor signaling intensity is a key factor in determining the sensitivity of prostate cancer cells to selenium inhibition of growth and cancer-specific biomarkers [J]. Mol Cancer Ther, 2005, 4: 1047-1055. |
| [3] | Wang Q, Li W, Zhang Y, et al. Androgen receptor regulates a distinct transcription program in androgen-independent prostate cancer [J]. Cell, 2009, 138: 245-256. |
| [4] | Montgomery RB, Mostaghel EA, Vessella R, et al. Maintenance of intratumoral androgens in metastatic prostate cancer: a mechanism for castration-resistant tumor growth [J]. Cancer Res, 2008, 68: 4447-4454. |
| [5] | Tran C, Ouk S, Clegg NJ, et al. Development of a second-generation antiandrogen for treatment of advanced prostate cancer [J]. Science, 2009, 324: 787-790. |
| [6] | Reid AHM, Attard G, Barrie E, et al. CYP17 inhibition as a hormonal strategy for prostate cancer [J]. Nat Clin Pract Urol, 2008, 5: 610-620. |
| [7] | Yin L, Hu Q. CYP17 inhibitors—abiraterone, C17, 20-lyase inhibitors and multi-targeting agents [J]. Nat Rev Urol, 2014, 11: 32-42. |
| [8] | Mostaghel EA, Marck BT, Plymate SR, et al. Resistance to CYP17A1 inhibition with abiraterone in castration-resistant prostate cancer: induction of steroidogenesis and androgen receptor splice variants [J]. Clin Cancer Res, 2011, 17: 5913-5925. |
| [9] | Chang KH, Li R, Kuri B, et al. A gain-of-function mutation in DHT synthesis in castration-resistant prostate cancer [J]. Cell, 2013, 154: 1074-1084. |
| [10] | Chen CD, Welsbie DS, Tran C, et al. Molecular determinants of resistance to antiandrogen therapy [J]. Nat Med, 2004, 10: 33-39. |
| [11] | Cai C, He HH, Chen S, et al. Androgen receptor gene expression in prostate cancer is directly suppressed by the androgen receptor through recruitment of lysine-specific demethylase 1 [J]. Cancer Cell, 2011, 20: 457-471. |
| [12] | Culig Z, Santer FR. Androgen receptor co-activators in the regulation of cellular events in prostate cancer [J]. World J Urol, 2012, 30: 297-302. |
| [13] | Balbas MD, Evans MJ, Hosfield DJ, et al. Overcoming mutation-based resistance to antiandrogens with rational drug design [J]. eLife, 2013, 2: e00499. doi: 00410.07554/eLife. 00499. |
| [14] | Otsuka T, Iguchi K, Fukami K, et al. Androgen receptor W741C and T877A mutations in AIDL cells, an androgen-independent subline of prostate cancer LNCaP cells [J]. Tumour Biol, 2011, 32: 1097-1102. |
| [15] | Hara T, Miyazaki J, Araki H, et al. Novel mutations of androgen receptor: a possible mechanism of bicalutamide withdrawal syndrome [J]. Cancer Res, 2003, 63: 149-153. |
| [16] | Steketee K, Timmerman L, Ziel-van der Made AC, et al. Broadened ligand responsiveness of androgen receptor mutants obtained by random amino acid substitution of H874 and mutation hot spot T877 in prostate cancer [J]. Int J Cancer, 2002, 100: 309-317. |
| [17] | Urushibara M, Ishioka J, Hyochi N, et al. Effects of steroidal and non-steroidal antiandrogens on wild-type and mutant androgen receptors [J]. Prostate, 2007, 67: 799-807. |
| [18] | Bohl CE, Gao W, Miller DD, et al. Structural basis for antagonism and resistance of bicalutamide in prostate cancer [J]. Proc Natl Acad Sci USA, 2005, 102: 6201-6206. |
| [19] | Osguthorpe DJ, Hagler AT. Mechanism of androgen receptor antagonism by bicalutamide in the treatment of prostate cancer [J]. Biochemistry, 2011, 50: 4105-4113. |
| [20] | Dehm SM, Schmidt LJ, Heemers HV, et al. Splicing of a novel androgen receptor exon generates a constitutively active androgen receptor that mediates prostate cancer therapy resistance [J]. Cancer Res, 2008, 68: 5469-5477. |
| [21] | Guo Z, Yang X, Sun F, et al. A novel androgen receptor splice variant is up-regulated during prostate cancer progression and promotes androgen depletion-resistant growth [J]. Cancer Res, 2009, 69: 2305-2313. |
| [22] | Sprenger CC, Plymate SR. The link between androgen receptor splice variants and castration-resistant prostate cancer [J]. Horm Cancer, 2014, 5: 207-217. |
| [23] | Hu R, Isaacs WB, Luo J. A snapshot of the expression signature of androgen receptor splicing variants and their distinctive transcriptional activities [J]. Prostate, 2011, 71: 1656-1667. |
| [24] | Hornberg E, Ylitalo EB, Crnalic S, et al. Expression of androgen receptor splice variants in prostate cancer bone metastases is associated with castration-resistance and short survival [J]. PLoS One, 2011, 6: e19059. doi:19010.11371/journal.pone.0019059. |
| [25] | Li Y, Chan SC, Brand LJ, et al. Androgen receptor splice variants mediate enzalutamide resistance in castration-resistant prostate cancer cell lines [J]. Cancer Res, 2013, 73: 483-489. |
| [26] | Cao B, Qi Y, Zhang G, et al. Androgen receptor splice variants activating the full-length receptor in mediating resistance to androgen-directed therapy [J]. Oncotarget, 2014, 5: 1646-1656. |
| [27] | Zhan Y, Cao B, Qi Y, et al. Methylselenol prodrug enhances MDV3100 efficacy for treatment of castration-resistant prostate cancer [J]. Int J Cancer, 2013, 133: 2225-2233. |
| [28] | Liu C, Lou W, Zhu Y, et al. Niclosamide inhibits androgen receptor variants expression and overcomes enzalutamide resistance in castration resistant prostate cancer [J]. Clin Cancer Res, 2014, 20: 3198-3210. |
| [29] | Arora VK, Schenkein E, Murali R, et al. Glucocorticoid receptor confers resistance to antiandrogens by bypassing androgen receptor blockade [J]. Cell, 2013, 155: 1309-1322. |
| [30] | Nadiminty N, Lou W, Sun M, et al. Aberrant activation of the androgen receptor by NF-B2/p52 in prostate cancer cells [J]. Cancer Res, 2010, 70: 3309-3319. |
| [31] | Semenas J, Hedblom A, Miftakhova RR, et al. The role of PI3K/AKT-related PIP5K1α and the discovery of its selective inhibitor for treatment of advanced prostate cancer [J]. Proc Natl Acad Sci USA, 2014, 111: E3689-3698. |
| [32] | Drake JM, Huang J. PIP5K1α inhibition as a therapeutic strategy for prostate cancer [J]. Proc Natl Acad Sci USA, 2014, 111: 12578-12579. |
| [33] | Toren P, Zoubeidi A. Targeting the PI3K/Akt pathway in prostate cancer: challenges and opportunities (review) [J]. Int J Oncol, 2014, 45: 1793-1801. |
| [34] | Wang Y, Kreisberg JI, Ghosh PM. Cross-talk between the androgen receptor and the phosphatidylinositol 3-kinase/Akt pathway in prostate cancer [J]. Curr Cancer Drug Targets, 2007, 7: 591-604. |
| [35] | Toren P, Kim S, Cordonnier T, et al. Combination AZD5363 with enzalutamide significantly delays enzalutamide-resistant prostate cancer in preclinical models [J]. Eur Urol, 2015, 67: 986-990. |
| [36] | Jain G, Cronauer MV, Schrader M, et al. NF-κB signaling in prostate cancer: a promising therapeutic target? [J]. World J Urol, 2012, 30: 303-310. |
| [37] | Nadiminty N, Tummala R, Liu C, et al. NF-κB2/p52 induces resistance to enzalutamide in prostate cancer: role of androgen receptor and its variants [J]. Mol Cancer Ther, 2013, 12: 1629-1637. |
| [38] | Jin R, Yamashita H, Yu X, et al. Inhibition of NF-κB signaling restores responsiveness of castrate-resistant prostate cancer cells to anti-androgen treatment by decreasing androgen receptor-variant expression [J]. .Oncogene, 2014, doi:10.1038/onc.2014 302. |
| [39] | Jin M, Zhang T, Liu C, et al. miRNA-128 suppresses prostate cancer by inhibiting BMI-1 to inhibit tumor-initiating cells [J]. Cancer Res, 2014, 74: 4183-4195. |
| [40] | Siu MK, Abou-Kheir W, Yin JJ, et al. Loss of EGFR signaling-regulated miR-203 promotes prostate cancer bone metastasis and tyrosine kinase inhibitors resistance [J]. Oncotarget, 2014, 5: 3770-3784. |
| [41] | Ottman R, Nguyen C, Lorch R, et al. MicroRNA expressions associated with progression of prostate cancer cells to antiandrogen therapy resistance [J]. Mol Cancer, 2014. doi:10.1186/1476-4598-1113-1181. |
 2015, Vol. 50
2015, Vol. 50


