川芎始载于《神农本草经》, 为伞形科植物川芎 (Ligusticum chuanxiong Hort.) 的干燥根茎, 具有活血行气、祛风止痛的功效, 其主要有效成分为川芎嗪和阿魏酸等[1, 2], 由于临床上已使用盐酸川芎嗪和阿魏酸钠的相关制剂, 文献[3, 4]报道, 若以川芎中的组分阿魏酸与川芎嗪配伍使用, 其效果比单用的阿魏酸与川芎嗪更为显著, 因此, 本课题组在组分中药理论的指导下[5], 以阿魏酸钠和盐酸川芎嗪两味药物为原料, 制成组分中药制剂——川芎组分片。
在中药多成分整体特征的体内评价方面, 本课题组已进行了一些相关研究[6, 7]。本文建立的吸波面积指的是药物经紫外−可见吸收光谱全波长扫描后获得的吸收度与波长曲线下面积 (area under the absorbance- wavelength curve, AUAWC), 公式为AUAWC = ΔAλ, 假设波长λ可以均分, 且λ均分值 = 1 nm, 则AUAWC = ΔA, 即AUAWC为每隔1 nm的吸收度值的总和; 由于吸收度具有加和性, 结合比尔定律 (A = ΕCl), 可得: ΔA = A1 + A2 + A3 + … Aλ = Εl (C1 + C2 + C3 + … Cλ), C总 = C1 + C2 + C3 + … Cλ, El为常数m, 则AUAWC = mC总, 即吸波面积和中药中整体成分的总浓度成正比。
因此, 当吸波面积的方法学确定后, 通过测得的不同时间点中药制剂样品的AUAWC, 就可算出该时间点制剂中整体成分的总浓度, 进而获得药物总含量, 体外方面, 可开展中药整体成分的溶出度研究, 绘制时间−溶出曲线; 体内方面, 可进行中药整体成分的体内药代动力学研究, 绘制总药物的血药浓度−时间曲线, 求算总药物的药代动力学参数。
本文通过川芎组分片中阿魏酸钠和盐酸川芎嗪混合整体成分的体外溶出度测试, 并以大鼠为研究对象, 开展体内研究, 探讨吸波面积法用于川芎组分片中整体成分体内外相关性研究的可行性, 为今后西药或中药复方制剂中多成分总药物的体内外相关性评价奠定基础。
材料与方法仪器 RCZ-6C1药物溶出仪 (上海黄海药检仪器厂); TU-1901双光束紫外可见分光光度计 (北京普析通用仪器有限责任公司)。
药品与试剂 川芎组分片 (批号20140929, 每片0.21 g, 成分为阿魏酸钠与盐酸川芎嗪) 由福建中医药大学药剂科研实验室制备; 阿魏酸对照品 (批号110773-201012) 和盐酸川芎嗪对照品 (批号110817- 200305) 由中国食品药品检定研究院提供。阿魏酸钠原料 (批号20130115) 为苏州市立德有限公司产品; 盐酸川芎嗪原料 (批号110601) 为福建天泉药业股份有限公司产品; 可溶性淀粉 (批号101223) 为西陇化工股份有限公司产品; 交联聚维酮 (批号130105) 为安徽山河药用辅料有限公司产品; 硬脂酸镁 (批号110918) 为安徽山河药用辅料有限公司产品; 氯化钠注射液 (批号: 140418A07) 为福州海王制药有限公司产品。
实验动物 清洁级健康雄性SD大鼠, 体质量 (250 ± 10) g, 上海斯莱克实验动物有限责任公司提供, 许可证号: SCXK (沪) 2007-0005。
川芎组分片溶出度的测定溶出介质的选择和溶出样品采集 参考《中国药典》 (2010版) [8] 以水为溶出介质测定溶出度。加热至 (37 ± 0.5) ℃, 转速为每分钟50转。分别在5、10、20、30、45和60 min取样10 mL, 经0.45 μm的微孔滤膜过滤后备用。同时立即补加同温等量的10 mL溶出介质。
样品溶出度的测定 取川芎组分片6片, 按“溶出样品采集”下方法采集样品, 按照紫外分光光度法, 以水为空白对照, 在200~600 nm进行全波长扫描。以累积溶出度为纵坐标, 时间 (t) 为横坐标, 绘制溶出曲线。
体外溶出度测定线性验证 精密称取阿魏酸对照品3.00 mg、盐酸川芎嗪对照品1.50 mg, 置25 mL量瓶中, 加水溶解并定容至刻度, 摇匀, 即得混合药物总浓度为180 μg·mL−1的储备液。用水稀释成混合药物总浓度分别为0.9、1.8、9、18、27、36和54 μg·mL−1的系列对照品溶液。按照紫外分光光度法, 以水为空白, 在200~600 nm进行全波长扫描。Origin 8.0软件拟合并计算AUAWC, 以混合药物总浓度 (C) 为横坐标, AUAWC为纵坐标, 绘制标准曲线, 计算回归方程。
片剂总样供试品溶液 按照川芎组分片处方比例, 精密称取阿魏酸钠原料3.00 mg、盐酸川芎嗪原料1.50 mg、可溶性淀粉1.80 mg、交联聚维酮0.31 mg和硬脂酸镁0.01 mg, 放入25 mL量瓶中, 加适量水后超声5 min, 使其充分溶解并用水定容至25 mL, 滤过, 取续滤液, 备用。精密吸取1 mL于10 mL量瓶中, 加水定容, 作为片剂总样供试品溶液备用。
辅料干扰考察 取3片川芎组分片, 研细, 混合均匀, 精密称取一片量, 再精密称取等同于一片但除去药物原料的辅料内容物一份, 分别放入已经装有900 mL水的溶出杯中, 加热至 (37 ± 0.5) ℃, 转速为每分钟50转。在第60 min时分别取样10 mL, 经0.45 μm的微孔滤膜过滤后取续滤液备用。按照紫外分光光度法, 以水为空白对照, 在200~600 nm进行全波长扫描, Origin 8.0软件拟合并计算出AUAWC。
精密度 将混合药物总浓度为36 μg·mL−1的对照品溶液, 按照紫外分光光度法, 以水为空白, 在200~600 nm进行全波长扫描6次, Origin 8.0软件拟合并计算出AUAWC。
稳定性 取10 min溶出样品, 分别于0、1、2、4、5、6和18 h进行全波长扫描, Origin 8.0软件拟合并计算出AUAWC。
重复性 取供试品溶液6份, 进行全波长扫描, Origin 8.0软件拟合并计算出AUAWC。
加样回收率 精密量取已知含量的供试品溶液6份, 每份1 mL, 分别精密加入18 μg·mL−1混合对照品溶液0.7 mL, 混合均匀后, 进行全波长扫描, Origin 8.0软件拟合计算出AUAWC。将AUAWC带入标准曲线求出混合后的样品浓度, 计算加样回收率。
大鼠体内总药物含量测定混合对照品储备液 精密称取阿魏酸对照品1.51 mg、盐酸川芎嗪对照品0.76 mg, 置25 mL量瓶中, 加甲醇溶解并定容至刻度, 摇匀, 即得混合药物总质量浓度为90.8 μg·mL−1的对照品储备液。用甲 醇梯度稀释, 得混合药物总质量浓度分别为36.32、27.24、18.16、9.08、4.54和0.908 μg·mL−1的系列对照品溶液。
方法专属性 取大鼠空白血浆0.4 mL, 加入甲醇3.6 mL, 涡旋2 min后离心10 min (3 800 r·min−1), 按照紫外−可见分光光度法, 以甲醇溶剂作为参比, 进行200~600 nm全波长扫描, 获得大鼠空白血浆的全波长扫描图; 分别将一定浓度的对照品溶液加入空白血浆中, 同法操作, 得空白血浆加对照品的全波长扫描图; 取受试大鼠给药后收集的血浆样品, 同法操作, 得全波长扫描图。
线性关系 取大鼠空白血浆0.4 mL, 加入系列对照品工作溶液3.6 mL, 涡旋2 min后离心10 min (3 800 r·min−1), 配制32.688、24.516、16.344、8.172、4.086和0.817 2 μg·mL−1血浆样品。按照紫外−可见分光光度法, 以甲醇溶剂作为参比, 进行200~600 nm全波长扫描, Origin 8.0软件计算吸收度−波长曲线下面积AUAWC1。同时, 取大鼠空白血浆0.4 mL, 加入甲醇3.6 mL, 测得AUAWC2 , 计算药物的ΔAUAWC = AUAWC1 − AUAWC2 , 以混合药物总质量浓度 (C) 为横坐标, ΔAUAWC为纵坐标, 绘制标准曲线药物的吸波面积 (ΔAUAWC) 与混合药物总质量浓度 (C) 的回归方程。
精密度 制备低、中、高3种质量浓度 (0.817 2、8.172和32.688 μg·mL−1) 的样品, 每个浓度平行做5份, 按“线性关系”项下操作, 每个样品测定一次药物的AUAWC, 于1个工作日内完成, 计算日内精密度。
提取回收率和方法回收率 制备低、中、高3种质量浓度 (0.817 2、8.172和32.688 μg·mL−1) 的样品, 按照“线性关系”项下操作, 测定样品的AUAWC, 并与相应浓度对照品甲醇溶液直接测定的吸波面积相比, 计算样品的萃取回收率, 每个浓度平行做5份。将以上各个样品测得的药物吸波面积值代入回归方程计算浓度, 所得浓度与实际浓度的比值即为相对回收率。
稳定性 取给药后大鼠血浆样品, 按照“方法专属性”项下操作, 分别在0、1、2、3、4、5、6、19和20 h测定样品AUAWC, 考察稳定性。
川芎组分片大鼠体内实验川芎组分片混悬液 取适量的川芎组分片研磨均匀, 用0.9% 氯化钠注射液溶解, 制备成总药物质量浓度为1.5 mg·mL−1混悬药液备用。
川芎组分片给药方案 取大鼠60只, 随机分为10组, 每组6只, 给药前禁食12 h, 自由饮水。其中一组灌胃0.9% 氯化钠注射液后5 min采血; 其余9组灌胃川芎组分药液 (按15 mg·kg−1量灌胃), 分别于给药后5、10、20、30、60、90、120、180和240 min后通过眼眶采血2.5 mL, 每组大鼠只在一个时间点取血, EDTA-Na2抗凝, 立即离心10 min (3 800 r·min−1), 吸取上清液血浆, −20 ℃保存备用。
血浆样品制备与扫描测试 精密吸取含药血浆样品0.4 mL于离心管中, 加入甲醇3.6 mL, 涡旋2 min后离心10 min (3 800 r·min−1), 吸取上清液至比色皿中, 以甲醇溶剂作为参比进行200~600 nm全波长扫描得吸光度−波长曲线。
数据分析 将全波长扫描的吸光度值导入Origin 8.0软件, 通过软件拟合并计算出曲线下的有效面积, 将灌胃川芎组分制剂后各个时间点的AUAWC均值减去空白血浆的AUAWC均值, 得到不同时间点大鼠血浆中药物的ΔAUAWC, 再分别带入标准曲线的线性方程中, 求得各时间点的大鼠血浆中混合药物总浓度, 以总浓度为纵坐标, 时间为横坐标, 绘制药−时曲线图。
采用中国药理学会数学药理委员会编制的DAS 2.0实用药动学软件处理血浆药物总浓度−时间数据, 以AIC作为房室模型判断标准, 若大鼠灌胃川芎组分药液后的药−时曲线符合一室模型, 可采用Wagner- Nelson法计算体内吸收百分数fa[9], 若符合二室模型, 可采用Loo-Riegelman法计算体内吸收百分数fa。AUC采用梯形法计算, AUC0−∞ = AUC0−t + Ct/ke, t为最后的取样时间点, Ct为最后一点的血药浓度, ke为消除速率常数, 通过对消除相对应时间点的平均血药浓度进行lnC-t作图, 求回归方程, 得斜率k, 即ke[10]。以t时间点的体外累积平均溶出率 (fr) 为自变量, 体内平均累积吸收百分数 (fa) 为因变量进行线性回归, 根据r值判断二者相关性。
Wagner-Nelson方程: ${\rm{fa}} = \frac{{{C_t} + k\int_0^t {{C_t}{\rm{d}}t} }}{{k\int_0^\infty {{C_t}{\rm{d}}t} }}$
Loo-Riegelman方程:${\rm{fa}} = \frac{{{C_t} + {k_{10}}\int_0^t {{C_t}{\rm{d}}t} + \frac{{X_p^t}}{{{V_C}}}}}{{{k_{10}}\int_0^\infty {{C_t}{\rm{d}}t} }}$
$\int_0^t {{C_t}{\rm{d}}t} $, $\int_0^\infty {{C_t}{\rm{d}}t} $分别为AUC0−t和AUC0−∞; Ct是t时刻的血药浓度; k为消除速率常数; k10为中央室消除速率常数; $X_p^t$为t时刻外周室的药量; VC为分布容积。
结果 1 体外溶出实验方法学考察 1.1 线性验证以AUAWC为纵坐标, 混合药物浓度 (C) 为横坐标, 进行线性回归, 得到回归方程AUAWC = 6.155 7 C + 9.479 3 (r = 0.996), 表明混合药物总浓度在0.9~54 μg·mL−1线性关系良好, 即吸波面积与中药中整体成分的总浓度成正比。
1.2 辅料干扰考察按照“辅料干扰考察”方法下操作, 结果得单辅料的AUAWC值为药片全组分的0.43%, 表明辅料对于紫外吸收测定影响很小, 可以忽略不计。
1.3 精密度结果得到的混合对照品AUAWC的RSD为1.31%, 表明本仪器精密度良好。
1.4 稳定性结果得到的溶出样品AUAWC的RSD值为1.20%, 表明溶出样品至少在18 h内稳定。
1.5 重复性结果得到的供试品AUAWC的RSD值为2.53%, 表明重复性良好。
1.6 加样回收率结果得到的平均加样回收率为101.28%, RSD为3.50%, 表明本法具有良好的回收率。
2 大鼠体内总药物的含量测定 2.1 方法专属性结果表明, 200~400 nm波长, 样品血浆比空白血浆的吸光度值要大 (其中空白血浆在320~340 nm无紫外吸收), 故通过差值可去除空白血浆的干扰。
2.2 线性验证以ΔAUAWC为纵坐标, 混合药物浓度 (C) 为横坐标, 进行线性回归, 得到回归方程ΔAUAWC = 6.268 6 C + 1.665 8 (r = 0.999 7), 混合药物总质量浓度在0.817 2~32.688 μg·mL−1线性关系良好, 即吸波面积与血浆中混合药物的总浓度成正比。
2.3 精密度低、中、高3种浓度样品日内精密度RSD分别为9.9%、1.8% 和0.3%, 符合生物样品测定有关要求。
2.4 提取回收率和方法回收率低、中、高3种浓度样品的萃取回收率分别为85.7% (RSD = 9.85%)、93.5% (RSD= 1.82%) 和90% (RSD = 0.32%), 相对回收率分别为90.4% (RSD = 13.39%)、108.4% (RSD = 1.87%)、99.5% (RSD= 0.33%), 符合生物样品测定有关要求。
2.5 稳定性血浆样品AUAWC的RSD值为1.7%, 表明血浆样品至少在20 h内稳定。
3 大鼠体内血药浓度的测定通过Origin 8.0软件拟合并计算出空白血浆和灌胃川芎组分片后不同时间点大鼠血浆供试品的吸波面积的平均值, 再将不同时间点体内药物的ΔAUAWC分别带入标准曲线的线性方程中, 求得各时间点的大鼠体内混合药物总浓度, 药−时曲线见图 1。
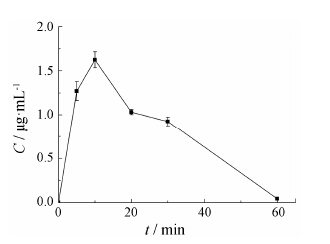
|
Figure 1 Mean plasma concentration-time curves of total drugs in rats. n = 6, x ± s |
结果表明, 大鼠灌胃川芎组分药液后的药−时曲线符合一室模型, 可采用Wagner-Nelson法计算体内吸收百分数fa, ke为0.085 2min−1。以第5、10、20、30和60 min时fr为自变量, 以fa为因变量进行线性回归, 得方程fa = 0.819 7 fr + 0.183 (r = 0.959 5), 临界值r (3, 0.01) = 0.959, 二者相关性结果表明川芎组分片的体外累积溶出度与体内吸收百分率有较好的相关性 (P < 0.01)。由于药物体内血药浓度在10 min内达到峰值, 故另以20 min内的fr为自变量, fa为因变量, 见表 1, 进行线性回归[11], 得方程fa = 0.587 1 fr + 0.274 9 (r = 0.999 9), 结果也表明川芎组分片的体外累积溶出度与体内累积吸收百分率有较好的相关性。即川芎组分片的体外溶出度实验能够反映体内药物的吸收过程[12]。
|
|
Table 1 Analysis result of the in vitro and in vivo correlation of tablet of rhizomes of Ligusticum chuanxiong components. n = 6, x ± s |
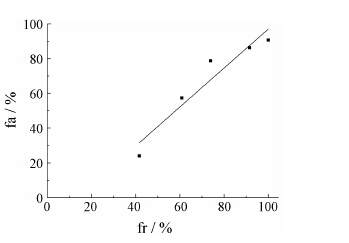
|
Figure 2 Correlation figure of the cumulative dissolution and absorption percentage |
实验中给药后第120 min时, 出现ΔAUAWC为负值, 原因可能与大鼠在实验过程中长时间没有饮水而引起的血浆稠度变大等因素有关。
阿魏酸钠与盐酸川芎嗪的代谢产物主要有硫酸酯结合产物和葡萄糖醛酸结合产物, 部分代谢物的紫外吸收可能由于母核侧链基团的增加会发生小幅度变化, 而吸波面积法主要体现的是原形药物及其代谢产物的总和, 可以说明这些总药物在体内的吸收、分布、代谢和排泄的整体体内动态变化过程, 与中药多成分复杂体系的整体观一致, 但不能体现单个药物具体的体内过程; 若借助高效液相以及高效液相−质谱联用的方法, 将有助于进一步阐明中药整体成分中各单一成分在体内具体动态的变化。而对于没有紫外吸收的中药, 则可以利用蒸发光散射检测器等仪器, 参照吸波面积法的研究思路, 对其中药进行整体成分的体内外研究。
| [1] | Shu B, Zhou CJ, Ma YH, et al. Research progress on pharmacological activities of the available compositions in Chinese medicinal herb Ligusticum chuanxiong [J]. Chin Pharmacol Bull (中国药理学通报), 2006, 22: 1043-1047. |
| [2] | Zhang L, Wang QD, Shi HM, et al. Influence of ferulic acid on the pain-depression dyad induced by reserpine [J]. Acta Pharm Sin (药学学报), 2013, 48: 32-37. |
| [3] | Yang JR, Zhang MX, Chang LT, et al. Effects of ligustrazine, ferulic acid and their compatibility on protection and adhesion molecules in myocardium of ischemia-reperfusion rats [J]. Chin Tradit Herb Drugs (中草药), 2008, 39: 1054-1056. |
| [4] | Pan ZH, Jin X. Protective effects of combination of ligustrazine and ferulic acid on myocardial injury induced by ischemia and reperfusion in rats [J]. Tianjin Med J (天津医药), 2008, 36: 796-798. |
| [5] | Li SY, Jiang ML, Zhang LH, et al. Central composite design-response surface method optimize of Fang-bing nasal inhalant from components of traditional Chinese medicine for sedative and sleep aiding [J]. Acta Pharm Sin (药学学报), 2013, 48: 573-579. |
| [6] | Zhang LH, Li SY, Li XD, et al. Pharmacokinetic studies of mixture composed of sodium ferulate and tetramethylpyrazine hydrochloride in rats. Proceeding of 2012 Graduate Academic Forum in Shanghai-the Future and Development of TCM (2012年上海市研究生学术论坛-中医药发展与未来论文集) [C]. Shanghai, 2012: 125-129. |
| [7] | Zhang LH, Xiao XJ, Yang ZZ, et al. A new method of area under the absorbance-wavelength curve for rats total metabolomic pharmacokinetics from Yangxue injection with multicomponents [J]. J Spectrosc, 2013. http://dx.doi.org/10.1155/2013/919023. |
| [8] | Chinese Pharmacopoeia Commission. Pharmacopeia of the People's Republic of China (Volume 2) (中华人民共和国药典二部) [S]. Beijing: China Medical Science Press, 2010: 410, 1151. |
| [9] | Le J, Liu X, Shi JM, et al. Dissolution of naproxen sodium tablets and evaluation of in vitro-in vivo correlation about this drug [J]. J Pharm Pract (药学实践杂志), 2008, 26: 211-213. |
| [10] | Fu XD, Tang L, Liu H. Studies on in vitro release characteristic and in vitro/in vivo correlation of diclofenac potassium sustained release tablets [J]. Pharm J Chin PLA (解放军药学学报), 2005, 21: 124-126. |
| [11] | Sun Y, Tang SF, Gao LQ. Dissolution testing of enalapril maleate tablets with flowing-through cell method and evaluation of in vivo-in vitro correlation [J]. Chin J Pharm Anal (药物分析杂志), 2009, 29: 560-563. |
| [12] | Tang LM, Chen GL. Dissolution of loxoprofen sodium tablets and evaluation of in vitro-in vivo correlation [J]. Chin J Pharm (中国医药工业杂志), 2006, 37: 550-552. |
 2015, Vol. 50
2015, Vol. 50


