最新研究结果表明, 乳腺癌已经成为威胁女性健康的“头号杀手”[1]。与其他癌症相比, 乳腺癌的发病越来越趋于年轻化。目前乳腺癌的临床治疗手段主要是保守治疗和乳房切除术[2]。其中, 化疗仍然是治疗乳腺癌的一种主要手段。如何将化疗药物有效地递送到肿瘤部位是众多研究关注的重点[3]。
由于肿瘤组织内部血管壁间隙较宽, 结构不完整, 淋巴回流缺失, 使得大分子物质和纳米给药系统在肿瘤部位具有较强的渗透和滞留效应 (enhanced permeability and retention effect, EPR effect)[4]。为此, 研究人员利用肿瘤组织的这一特点将药物包裹在纳米载体中, 通过EPR效应, 将药物有效地靶向肿瘤部位发挥治疗作用[5,6]。
在众多纳米给药系统中, 脂质体具有良好的生物相容性和靶向性, 同时可以降低所包载药物的毒性[7]。聚乙二醇 (polyethylene glycols, PEG) 可以显著延长药物载体在体内的循环时间, PEG修饰的脂质体被广泛应用在纳米给药系统的构建中[8]。但是, 当PEG修饰的脂质体到达肿瘤部位后, PEG较弱的穿透能力会限制脂质体入胞进一步发挥作用[9]。
穿膜肽可以高效的介导蛋白、核酸和纳米给药 系统入胞, 典型的穿膜肽包括TAT (AYGRKKRRQR RR)[10]和R8 (RRRRRRRR)[11]。然而, 穿膜肽通常都缺乏组织选择性, 能够穿透所有细胞膜, 将纳米给药系统递送到肿瘤部位的同时还会将其递送到其他脏器[12]。另外, 由于穿膜肽TAT和R8均带有正电荷, 在血液循环中会与血浆蛋白结合, 降低其体内稳定性[13]。这些缺点大大限制了穿膜肽的体内应用。
鉴于穿膜肽和PEG的优劣, 为了利用PEG的长循环效应和穿膜肽的高效入胞能力, 研究人员构建了基于敏感型PEG修饰的药物传递系统。这种敏感型PEG包括还原敏感型PEG[14]、酶敏感型PEG[15]和光敏感型PEG[16]等。另外, 在实体瘤中, 肿瘤细胞具有较强的增殖分化能力, 肿瘤部位氧供不足, 使得肿瘤组织细胞外微环境含有较多乳酸, 其细胞外的pH值 (6.5~6.8) 普遍低于正常组织和血液的pH值(7.2~7.4)[17,18]。因此, 也可以利用肿瘤组织这一特殊的微环境构建pH敏感型药物传递系统。
本课题设计了基于穿膜肽R8和pH敏感型PEG的共修饰脂质体给药系统 (Cl-Lip)。在血液循环中该pH敏感型PEG保持稳定, 可以屏蔽穿膜肽R8。当 脂质体通过EPR效应靶向到肿瘤部位后, 在肿瘤部位的微酸环境条件下, 连接PEG的化学键水解断裂, 使得该pH敏感型PEG断裂脱离脂质体表面, 穿膜肽R8去屏蔽化, 介导脂质体入胞。本文构建了此共修饰脂质体药物传递系统, 利用乳腺癌4T1细胞, 对其体外靶向性包括不同预孵育条件下的入胞能力、入胞途径、溶酶体逃逸能力和肿瘤球穿透能力进行评价。
材料与方法试剂与药物 大豆磷脂 (SPC, 上海艾韦特医药科技有限公司); 胆固醇 (Chole, 成都市科伦化工试剂厂); 1, 2-distearoyl-sn-glycero-3-phosphoethalamine- N-[maleimide (polyethylene glycol)-2000] (DSPE-PEG2K- Mal)、1, 2-dioleoyl-sn-glycero-3-phosphoethanolamine- N-(carboxyfluorescein) (CFPE) (美国Avanti Polar Lipids公司); R8 peptide (Cys-RRRRRRRR) (成都凯捷生物科技有限公司); PEG5K-Hz-PE、DSPE-PEG2K-R8 (本实验室制备); Lyso-tracker Red (美国Invitrogen公 司); 4'-6-diamidino-2-pheylindole (DAPI, 江苏碧云天生物有限公司); 1640培养基、胎牛血清 (FBS) (美国Hyclone公司); 叠氮钠、秋水仙素 (美国Merck公司); 多聚赖氨酸、菲氯平 (美国Sigma公司); 氯丙嗪 (美国Calbiochem公司); 其他试剂均为分析纯试剂。
仪器 激光粒度仪/zeta电位分析仪 (Nano ZS90, 英国Malvern公司); 流式细胞仪 (CytomicsTM FC500, 美国Beckman Coulter公司); 激光共聚焦显微镜 (FV1000, 美国Olympus公司)。
细胞 小鼠乳腺癌4T1细胞购于中国科学院上海细胞库。4T1细胞用含10% 胎牛血清的1640完全培养基于37 ℃孵箱中培养, 0.25% 胰酶消化传代。
脂质体的制备 分别精密称取Chole、SPC、DSPE-PEG2K-R8和PEG5K-Hz-PE适量溶于氯仿溶液中, 脂质材料按照Chole、SPC、DSPE-PEG2K-R8摩尔比为35∶57∶0.8精密量取, 制备单纯R8修饰的 脂质体 (R8-Lip)[19]; 按照Chole、SPC、DSPE-PEG2K- R8、PEG5K-Hz-PE摩尔比为35∶57∶0.8∶8精密量 取, 制备共修饰脂质体 (Cl-Lip)。进一步将所有脂质材料加入至25 mL茄形瓶中, 在37 ℃条件下旋蒸 除去氯仿至形成薄膜, 真空干燥过夜。加入pH 8.0 PBS溶液1 mL放置于摇床中, 37 ℃水化15 min, 在冰浴条件下探头超声 (80 W, 100 s)。所形成的脂质 体于4 ℃条件下保存备用。对于CFPE标记的脂质 体, 将适量的CFPE氯仿溶液加入至脂质材料中共同旋蒸形成薄膜, 使得所形成的脂质体中CFPE终质量浓度为15 μg·mL−1。
共修饰脂质体粒径和电位的考察 取Cl-Lip 100 μL, 用纯水稀释至1 mL, 采用激光粒度仪/zeta电位分析仪对其粒径与zeta电位进行测定。
共修饰脂质体体外血清稳定性考察 取Cl-Lip 1 mL与滤过的胎牛血清1∶1 (v/v) 混合, 分别于0.5、1、2、4、8和24 h取100 μL, 用纯水稀释至1 mL, 采用激光粒度仪/zeta电位分析仪对其粒径进行测定。
不同预孵育条件下细胞对共修饰脂质体摄取的考察 定量将所制备的CFPE标记的Cl-Lip与不同pH条件下 (pH 7.4、pH 6.0) 的1640培养基混合使得CFPE的终质量浓度为2 μg·mL−1。混合液分别在37 ℃下孵育1和2 h后, 将其pH调至7.4备用。
另将4T1细胞接种在6孔板内, 待细胞汇合度达到70%~80% 时, 将原培养基吸出后, 加入Cl-Lip与培养基的混合液。在37 ℃、5% CO2孵箱中孵育2 h后将培养基吸出, 用PBS漂洗3次, 胰酶消化, 离心后用0.4 mL PBS重悬细胞, 采用流式细胞仪检测细胞对不同预孵育条件下Cl-Lip的摄取强度。
共修饰脂质体的摄取机制考察 将细胞分别加入适量细胞摄取抑制剂氯丙嗪、多聚赖氨酸、菲氯平、秋水仙素和叠氮钠, 孵育30 min后再将Cl-Lip与培养基的混合液加至上述含有4T1细胞的6孔板中, 2 h后吸出培养基, 用PBS漂洗3次, 胰酶消化, 离心后用0.4 mL PBS重悬细胞, 采用流式细胞仪检测加入不同抑制剂后, 细胞对Cl-Lip摄取的程度。同时, 考察在4 ℃孵育条件下, 细胞对Cl-Lip的摄取强度。
共修饰脂质体的溶酶体逃逸能力考察 将Cl-Lip与培养基的混合液加入至含有4T1细胞的6孔板中, 2 h后加入Lyso-Tracker使得其终质量浓度为1 μg·mL−1, 与细胞共孵育 30 min后, 将培养基吸出, 用PBS漂洗3次, 4%多聚甲醛固定30 min, 1 μg·mL−1 DAPI溶液染色5 min, 采用激光共聚焦观察Cl-Lip的溶酶体逃逸能力。
共修饰脂质体的肿瘤球穿透能力考察 在96孔板中加入2% 低分子量琼脂糖凝胶的培养基混悬液100 μL, 待其冷却形成凝胶。另在每孔中加入细胞混悬液(每孔细胞数为8 000个), 待其生长3天, 形成肿瘤球后备用。
将Cl-Lip与培养基的混合液加至含有肿瘤球的96孔板中, 与肿瘤球共孵育2 h后, 吸出肿瘤球, 用PBS漂洗3次, 4%多聚甲醛固定30 min后, 采用激光共聚焦观察Cl-Lip对肿瘤球的穿透能力。
数据处理 采用Excel 2013软件将数据录入, 求得平均值, 并进行双样本的t检验及方差分析, 实验数据用x ± s表示。
结果 1 共修饰脂质体的粒径和电位为了使所构建的共修饰脂质体Cl-Lip可有效地递送到肿瘤部位, 首先对其粒径和电位进行测定。由表 1和图 1可见, R8-Lip的粒径为 (98.6 ± 3.6) nm, PDI为0.267 ± 0.148; Cl-Lip的粒径为 (110.4 ± 5.2) nm, PDI为0.207 ± 0.039, 表明R8-Lip和Cl-Lip具有良好均一性。
|
|
Table 1 Size and zeta potential of different liposomes. n = 3, x ± s. R8-Lip: R8 peptide modified liposomes; Cl-Lip: R8 peptide and pH sensitive PEG co-modified liposomes |

|
Figure 1 Size (A) and zeta potential (B) of Cl-Lip |
R8-Lip的zeta电位为 (0.56 ± 0.08) mV, Cl-Lip的zeta电位为 (−3.46 ± 0.05) mV, 结果表明, 修饰pH敏感型的PEG后, Cl-Lip略带负电, pH敏感的PEG可以完全屏蔽穿膜肽R8的正电荷。
2 共修饰脂质体的体外血清稳定性为了模拟体内环境, 考察共修饰脂质体进入体内的血清稳定性, 本课题将脂质体与胎牛血清混合孵育, 并在不同时间点对其粒径进行测定, 考察其血清稳定性。由图 2可见, Cl-Lip在不同的时间点, 粒径均在110 nm左右, 且保持稳定, 说明该共修饰脂质体具有良好的血清稳定性。
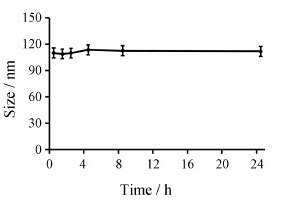
|
Figure 2 The size of Cl-Lip in 50% FBS at different time points. n = 3, x ± s |
pH敏感型PEG在不同条件下的水解程度是影 响Cl-Lip的入胞能力的重要因素。该pH敏感型PEG在不同pH的介质中和预孵育时间条件下会发生不同程度的水解使其断裂, 从而不同程度地暴露穿膜肽R8, 因此考察了Cl-Lip在不同的预孵育条件下4T1
细胞对Cl-Lip的摄取。由图 3可见, 在pH 7.4预孵育条件下, 随着预孵育时间的增加, 细胞对脂质体的摄取强度没有明显变化, 细胞对其的摄取强度都很弱; 在pH 6.0预孵育条件下, 随着预孵育时间的增加, 细胞对脂质体的摄取强度显著性增强。同时, 在pH 6.0预孵育条件下, 细胞对Cl-Lip的摄取强度均高于在pH 7.4同等条件下的摄取强度。当预孵育时间为 1 h时, 细胞对pH 6.0预孵育条件下的Cl-Lip摄取强度是pH 7.4条件下的2.35倍; 当预孵育时间为2 h时, 细胞对pH 6.0预孵育条件下的Cl-Lip摄取强度是pH 7.4条件下的3.87倍。此结果表明, 细胞对Cl- Lip的摄取呈pH依赖性和预孵育时间依赖性。由于在预孵育时间为2 h时, 细胞对pH 6.0预孵育条件下的Cl-Lip摄取强度较高, 且与pH 7.4条件下的摄取强度对比更为明显。因此, 本课题采用的预孵育时间为2 h。

|
Figure 3 The cellular uptake of Cl-Lip by 4T1 cells under different pre-incubation conditions detected by flow cytometry. n = 3, x ± s. P < 0.05 vs Cl-Lip (pH 7.4) groups; ΔP < 0.05 vs Cl-Lip (pH 6.0, 1 h) group |
本课题将不同的摄取途径抑制剂与细胞共孵育, 以考察共修饰脂质体Cl-Lip的入胞机制。其中氯丙嗪为网格蛋白介导的内吞途径抑制剂, 多聚赖氨酸为电荷依赖型的内吞途径抑制剂, 菲氯平为陷穴蛋白介导的内吞途径抑制剂, 秋水仙素为巨胞饮途径抑制剂, 叠氮钠为能量依赖型的内吞途径抑制剂, 4 ℃作为能量依赖型的内吞途径的抑制条件。
不同的摄取抑制剂对4T1细胞的摄取有不同的影响 (图 4), 在4 ℃条件下孵育对细胞摄取的抑制率为67.3%, 氯丙嗪、多聚赖氨酸、菲氯平、秋水仙素和叠氮钠对细胞摄取的抑制率分别为94.1%、30.5%、34.9%、27.0% 和47.1%。结果表明, Cl-Lip可通过多种途径入胞, 其中主要为网格蛋白介导 (氯丙嗪) 和能量依赖型 (叠氮钠) 的内吞途径。

|
Figure 4 The endocytosis inhibition assay of Cl-Lip preincubated in pH 6.0 on 4T1 cells detected by flow cytometry. n = 3, x± s. P < 0.05, **P < 0.01 vs control group |
由于溶酶体可以降解入胞后的脂质体, 降低治疗效果, 因此良好的溶酶体逃逸能力是保障脂质体发挥作用的关键性因素[20]。为此, 本课题将CFPE标记的Cl-Lip与4T1细胞共孵育后, 用Lyso-Tracker标记溶酶体, DAPI标记细胞核来考察该脂质体的溶酶体逃逸能力。如图 5所示, 绿色荧光代表CFPE标记的脂质体, 红色荧光代表Lyso-Tracker标记的溶酶体, 蓝色荧光代表DAPI标记的细胞核。在pH 7.4预孵育条件下, 细胞对Cl-Lip的摄取较弱, 没有在细胞内及周围显示出较强的绿色荧光, 无法判断当其入胞后是否可以与红色荧光标记的溶酶体重合, 没有表现出在该条件下Cl-Lip具有溶酶体逃逸能力。在pH 6.0预孵育条件下, 细胞对Cl-Lip的摄取显著性增强。根据荧光重叠图可以看出, 尽管有部分脂质体吸附在细胞膜的表面, 但是在溶酶体 (红色荧光) 周围也存在散在的绿色荧光, 说明该部分脂质体已摄取入胞, 且细胞内的绿色荧光没有与红色荧光重合, 表明在该条件下Cl-Lip入胞后并没有分布在溶酶体中, 具有较好的溶酶体逃逸能力。以上结果说明, 在低pH条件下, Cl-Lip具有较强的入胞能力和溶酶体逃逸能力, 入胞后可以避免溶酶体对其的降解, 为其进一步发挥作用提供保障。

|
Figure 5 Co-localization of liposomes, lysosomes and nuclei. The liposomes were labeled with 1, 2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-carboxy fluorescein (CFPE, green), lysosomes were stained with Lyso-Tracker (red), and the nuclei were stained with 4'-6-diamidino-2-pheylindole (DAPI, blue). Scale bars represent 10 μm |
由于体内肿瘤部位组织为多层细胞, 为了模拟其体内微环境, 本课题考查了Cl-Lip对肿瘤球的穿透能力。由图 6可见, Cl-Lip对肿瘤球的穿透能力呈显著的pH依赖性。在pH 7.4预孵育条件下, 在肿瘤球表面仅可以看到较弱的绿色荧光, 而在肿瘤球内部25 μm时, 已经无法观察到绿色荧光。结果说明, 在生理条件下Cl-Lip对肿瘤球的穿透能力较弱, 仅可以分布在其浅层的肿瘤细胞, 无法穿透进入其深层的细胞; 在pH 6.0预孵育条件下, Cl-Lip对肿瘤球的穿透能力显著性增强, 在肿瘤球表面可以看到较强的绿色荧光, 而在肿瘤球内部25 μm时, 仍然能观察到绿色荧光, 即使在肿瘤球内部50 μm时, 仍有较弱的绿色荧光。上述结果说明, 在体外模拟肿瘤组织的微酸环境下Cl-Lip不仅可以分布肿瘤球浅层的肿瘤细胞, 也穿透到达其深层的肿瘤细胞从而发挥较好的治疗效果。

|
Figure 6 CLSM images of penetration of CFPE labeled liposomes in 4T1 tumor spheroids within different depths. Scale bars represent 250 μm |
为了避免穿膜肽的组织选择性差的缺点, 结合PEG可以长循环的优点, 研究人员通过不同性质的化学键合成出各类环境响应型的PEG , 进而将此类PEG和穿膜肽共同修饰在给药系统中。付寒等[21]通过将二硫键引入PEG中, 合成出还原敏感型PEG , 进而构建了还原敏感型给药系统。通过利用谷胱甘肽使给药系统中的还原敏感型PEG在胞外断裂, 从而介导给药系统入胞。但是由于肿瘤组织胞外的谷胱 甘肽浓度较低[22], 无法通过胞外自身条件使得此化学键断裂, 因此往往需要给予外源性谷胱甘肽, 增加了该系统的不便。酶敏感型PEG断裂依赖于其酶浓度[23], 使得给药系统的应用受到限制。光敏感型PEG需要外源性光照使得PEG断裂, 其应用也不广泛。
由于在大多数实体瘤中, 胞外pH均较低, 当给药系统靶向至肿瘤部位后, 可以利用肿瘤部位自身环境使PEG中的化学键水解, 使得PEG从给药系统表面脱离, 通过穿膜肽入胞能力的介导给药系统发挥作用。与其他类型的PEG相比, pH敏感型PEG可以使给药系统“智能”化, 不需要外源性物质或光照, 且能广泛应用。因此, 本课题利用肿瘤部位弱酸性环境, 同时选取脂质体为给药系统, 构建了穿膜肽R8和pH敏感型PEG共修饰的脂质体。
在共修饰脂质体的构建中, 本课题将穿膜肽R8修饰在PEG上, 利用PEG的亲水性, 可以减少穿膜肽被网状内皮系统的摄取[19], 同时脂质体到达肿瘤部位后, 作为“桥梁”直接与细胞膜接触, 增加其介导脂质体入胞几率。另外, 将R8通过PEG连接在DSPE上, DSPE-PEG2K-R8作为磷脂材料直接修饰在脂质体上, 避免其在血液循环过程中脱离脂质体表面, 增加共修饰脂质体的稳定性。
通过渗透和EPR效应到达肿瘤部位发挥作用的被动靶向脂质体的粒径范围为100~200 nm[24]。实验表明, 本课题通过薄膜分散法制备的Cl-Lip粒径满足被动靶向脂质体的基本要求。与R8-Lip的zeta电位相比, Cl-Lip带有负电位, 表明所构建脂质体在pH 7.4条件下, 可以较好的屏蔽穿膜肽R8的正电荷。R8-Lip的正电荷较低可能是因为脂质体水化过程中选用pH 8.0的PBS, 该pH条件下PBS的弱碱性使得R8-Lip的正电荷略有下降。选取pH 8.0的PBS是为了避免保存过程中pH敏感型PEG中腙键的水解, 降低其对穿膜肽R8的屏蔽作用。同时, 体外血清稳定性实验表明, 该脂质体与血清混合后, 具有良好的稳定性, 主要是因为PEG可以屏蔽穿膜肽R8的正电荷, 减少血浆蛋白对其结合并提高稳定性, 为进一步的体内外靶向研究奠定了基础。
为了验证所构建共修饰脂质体的pH响应性, 本课题考察了在不同的pH预孵育条件下细胞对共修饰脂质体的摄取。结果表明, 在pH 6.0条件下, 细胞对Cl-Lip的摄取显著高于pH 7.4条件下的摄取, 说明在pH 7.4条件下穿膜肽R8被pH敏感型PEG屏蔽, 当pH降低后, pH敏感型PEG水解暴露穿膜肽R8, 使其介导入胞。因此, Cl-Lip具有良好的pH响应性。
穿膜肽介导的脂质体入胞有多种途径, 包括能量依赖型的内吞途径、电荷依赖型的内吞途径、巨胞饮途径、网格蛋白介导的内吞途径和陷穴蛋白介导 的内吞途径[25]。为了考察Cl-Lip以何种途径入胞, 本课题考察了其内吞途径。结果表明, Cl-Lip的主要入胞途径为网格蛋白介导的内吞途径和能量依赖型的内吞途径。有相关报道[13]表明R8-Lip的主要入胞途径为网格蛋白介导的内吞途径与巨胞饮途径。然而, 本实验结果表明Cl-Lip的入胞途径与R8-Lip的入胞途径略有差异, 其可能是因为弱酸性条件下尽管大部分pH敏感型PEG断裂, 但是残存在脂质体表面的PEG5K-Hz-PE会影响脂质体的入胞途径。
另外, 研究表明, 富含精氨酸穿膜肽修饰的纳米粒具有较强的溶酶体逃逸能力[26]。在pH 7.4条件下, 穿膜肽R8被pH敏感型PEG屏蔽, 无法介导其入胞, 因此细胞膜和细胞内的绿色荧光较弱, 无法考察其溶酶体逃逸能力的强弱; 在pH 6.0条件下, 当穿膜肽R8暴露后, Cl-Lip在穿膜肽的介导下入胞, 因此在细胞膜和细胞内的绿色荧光较强, 同时其入胞后表现出良好的溶酶体逃逸能力, 进而可以避免溶酶体对其降解, 保障其治疗作用的发挥。部分脂质体分布在细胞膜表面可能是因为带有正电的穿膜肽R8暴露后会吸附在带负电的细胞膜上。
为了模拟体内肿瘤组织环境, 本课题构建了肿瘤球, 并考察共修饰脂质体的肿瘤球穿透能力。结果表明, 在低pH条件下, 由于穿膜肽R8的暴露, Cl-Lip吸附在肿瘤球表面, 同时在穿膜肽R8的介导下可以穿透进入深层的肿瘤细胞发挥作用。说明Cl-Lip在体内弱酸环境下可以穿透进入深层肿瘤细胞发挥作用。
本研究初步证明了穿膜肽R8和pH敏感型PEG共修饰的脂质体具有良好的pH响应性, 在肿瘤组织微酸性环境下具有较强的入胞能力, 良好的溶酶体逃逸能力和较强的肿瘤球穿透能力, 是一种潜在的靶向药物传递系统。
| [1] | Zhang L, Yao HJ, Yu Y, et al. Mitochondrial targeting liposomes incorporating daunorubicin and quinacrine for treatment of relapsed breast cancer arising from cancer stem cells [J]. Biomaterials, 2012, 33: 565-582. |
| [2] | DeSantis CE, Lin CC, Mariotto AB, et al. Cancer treatment and survivorship statistics, 2014 [J]. CA Cancer J Clin, 2014, 64: 252-271. |
| [3] | Sharma G, Anabousi S, Ehrhardt C, et al. Liposomes as targeted drug delivery systems in the treatment of breast cancer [J]. J Drug Target, 2006, 14: 301-310. |
| [4] | Nichols JW, Bae YH. EPR: evidence and fallacy [J]. J Control Release, 2014, 190: 451-464. |
| [5] | Torchilin V. Tumor delivery of macromolecular drugs based on the EPR effect [J]. Adv Drug Deliv Rev, 2011, 63: 131-135. |
| [6] | Maeda H, Nakamura H, Fang J. The EPR effect for macromolecular drug delivery to solid tumors: improvement of tumor uptake, lowering of systemic toxicity, and distinct tumor imaging in vivo [J]. Adv Drug Deliv Rev, 2013, 65: 71-79. |
| [7] | Lim SB, Banerjee A, Önyüksel H. Improvement of drug safety by the use of lipid-based nanocarriers [J]. J Control Release, 2012, 163: 34-45. |
| [8] | Koren E, Apte A, Jani A, et al. Multifunctional PEGylated 2C5-immunoliposomes containing pH-sensitive bonds and TAT peptide for enhanced tumor cell internalization and cytotoxicity [J]. J Control Release, 2012, 160: 264-273. |
| [9] | Hatakeyama H, Akita H, Harashima H. A multifunctional envelope type nano device (MEND) for gene delivery to tumours based on the EPR effect: a strategy for overcoming the PEG dilemma [J]. Adv Drug Deliv Rev, 2011, 63: 152-160. |
| [10] | Yuan W, Kuai R, Cai W, et al. Increased delivery of doxorubicin into tumor cells using extracellularly activated TAT functionalized liposomes: in vitro and in vivo study [J]. J Biomed Nanotechnol, 2014, 10: 1563-1573. |
| [11] | Yin Y, Wu X, Yang Z, et al. The potential efficacy of R8-modified paclitaxel-loaded liposomes on pulmonary arterial hypertension [J]. Pharm Res, 2013, 30: 2050-2062. |
| [12] | Gao H, Zhang Q, Yu Z, et al. Cell-penetrating peptide-based intelligent liposomal systems for enhanced drug delivery [J]. Curr Pharm Biotechnol, 2014, 15: 210-219. |
| [13] | Tang J, Fu H, Kuang Q, et al. Liposomes co-modified with cholesterol anchored cleavable PEG and octaarginines for tumor targeted drug delivery [J]. J Drug Target, 2014, 22: 313-326. |
| [14] | Kuai R, Yuan W, Qin Y, et al. Efficient delivery of payload into tumor cells in a controlled manner by TAT and thiolytic cleavable PEG co-modified liposomes [J]. Mol Pharm, 2010, 7: 1816-1826. |
| [15] | Medina OP, Haikola M, Tahtinen M, et al. Liposomal tumor targeting in drug delivery utilizing MMP-2-and MMP-9-binding ligands [J]. J Drug Deliv, 2011, 2011: 160515. |
| [16] | Fleige E, Achazi K, Schaletzki K, et al. pH-Responsive dendritic core–multishell nanocarriers [J]. J Control Release, 2014, 185: 99-108. |
| [17] | Liu J, Huang Y, Kumar A, et al. pH-Sensitive nano-systems for drug delivery in cancer therapy [J]. Biotechnol Adv, 2014, 32: 693-710. |
| [18] | Felber AE, Dufresne MH, Leroux JC. pH-Sensitive vesicles, polymeric micelles, and nanospheres prepared with polycarboxylates [J]. Adv Drug Deliv Rev, 2012, 64: 979-992. |
| [19] | Wang H, Jia H, Cheng S, et al. PEG-stabilized micellar system with positively charged polyester core fast pH-responsible drug release [J]. Pharm Res, 2012, 29: 1582-1594. |
| [20] | Chen Y, Liu L. Modern methods for delivery of drugs across the blood-brain barrier [J]. Adv Drug Deliv Rev, 2012, 64: 640-665. |
| [21] | Fu H, Hu GL, He Q. Preparation of cell penetrating peptide TAT and cleavable PEG co-modified liposomes loaded with paclitaxel and its in vitro apoptosis assay [J]. Acta Pharm Sin (药学学报), 2014, 49: 1054-1061. |
| [22] | Yen HC, Cabral H, Mi P, et al. Light-induced cytosolic activation of reduction-sensitive camptothecin-loaded polymeric micelles for spatiotemporally controlled in vivo chemotherapy [J]. ACS Nano, 2014, 8: 11591-11602. |
| [23] | Wan Y, Han J, Fan G, et al. Enzyme-responsive liposomes modified adenoviral vectors for enhanced tumor cell transduction and reduced immunogenicity [J]. Biomaterials, 2013, 34: 3020-3030. |
| [24] | Zong T, Mei L, Gao H, et al. Synergistic dual-ligand doxorubicin liposomes improve targeting and therapeutic efficacy of brain glioma in animals [J]. Mol Pharm, 2014, 11: 2346-2357. |
| [25] | Zhang Q, Tang J, Fu L, et al. A pH-responsive α-helical cell penetrating peptide-mediated liposomal delivery system [J]. Biomaterials, 2013, 34: 7980-7993. |
| [26] | Liu Y, Ran R, Chen J, et al. Paclitaxel loaded liposomes decorated with a multifunctional tandem peptide for glioma targeting [J]. Biomaterials, 2014, 35: 4835-4847. |
 2015, Vol. 50
2015, Vol. 50


