随着生命科学理论的丰富, 以基因克隆、DNA重组为代表的分子生物学及生物技术体系得到了极大的发展。在此基础之上研发的蛋白质药物, 特别是重组蛋白和抗体等药物发展迅速, 为个体化医疗提供了极为有效的治疗手段。由于这类药物特异性好、疗效明显, 带来了巨大的经济效益。目前已有大量的蛋白质药物 (EPO、胰岛素、单克隆抗体[1]等) 在实际治疗中起到了非常重要的作用。Amgen、Genentech 为首的生物制药公司年销售额迅速超过百亿美元。蛋白质类药物迎来一个飞速发展的时期。
蛋白质药物的飞速发展对蛋白质药物分析提出了日益紧迫的挑战。不同于传统小分子药物, 蛋白质药物具有极大的复杂性[2]。这一复杂性除了包含蛋白
质药物的氨基酸序列、构型外, 蛋白质翻译后修饰也是一个非常重要的方面[3]。蛋白质的翻译后修饰涵盖了蛋白质的磷酸化、乙酰化以及糖基化等。这些翻译后修饰会对蛋白质的结构、活性产生巨大的影响, 甚至逆转蛋白质的活性。为了保证蛋白质药物的活性与药效的可控, 对蛋白质药物的均质性进行有效的控制是蛋白质药物生产与分析过程中非常重要的方面, 这其中就必然包含对蛋白质翻译后修饰的质控。相对于磷酸化、乙酰化, 糖基化由于其对蛋白质结构与活性影响的显著性, 近年来受到了越来越多的重视。由于N-糖基化的普遍性和修饰N-糖结构的多样性, N-糖基化被普遍作为蛋白质均质性的重要考察项目。由于蛋白质N-糖结构上的一些特点对现有的分析方法形成了巨大的挑战。首先由于N-糖结构复杂, 为了获得可靠的数据需要将蛋白质修饰的N-糖进行水解与纯化, 而后进行分析。这一过程非常复杂、费时, 同时还有可能对寡糖结构产生一定的破坏[4], 从而限制了目前蛋白质糖基化分析的效率与可靠性。为了解决糖蛋白N-糖分离、纯化过程复杂的问题, 同时保证处理过程中N-糖结构的完整, 近年来大量工作用于开发新的N-糖分离、纯化方法以简化N-糖处理过程, 提高处理效率, 避免N-糖结构的破坏[5]。但是目前大部分N-糖处理方式均基于固相微萃取 (SPE) 技术, 该类处理方式洗脱过程复杂, 耗时较长, 并需使用低pH洗脱液, 仍旧存在N-糖结构被破坏的可能, 同时也不易于实现样品的高通量处理。相比于SPE技术, 超滤技术由于其效率高、操作简便、通量高, 被广泛应用于低丰度糖蛋白的富集[6]及酶解后N-糖的分离、纯化[7], 而且超滤在简便性、处理通量、处理效率方面具有明显的优势。除此之外, N-糖较差的光学与质谱响应所导致的低灵敏度和复杂的基质效应也限制低丰度N-糖的分析, 制约了N-糖分析的有效性[8]。
为了解决以上问题, 本文基于超滤反应器对N-糖酶解与分离纯化过程进行整合, 开发一种新的蛋白质N-糖水解、分离、纯化的方式, 有效缩短了样品处理时间, 提高了处理效率与速度, 避免了处理过程中对N-糖结构的破坏, 提高了N-糖的提取效率。结合HPLC-HRMS分析方法, 建立了一套高效、快速, 适应于蛋白质药物N-糖的分析方法。
材料与方法仪器与药品 采用Dionex Ultimate3000 UPLC (Sunnyvale, CA, USA) 系统与Thermo Q Exactive (Bremen, Germany) 高分辨质谱联用对衍生化的样品进行分析。所用色谱柱为Waters Xbridge Amide (150 mm × 2.3 mm, 1.7 μm) (Milford, MA, USA) 以HILIC模式分离[9]。
核糖核酸酶B、肽N-糖苷酶F (PNGase F, 500 000 U·mL−1)、α-酸性糖蛋白购自NEB (Ipswich, MA, USA)。转铁蛋白、卵清白蛋白、二硫苏糖醇、碘乙酰胺、碳酸氢铵和乙酸购自Sigma Aldrich (St. Louis, MO, USA)。Oasis SPE萃取小柱购自Waters (Milford, MA, USA)。Nanosep超滤离心管购自PALL (Port Washington, NY, USA)。本文中所涉及的溶剂均为HPLC-MS以上纯度。衍生化试剂2, 4-双 (二乙胺基)-1, 3, 5-三嗪由本实验室合成。
糖蛋白PNGase F酶解 传统酶解方法: 将一定量糖蛋白置于1.5 mL离心管中, 加入碳酸氢铵缓冲液 (20 mmol·L−1) 100 μL稀释, 加入二硫苏糖醇溶 液 (100 mmol·L−1) 2.5 μL, 65 ℃温浴1 h, 加入碘乙 酰胺溶液 (100 mmol·L−1) 10 μL, 20 ℃避光温浴1 h, 加入二硫苏糖醇溶液2.5 μL、碳酸氢铵缓冲液150 μL、PNGase F 1 μL, 37 ℃温浴18 h。酶解后的样品进一 步进行分离、纯化。
基于超滤反应器的酶解方法: 将一定量糖蛋白置于超滤反应器中, 加入碳酸氢铵缓冲液 (20 mmol·L−1) 100 μL稀释, 加入二硫苏糖醇溶液 (100 mmol·L−1) 2.5 μL, 65 ℃温浴1 h, 加入碘乙酰胺溶 液 (100 mmol·L−1) 10 μL, 20 ℃避光温浴1 h。10 000 r·min−1离心15 min, 弃去滤液。加入碳酸氢铵缓冲液200 μL, 10 000 r·min−1离心15 min, 弃去滤液, 重复 2次。加入碳酸氢铵缓冲液150 μL、PNGase F 1 μL, 37 ℃温浴18 h。酶解后的样品进一步进行分离、纯化。
N-糖分离、纯化 传统方法酶解的样品通过SPE分离除去蛋白质与其他小分子, 得到的寡糖浓缩至干, 得N-糖样品[10]。
反应完成后的超滤反应器10 000 r·min−1离心15 min, 收集滤液, 加入碳酸氢铵缓冲液200 μL洗涤, 合并滤液, 浓缩至干, 得N-糖样品。
N-糖衍生化 N-糖样品加入衍生化溶液 (30 mg·mL−1 2, 4-双 (二乙胺基)-1, 3, 5-三嗪异丙醇溶液∶10%甲酸∶水, 7∶1∶2) 10 μL, 37 ℃温浴2 h。加入乙腈10 μL, 13 000 r·min−1高速离心15 min, 取上清液, 进行UPLC-HRMS分析。
N-糖UPLC-HRMS条件 乙腈为流动相A, 20 mmol·L−1碳酸氢铵为流动相B, 流速为0.4 mL·min−1。初始流动相比例为20%流动相A; 在15 min内升至50% 流动相A; 保持该比例洗脱5 min; 在2 min内 回到初始比例, 并保持3 min。质谱扫描范围为m/z 800~3 000 (70 000分辨率), 正离子扫描模式。应用HESI离子源完成样品离子化。离子源参数设计如下: 辅助气35 arb; 喷雾电压3.2 kV; 源温320 ℃。
结果与讨论 1 核糖核酸酶B N-糖提取效率核糖核酸酶B由于其糖基化水平较高, N-糖基 化位点单一, N-糖结构简单, 通常作为N-糖基化分 析的标准样品。通过比较基于超滤反应器的N-糖样品制备方式与常规的SPE制备方式处理7种高甘露N-糖型的UPLC-HRMS分析结果, 考察了新型样品处理方式的提取效率。如图 1所示, 经过超滤反应器与传统方法处理的核糖核酸酶B的N-糖在UPLC- HRMS分析后得到了几乎完全一致的色谱图。这一 结果说明新的样品处理方式与传统方法一样, 能够将核糖核酸酶B的7种N-糖提取出来。考察了核糖核酸酶B分别经过超滤反应器与传统方法处理后N-糖的丰度。如表 1所示, 超滤反应器处理方法与传统SPE方法对于核糖核酸酶B中的7种N-糖 (M5、M6、M7-1、M7-2、M8-1、M8-2、M9) 的提取效率相当, 结果说明新方法可以替代传统方法。但是如图 1中所 示, 超滤反应器处理的样品相比SPE方法更有效地避免部分水溶性多肽的影响, 同时超滤反应器处理方法在处理时间上有显著优势。由于避免了复杂的SPE纯化过程 (一般需要0.5~1 h), 加快了样品处理的速度, 提高了N-糖分析方法的通量。
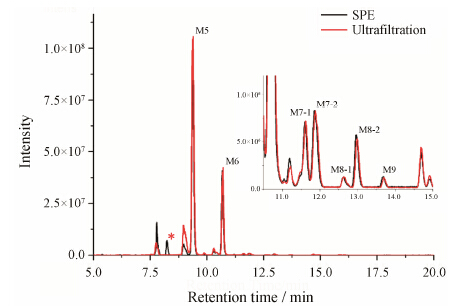
|
Figure 1 HPLC-MS RNase B N-glycans BPC profiles. The peak associated with hydrophilic peptides was marked by * |
|
|
Table 1 RNase B N-glycans extraction efficiency. Bio-sample was divided into two vials equally, and treated with ultrafiltration and SPE separately. The efficiency was calculated by the N- glycans abundances with different pretreatments |
在蛋白质N-糖分析中, 绝大部分糖蛋白中的N-糖均非单一的高甘露糖型, 大部分N-糖结构中均含有N-乙酰葡萄糖胺单元。N-乙酰葡萄糖胺单元的存在很大程度上改变了N-糖的亲水性, 为了考察含N-乙酰葡萄糖胺结构的N-糖经过不同提取方法的提取效率, 分别采用超滤与SPE方法对卵清白蛋白进行了处理。如图 2所示, 与核糖核酸酶B的结果不完全相同的是, 有部分N-糖经过超滤方法提取的峰面积明显高于传统SPE方法。如表 2所示, 通过考察保留时间不同的4种含N-乙酰葡萄糖胺的N-糖, 基于超滤的方法针对此类N-糖在提取效率上比SPE方法具有明显的优势, 4种卵清白蛋白N-糖超滤提取与传统提取的峰面积比值为1.13~1.18。由于此类富含N-乙酰葡萄糖胺结构的N-糖的亲水性相对较弱, 有部分在传统方法中反相SPE柱上保留, 导致了最终提取率的降低。而基于超滤的处理方式有效避免了这种损失, 从而提高了提取效率。同时如图 2中所示, 新的处理方法在卵清白蛋白N-糖提取中亦有效避免了水溶性多肽的影响。
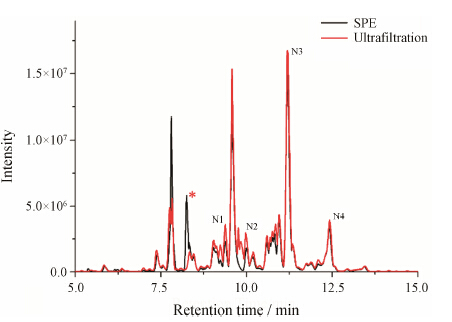
|
Figure 2 HPLC-MS ovalbumin N-glycans BPC profiles. The peak associated with hydrophilic peptides was marked by */span> |
|
|
Table 2 Ovalbumin N-glycans extraction efficiency. Bio- sample was divided into two vials equally, and treated with ultrafiltration and SPE separately. The efficiency was calculated by the N-glycans abundances with different pretreatment |
含有唾液酸结构的N-糖由于其结构的不稳定性, 是N-糖分析所面临的挑战之一。N-糖中唾液酸结构对样品处理的pH值与温度都有着严格的要求, 较高温度与酸度极易发生水解, 直接影响含有唾液酸结构的N-糖检测结果的可靠性。为了考察基于超滤的新处理方法对于此类N-糖的提取效率, 分别应用超滤与SPE的处理方法对α-酸性糖蛋白 (含大量唾液酸修饰的N-糖) 进行了处理。如图 3所示, 基于超滤的处理方法在提取效率方面具有显著的优势。如表 3所示, 基于超滤方法的此类N-糖的提取效率比SPE方法有显著提高, 8种含唾液酸结构N-糖超滤提取与传统提取的峰面积比值为1.19~2.09。提取效率随着N-糖结构的复杂化有着进一步的提高。这很可能是由于复杂结构N-糖中的唾液酸相比较于简单结构N-糖中唾液酸结构更不稳定。而在SPE过程中由于会应用相对高浓度的乙酸, 在SPE处理的过程中含有唾液酸结构的N-糖会发生脱唾液酸反应, 从而脱去部分唾液酸单元, 导致提取效率的降低。基于超滤的处理过程中, 并不需要应用高浓度的酸溶液, 且在处理时间上有着明显的降低 (30 min), 进而有效避免脱唾液酸反应的发生, 保证了提取效率。就含有唾液酸单元的N-糖而言, 基于超滤的处理方法有着明显的改进, 有效地保证了N-糖分析结果的可靠性。
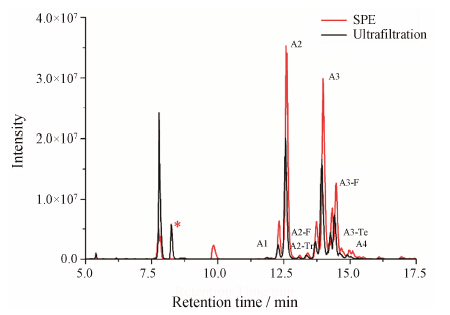
|
Figure 3 HPLC-MS α-acidglycoprotein N-glycans BPC profiles. The peak associated with hydrophilic peptides was marked by * |
|
|
Table 3 α-Acidglycoprotein N-glycans extraction efficiency. Bio-sample was divided into two vials equally, and treated with ultrafiltration and SPE separately. The efficiency was calculated by the N-glycans abundances with different pretreatment |
通过综合考察基于超滤反应器的N-糖的处理方法对于不同结构N-糖的提取效率, 作者发现新的处理方法有效缩短了N-糖处理的时间, 提高了N-糖处理效率, 并可以有效去除N-糖样品中的水溶性多肽。针对含不同结构单元的N-糖, 相比传统SPE方法, 基于超滤的新处理方法对含有N-乙酰葡萄糖和唾液酸结构的N-糖具有更高的提取效率, 同时抑制了N-糖结构的降解。基于超滤的新方法将N-糖酶解与后续的分离、纯化实现了有机的结合, 有效提高N-糖的提取效率, 缩短处理时间, 提高了通量, 抑制了可能发生的不良反应, 保证蛋白质药物N-糖分析的效率与有效性。通过与HPLC-HRMS的联用, 本文开发了一种高效、可靠, 适合蛋白质药物的N-糖基化修饰分析方法。
| [1] | Gennaro LA, Salas-Solano O. On-line CE-LIF-MS technology for the direct characterization of N-linked glycans from therapeutic antibodies [J]. Anal Chem, 2008, 80: 3838-3845. |
| [2] | Ongay S, Neususs C. Isoform differentiation of intact AGP from human serum by capillary electrophoresis-mass spectrometry [J]. Anal Bioanal Chem, 2010, 398: 845-855. |
| [3] | Han H, Livingston E, Chen X. High throughput profiling of charge heterogeneity in antibodies by microchip electrophoresis [J]. Anal Chem, 2011, 83: 8184-8191. |
| [4] | Bigge JC, Patel TP, Bruce JA, et al. Nonselective and efficient fluorescent labeling of glycans using 2-amino benzamide and anthranilic acid [J]. Anal Biochem, 1995, 230: 229-238. |
| [5] | Zhu J, Wang F, Chen R, et al. Centrifugation assisted microreactor enables facile integration of trypsin digestion, hydrophilic interaction chromatography enrichment, and on-column deglycosylation for rapid and sensitive N-glycoproteome analysis [J]. Anal Chem, 2012, 84: 5146-5153. |
| [6] | Song Y, Choi MH, Park JN, et al. Engineering of the yeast Yarrowia lipolytica for the production of glycoproteins lacking the outer-chain mannose residues of N-glycans [J]. Appl Environ Microb, 2007, 73: 4446-4454. |
| [7] | Anders JB, Barry RO, Shilpa RS, et al. Cyanovirin-N defines a new class of antiviral agent targeting N-linked, high-mannose glycans in an oligosaccharide-specific manner [J]. Mol Pharmacol, 2001, 59: 949-954. |
| [8] | Ruhaak LR, Zauner G, Huhn C, et al. Glycan labeling strategies and their use in identification and quantification [J]. Anal Bioanal Chem, 2010, 397: 3457-3481. |
| [9] | Melmer M, Stangler T, Schiefermeier M, et al. HILIC analysis of fluorescence-labeled N-glycans from recombinant biopharmaceuticals [J]. Anal Bioanal Chem, 2010, 398: 905-914. |
| [10] | Zhuang ZX, Mitra I, Hussein A, et al. Microchip electrophoresis of N-glycans on serpentine separation channels with asymmetrically tapered turns [J]. Electrophoresis, 2011, 32: 246-253. |
 2015, Vol. 50
2015, Vol. 50