2. 安徽省中医药科学院药物化学研究所, 安徽 合肥 230031
2. Institute of Pharmaceutical Chemistry, Anhui Academy of Chinese Medicine, Hefei 230031, China
近年来, 因恶性肿瘤致死的人数逐年增加[1, 2], 肿瘤细胞的侵袭与迁移是恶性肿瘤最重要的生物学特征, 也是恶性肿瘤难以治愈的主要原因[3, 4], 在此过程中, 肿瘤细胞首先获得侵袭表型, 再黏附到组织的细胞外基质 (ECM) 上形成复合物[5, 6, 7], 通过分泌蛋白酶降解ECM的主要成分胶原而侵入组织, 进一步迁移并增殖为继发性肿瘤。因此, 降解ECM的过程是恶性肿瘤侵袭与迁移的主要标志[8]。通过抑制肿瘤细胞的侵袭与迁移达到抑制其在体内扩散的目的, 是临床治疗恶性肿瘤重要而有效的手段[9, 10]。
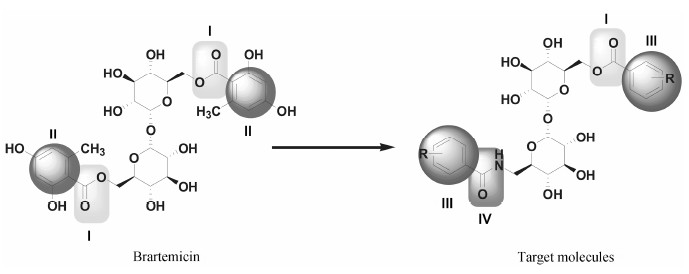
从放线菌Nonomuraea代谢物中分离得到的天然海藻糖衍生物brartemicin (图 1) 具有良好地抑制结肠癌26-L5细胞侵袭的能力, 且对该细胞表现出低细胞毒性[11]。为进一步研究结构多样性海藻糖衍生物 的相关生物活性, 获得更好抗肿瘤侵袭与迁移活性且低毒的先导化合物, 本课题组以brartemicin为先导物, 根据生物电子等排原理, 将brartemicin分子结构中对称二酯基中的一个酯基 (Ⅰ) 转变成具有氢键供体作用且更具结构稳定性的酰胺基 (Ⅳ); 鉴于生物活性分子中引入不同种类的取代基可改变分子的电性、立体化学等性质, 从而影响药物的生物活性及毒性等, 进一步将brartemicin结构中2, 4-二羟基- 6-甲基苯基 (Ⅱ) 转变为在不同位置含不同类型取代基的芳基 (Ⅲ), 设计并合成了15个具有不对称结构的新型天然海藻糖衍生物 (图 1)。
|
Figure 1 The structures of brartemicin and target molecules |
目标化合物的合成以二水合D-海藻糖 (1) 为原料, 经羟基保护、选择性脱保护基、与含不同取代基的苯甲酸发生Mitsunobu反应以及羧酸与胺的缩合等反应制得目标化合物, 如合成路线1所示。
以MTT法检测目标化合物对肺癌A549、肝癌HepG2和正常人脐静脉内皮细胞HUVEC增殖的影响。在此基础上, 利用Matrigel黏附实验测试了目标化合物对A549和HepG2细胞的黏附能力的影响, 并进一步选用Transwell小室法考察了目标化合物对上述两种肿瘤细胞侵袭与迁移能力的影响。并对目标化合物的构效关系进行了初步探讨。

|
Reagents and conditions: (i) TMSCl, Py, 24 h; (ii) CH3COOH, CH3OH, 10 ℃, 18 h, 78%; (iii) ArCOOH, DIAD, Ph3P, 12 h, 80%−91%; (iv) CH3COOH, CH3OH, H2O, reflux, 4 h, 72%−89%; (v) TsCl, Py (cat.), 24 h, 71%−79%; (vi) NaN3, reflux, 14 h, 74%−81%; (vii) Ph3P, THF, H2O, 24 h, 78%−87%; (viii) ArCOOH, HATU, Py, 4 h, 62%−77%. Scheme 1 Synthetic route of trehalose derivatives |
中间体3是合成目标化合物的关键中间体, 以三苯甲基、叔丁基二甲基硅基、乙酰基等保护原料1结构中醇羟基时, 均不能选择性脱保护基得中间体3。作者以三甲基氯硅烷 (TMSCl) 与原料1反应所得产物无需提纯, 在氮气环境, 控制温度在10 ℃以下反应, 并以石油醚对反应混合体系进行反复萃取, 可以较高收率得中间体3 (收率78%)。以Mitsunobu反应合成中间体4~18时, 较易形成双酯副产物, 重复实验表明, 将醇首先与偶氮二甲酸二异丙酯 (DIAD)/三苯基膦 (Ph3P) 混合, 然后在冰浴下滴加稍过量 (1.2 eq) 的取代苯甲酸, 能有效减少双酯副产物。还原叠氮基生成中间体64~78时, 使用催化氢化法不仅收率低而且产物难以分离提纯, 当以三苯基膦/四氢呋喃/水体系进行还原时, 反应条件温和且后处理方便。目标化合物79~93的结构经1H NMR、MS和元素分析确证, 理化数据等见表 1和表 2。
|
|
Table 1 Structures and physical property of target compounds (79−93) |
|
|
Table 2 Spectral data of target compounds (79−93) |
以brartemicin为阳性对照, 选用不同浓度梯度 (1~64 μmol·L−1) 的待测物, 分别与人非小细胞肺癌A549、人肝癌细胞HepG2和人正常细胞HUVEC[12]共同孵育24 h后, 用MTT法检测其对细胞增殖的影响。结果显示, 在1~32 μmol·L−1浓度内, 目标物79~93和brartemicin对细胞增殖的抑制率与溶剂对照组比较均无显著性差异 (P > 0.05)。提示brartemicin及以其为先导物设计合成的目标物, 在此浓度范围对两种肿瘤细胞A549、HepG2和正常细胞HUVEC均未表现出细胞毒作用。将32 μmol·L−1的浓度水平, 作为后续药理活性测试的最大实验浓度值, 以排除因细胞增殖抑制对实验结果的影响。
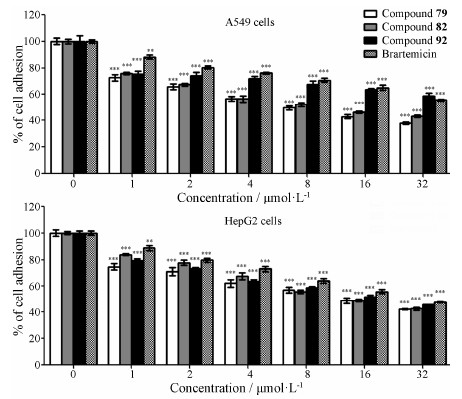
3 目标化合物对A549和HepG2细胞与Matrigel黏附能力的影响Matrigel的主要成分与ECM相近, 常通过人工重组用于模拟ECM, 作为研究肿瘤细胞与ECM黏附作用的分子模型。以brartemicin为阳性对照, 将不同浓度的待测物与肿瘤细胞共同孵育2 h, 再经重悬后的细胞与Matrigel黏附30 min, 采用MTT法检测其对肿瘤细胞与Matrigel黏附能力的影响。结果表明, 不同浓度的目标化合物79~93对A549和HepG2黏附抑制率分别介于1%~62% 和2%~58%。其中, 化合物79、82和92在所有实验浓度水平时, 对肿瘤细胞黏附的抑制率与溶剂对照组相比, 均存在显著性差异 (P < 0.05), 且抑制率随浓度的升高而增大。在32 μmol·L−1浓度水平时, brartemicin对A549细胞和HepG2细胞的黏附抑制率分别为44% 和52%; 化合物79、82和92对A549细胞黏附的抑制率分别为62%、57% 和41%, 对HepG2细胞黏附的抑制率分别为58%、57% 和54%, 实验结果见图 2 (纵坐标为黏附率, 抑制率 = 100% − 黏附率)。
|
Figure 2 Brartemicin and compounds 79, 82 and 92 inhibited adhesion of A549 and HepG2 cells. Cells were normal incubated with brartemicin and compounds 79, 82 and 92 for 2 h. MTT assay was used to observe the cells adhesion to Matrigel. Data was shown as mean ± SD of three independent experiments. **P < 0.01, ***P < 0.001 vs control (compound 0 μmol·L−1) |
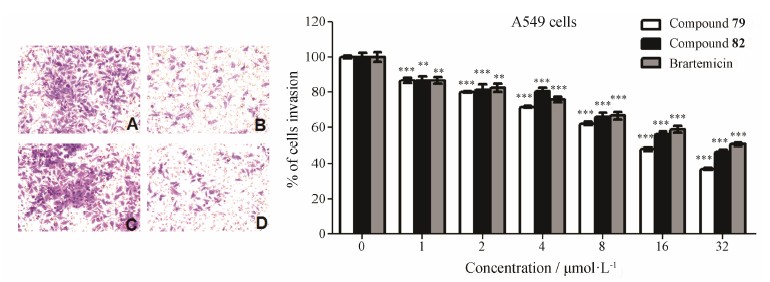
肿瘤细胞与ECM的黏附为细胞侵袭与迁移提供了条件, 细胞侵袭与迁移则是细胞黏附的后续与结果[7, 13]。 基于Matrigel黏附实验的结果, 以brartemicin为阳性对照, 以不同浓度的待测物与肿瘤细胞在Transwell小室中培育24 h, 进一步检测其对肿瘤细胞侵袭与迁移能力的影响。结果显示, 目标化合物79~93对两种肿瘤细胞侵袭与迁移具有不同程度地抑制作用, 并呈现出效应—剂量依赖关系 (图 3~5) (纵坐标为侵袭与迁移率, 抑制率 = 100% − 侵袭与迁移率)。在32 μmol·L−1浓度水平时, 仅化合物79和82对A549细胞迁移抑制率高于30% (分别为46% 和42%); 阳性对照组、化合物79和82对A549细胞侵袭抑制率分别为49%、63% 和53%, 对HepG2细胞的侵袭抑制率分别为39%、74% 和68%; 化合物92对HepG2细胞的侵袭抑制率为57%。
|
Figure 3 Brartemicin and compounds 79 and 82 inhibited invasion of A549 cells. Cells were dyed by 0.1% crystal violet and then randomly selected fields were photographed at 200×. The photos showed the stained invasion cells. A and C: Controls; B and D: 32 μmol·L−1. The stained cells of the lower surface were dissolved in 10% acetic acid. The effect of cells invasion was calculated through comparing the OD value of experimental groups and control groups by microplate reader. n = 3, x ± s. **P < 0.01, ***P < 0.001 vs control (compound 0 μmol·L−1) |

|
Figure 4 Brartemicin and compounds 79 and 82 inhibited migration of A549 cells. The photos showed the stained migration cells. A and C: Controls; B and D: 32 μmol·L−1. n = 3, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control (compound 0 μmol·L−1) |

|
Figure 5 Brartemicin and compounds 79, 82 and 92 inhibited invasion of HepG2 cells. The photos showed the stained invasion cells. A, C and E: Controls; B, D and F: 32 μmol·L−1. n = 3, x ± s. *P < 0.05, ***P < 0.001 vs control (compound 0 μmol·L−1) |
实验中采用间接计数法, 考察目标物对细胞侵袭与迁移的影响, 相较于直接计数法, 该法简便、可靠, 并可消除某些圆形贴壁细胞等对细胞计数的干扰。
5 小结本文设计并合成了15个新型结构的海藻糖衍生物, 药理活性筛选结果表明: 在1~32 μmol·L−1浓度内, 所有目标物对肿瘤细胞A549和HepG2及正常细胞HUVEC无细胞毒作用, 并对肿瘤细胞的黏附、侵袭与迁移能力具有不同程度的抑制作用。在6组梯度实验浓度中, 化合物79、82和92对肿瘤细胞的黏附均表现出良好的抑制能力, 化合物79、82对A549细胞侵袭与迁移以及化合物79、82和92对HepG2细胞侵袭均具有良好的抑制活性。
在32 μmol·L−1浓度水平上: ① 阳性对照组brartemicin对两种肿瘤细胞黏附的抑制作用均低于化合物79和82, 与化合物92抑制作用相当; ② 阳性对照组brartemicin对两种肿瘤细胞的侵袭抑制率均高于30%, 但对A549细胞的侵袭抑制作用低于化合物79和82; 对HepG2细胞侵袭抑制作用低于化合物79、82和92; 对两种肿瘤细胞迁移的抑制率则均低于30%; ③ 目标物结构中2-位或2-和3-位引入甲氧基 (化合物82或79), 对两种肿瘤细胞黏附的抑制作用, 以及对A549细胞侵袭与迁移和对HepG2细胞侵袭的抑制作用均优于其他位置的单取代或双取代芳基 (化合物80、81、83~87、89~93), 提示芳环2-位、3-位引入具有供电子作用的甲氧基时, 对提高目标物抗肿瘤细胞黏附、侵袭与迁移活性具有重要意义; ④ 将brartemicin结构中双酯基中的一个酯基以酰胺基替代, 仍可获得具有较好抑制肿瘤细胞黏附、侵袭或迁移活性的化合物 (化合物79、82和92), 提示同时存在的双酯基并不一定是此类海藻糖衍生物抗肿瘤活性所必需的结构。
本实验结果对进一步合理优化具有高效抗肿瘤细胞黏附、侵袭与迁移活性且低毒的海藻糖衍生物结构具有较好的指导意义, 进一步的作用机制研究正在进行中。
实验部分LCQ ADVANTAGE MAX液质联用质谱仪 (Finnigan公司), Bruker 300 MHz核磁共振仪 (TMS为内标), Perkin-Elmer 2400 Ⅱ型元素分析仪 (美国PE公司), 多功能酶标仪 (美国MD公司), 倒置荧光显微镜 (德国Leica公司)。所有药化和药理试剂均为市售, 吡啶和二氯甲烷需无水处理。
1 化学部分 1.1 2, 2', 3, 3', 4, 4', 6, 6'-八(三甲基硅基)-α, α-D-海藻糖 (2) 的合成将1 (4.5 g, 12.0 mmol) 溶于20 mL无水吡啶中, 冰浴冷却, 滴加三甲基氯硅烷 (15.0 mL, 118.8 mmol), 室温搅拌反应24 h后, 抽滤所得滤液直接用于下步反应。
1.2 2, 2', 3, 3', 4, 4'-六(三甲基硅基)-α, α-D-海藻糖 (3) 的合成上步所得液体中加入9 mL水−无水甲醇−冰醋酸 (体积比为5∶3∶1), 氮气保护下, 低温 (10 ℃以下) 搅拌反应18 h, 石油醚萃取多次, 有机相经饱和食盐水洗涤, 无水硫酸钠干燥, 过滤浓缩得无色油状液体3, 7.2 g, 收率78%。
1.3 6-羟基-6'-(2, 3-二甲氧基苯甲酰基)-2, 2', 3, 3', 4, 4'-六(三甲基硅基)-α, α-D-海藻糖 (4) 的合成将中间体3 (7.2 g, 9.3 mmol) 溶于10 mL无水二氯甲烷中, 冰浴冷却, 加入10 mL含三苯基膦 (2.5 g, 9.5 mmol) 和DIAD (1.9 mL, 9.5 mmol) 的无水二氯甲烷溶液搅拌1 h。滴加10 mL含2, 3-二甲氧基苯甲酸 (1.4 g, 7.9 mmol) 的无水二氯甲烷溶液, 常温搅拌反应12 h, TLC检测反应结束。减压蒸除溶剂, 用乙酸乙酯萃取, 有机相依次用饱和碳酸氢钠、饱和食盐水洗涤, 无水硫酸钠干燥, 过滤浓缩, 得淡黄色油状液体4, 7.5 g, 收率86%。同法制得中间体5~18。
1.4 6-羟基-6'-(2, 3-二甲氧基苯甲酰基)-α, α-D-海藻糖 (19) 的合成将中间体4 (7.5 g, 8.0 mmol) 溶于40 mL水−甲醇 (体积比为5∶3) 混合溶剂中, 加入0.5 mL冰醋酸, 回流4 h后浓缩反应液, 乙酸乙酯萃取, 有机相经饱和食盐水洗涤, 无水硫酸钠干燥, 过滤浓缩得黄色油状液体, 柱色谱 (石油醚−乙酸乙酯 = 12∶1~3∶1) 梯度洗脱, 乙酸乙酯重结晶得白色固体19, 3.5 g, 收率87%, mp 152~153 ℃。同法制得中间体20~33。
1.5 6-(4-甲基苯磺酰基)-6'-(2, 3-二甲氧基苯甲酰基)-α, α-D-海藻糖 (34) 的合成将中间体19 (3.0 g, 6.1 mmol) 溶于10 mL无水二氯甲烷, 加入2 mL无水吡啶, 冰浴下滴加10 mL含对甲苯磺酰氯 (1.5 g, 7.9 mmol) 的无水二氯甲烷溶液, 常温搅拌反应24 h, TLC检测反应完毕后, 加入30 mL水稀释反应液, 再用乙酸乙酯萃取, 有机相经饱和食盐水洗涤, 无水硫酸钠干燥, 过滤浓缩得黄色油状液体34, 2.9 g, 收率74%。同法制得中间体35~48。
1.6 6-叠氮基-6'-(2, 3-二甲氧基苯甲酰基)-α, α-D-海藻糖 (49) 的合成
将中间体34 (2.9 g, 4.4 mmol) 溶于30 mL无水二氯甲烷, 加入过量NaN3 (0.4 g, 6.6 mmol) , 氮气保护, 60 ℃搅拌回流反应14 h, 冷却后加入20 mL冰水, 剧烈搅拌10 min, 浓缩反应液, 用乙酸乙酯萃取, 有机相经饱和食盐水洗涤, 无水硫酸钠干燥, 过滤浓缩得黄色油状液体49, 1.9 g, 收率80%。同法制得中间体50~63。
1.7 6-氨基-6'-(2, 3-二甲氧基苯甲酰基)-α, α-D-海藻糖 (64) 的合成将中间体49 (1.9 g, 3.5 mmol) 溶于40 mL四氢呋喃−水 (体积比为3∶1) 中, 加入三苯基膦 (1.1 g, 4.0 mmol) 常温反应24 h, TLC检测反应结束, 浓缩反应液, 用乙酸乙酯萃取, 有机相经饱和食盐水洗涤, 无水硫酸钠干燥, 过滤浓缩滤液得橙黄色油状液体64, 1.5 g, 收率84%。同法制得中间体65~78。
1.8 6-(2, 3-二甲氧基苯甲酰基)-6'-(2, 3-二甲氧基苯甲酰基)-α, α-D-海藻糖 (79) 的合成将中间体64 (1.5 g, 3.0 mmol) 溶于20 mL无水二氯甲烷中, 冰浴冷却, 依次加入2, 3-二甲氧基苯甲酸 (0.6 g, 3.3 mmol)、0.5 mL吡啶和2-(7-偶氮苯并三氮唑)-N, N, N ', N '-四甲基脲六氟磷酸酯 (HATU) (1.1 g, 3.3 mmol), 常温搅拌反应4 h, TLC检测反应结束后, 浓缩反应液, 用乙酸乙酯萃取, 有机相依次经饱和碳酸氢钠溶液、饱和食盐水洗涤, 无水硫酸钠干燥, 过滤浓缩得橙黄色油状液体, 柱色谱 (石油醚−乙酸乙酯 = 9∶1~3∶1) 梯度洗脱, 乙酸乙酯重结晶得到白色固体79, 1.4 g, 收率71%。同法制得化合物80~93。
2 活性评价 2.1 细胞培养、实验分组及数据处理选取人肺癌A549、人肝癌HepG2和人脐静脉内皮细胞HUVEC细胞, 用含10% 胎牛血清的改良型1640培养液, 于37 ℃、5% CO2的培养箱中培养并传代, 取对数期的细胞用于实验。以不同浓度待测物处理细胞作为实验组, 以溶解待测物的溶剂处理细胞为溶剂对照组。结果数据采用SPSS 17.0单因素方差分析的LSD-t检 验 (方差齐时) 或Dunnett-t检验(方差不齐时) 分析, 并对不同浓度的实验组和溶剂对照组进行比较。
2.2 目标化合物对HepG2、A549和HUVEC细胞增殖的影响将细胞用0.25% 胰酶消化后用含血清的培养液制成每毫升5.0×104单细胞悬液, 以每孔100 μL接种于96孔板中培育过夜。待细胞贴壁后加入100 μL待测物 (实验浓度分别为1、2、4、8、16、32和64 μmol·L−1), 同时设置溶剂对照组和调零组 (未加入细胞和待测物), 每组各设6个复孔。待测物与细胞作用24 h后, 每孔加入5 mg·mL−1的MTT 20 μL继续孵育4 h, 吸弃上清液, 每孔加入DMSO 150 μL, 摇床振荡20 min, 用多功能酶标仪在490 nm波长处测出各组的OD值, 并以570 nm为参考波长, 比较不同浓度待测物对细胞增殖的影响。重复实验3次。按公式: 存活率= (实验组OD均值−调零组OD值)/(溶剂对照组OD均值−调零组OD均值)×100%, 计算细胞存活率, 抑制率= 100%−存活率。
2.3 目标化合物对A549和HepG2与Matrigel黏附能力的影响将Matrigel于无血清培养液按体积比1∶9稀释配制成Matrigel稀溶液, 并按每孔50 μL加入96孔板中, 4 ℃冰箱水平静置处理过夜, 次日放入培养箱中3 h, 取出放入超净台中风干4 h, 吸弃上清液待用。将不同浓度待测物 (实验浓度分别为1、2、4、8、16和32 μmol·L−1) 与肿瘤细胞培育2 h, 再经重悬后的细胞 (细胞密度为每毫升2.0×105) 按每孔100 μL接种于预先已包裹Matrigel稀溶液的96孔板中, 同时设置溶剂对照组, 每组各设6个复孔。继续培养30 min后, 吸弃培养液并用PBS小心清洗3次, 加入100 μL含10% MTT的无血清培养液, 置于培养箱中培育4 h, 吸弃上清液, 每孔加入DMSO 150 μL, 摇床振荡20 min, 在570 nm波长处测出各组的OD值, 并以630 nm为参考波长, 比较不同浓度待测物对肿瘤细胞与Matrigel黏附的抑制作用。重复实验3次。按公式: 黏附率= (实验组OD均值/溶剂对照组OD均值)×100%, 计算肿瘤细胞黏附率, 抑制率= 100%−黏附率。
2.4 目标化合物对A549和HepG2细胞侵袭与迁移能力的影响将细胞消化并配制成每毫升2.0×105单细胞悬液, 按每孔100 μL接种于预先包裹Matrigel稀溶液的Transwell小室 (孔径为8 μm) 中, 加入等体积的待测物 (实验浓度分别为1、2、4、8、16和32 μmol·L−1), 同时设置溶剂对照组, 每组各设3个复孔。小室下面加入600 μL含20% 血清的培养液作为趋化因子, 小室放置于培养箱中孵育24 h。取出小室, 弃去小室内的培养液, 将小室内未侵袭的细胞用棉签小心擦去, 穿过聚碳酯膜的细胞用4% 多聚甲醛固定30 min, 超净台内风干后用0.1% 结晶紫 (无水甲醇配制) 染色30 min, PBS小心清洗3次后, 200倍倒置荧光显微镜下拍照。各小室的染色细胞经10% 冰醋酸溶解, 每个小室各取两次100 μL洗脱液移入96孔板中, 在570 nm处测其OD值, 参考波长为630 nm。重复实验3次。
细胞迁移实验方法同细胞侵袭实验, 仅小室内不用Matrigel处理。按公式: 侵袭 (迁移) 率= (实验组OD均值/溶剂对照组OD均值)×100%, 计算肿瘤细胞侵袭与迁移率, 抑制率= 100%−侵袭 (迁移) 率。
| [1] | Yang J, Chen SZ. Synergistic effect and its possible mechanisms of lidamycin in combination with TRAIL in NSCLC [J]. Acta Pharm Sin (药学学报), 2010, 45: 1247-1253. |
| [2] | Kumar A, Dogra S. Pathophysiology and therapeutic strategies in the management of stroke: an update [J]. Drugs Today, 2008, 44: 757-757. |
| [3] | Chen K, Wei H, Ling S, et al. Expression and significance of transforming growth factor-β1 in epithelial ovarian cancer and its extracellular matrix [J]. Oncol Lett, 2014, 8: 2171-2174. |
| [4] | Ma XM, Shen ZH, Liu ZY, et al. Heparanase promotes human gastric cancer cells migration and invasion by increasing Src and p38 phosphorylation expression [J]. Int J Clin Exp Pathol, 2014, 7: 5609-5621. |
| [5] | Tang CH. Molecular mechanisms of chondrosarcoma metastasis [J]. Biomedicine, 2012, 2: 92-98. |
| [6] | Martin SK, Kamelgarn M, Kyprianou N. Cytoskeleton targeting value in prostate cancer treatment [J]. Am J Clin Exp Urol, 2014, 2: 15-26. |
| [7] | Geiger TR, Peeper DS. Metastasis mechanisms [J]. Biochim Biophys Acta, 2009, 1796: 293-308. |
| [8] | Herszényi L, Barabás L, Hritz I, et al. Impact of proteolytic enzymes in colorectal cancer development and progression [J]. World J Gastroenterol, 2014, 20: 13246-13257. |
| [9] | Borrirukwanit K, Pavasant P, Blick T, et al. High threshold of β1 integrin inhibition required to block collagen I-induced membrane type-1 matrix metalloproteinase (MT1-MMP) activation of matrix metalloproteinase 2 (MMP-2) [J]. Cancer Cell Int, 2014, 14: 99-112. |
| [10] | Shi Q, Li J, Feng Z, et al. Effect of ginsenoside Rh2 on the migratory ability of HepG2 liver carcinoma cells: recruiting histone deacetylase and inhibiting activator protein 1 transcription factors [J]. Mol Med Rep, 2014, 10: 1779-1785. |
| [11] | Igarashi Y, Mogi T, Yanase S, et al. Brartemicin, an inhibitor of tumor cell invasion from the Actinomycete nonomuraea sp. [J]. J Nat Prod, 2009, 72: 980-982. |
| [12] | Liu HL, Wang J, Lin DZ, et al. Lead compound optimization strategy (2)-structure optimization strategy for reducing toxicity risks in drug design [J]. Acta Pham Sin (药学学报), 2014, 49: 1-15. |
| [13] | Ko HS, Kim JS, Cho SM, et al. Urokinase-type plasminogen activator expression and Rac1/WAVE-2/Arp2/3 pathway are blocked by pterostilbene to suppress cell migration and invasion in MDA-MB-231 cells [J]. Bioorg Med Chem Lett, 2014, 24: 1176-1179. |
 2015, Vol. 50
2015, Vol. 50


