过敏炎症反应是以病理生理学和医学障碍为特征的一类反应,包括过敏性哮喘、过敏性皮炎和过敏性鼻炎等。它是血管系统的活体组织对损伤因子所发生的防御反应,是一种常见的基本病理过程,当机体发生炎症反应时往往会伴随着大量炎症介质的产生。有研究表明,肥大细胞在过敏炎症反应中发挥着重要的作用,常用于评价抗炎药物的体外效应[1, 2]。肥大细胞被抗原激活以后,会释放出组胺、IL-6、IL-8、IL-1β和TNF-α等与I型变态反应相关的炎症介质,从而引起过敏炎症反应[3]。因此,过敏炎症反应与肥大细胞的活化密切相关,抑制肥大细胞释放组胺和其他相关的炎症细胞因子可以在一定程度上减轻过敏炎症反应的强度。已有研究发现,NF-κB信号通路中相关蛋白与炎症反应和免疫应答的调节密切相 关[4, 5]。当细胞处于静息状态时,NF-κB以二聚体的形式与NF-κB抑制蛋白IκB结合,游离于细胞中。当细胞受到刺激时,IκB会被活化的激酶磷酸化。IκB激酶 (IKKα和IKKβ) 在活化NF-κB信号通路时发挥重要的作用[6, 7]。有研究表明,当细胞缺乏IKKβ基因时,NF-κB信号通路就不会被活化[8, 9]。活化的IKKβ磷酸化IκBα,使与IκBα结合的NF-κB游离出来。游离的NF-κB进入到细胞核中,诱导相关炎症介质的释放[10, 11]。
山柰酚 (kaempferol) 是一种从姜科植物山柰以及檀香科植物百蕊草中所提取的黄酮类化合物,它广泛存在于各种蔬菜和水果中。山柰酚具有抗肿瘤[12]、抗炎[13]和抗氧化[14]等多种作用。最近的研究表明,山柰酚对急性肺损伤[15]、乳腺炎[16]、关节炎[17]等炎症疾病可能有潜在的治疗效果。Kim等[18]发现山柰酚在大鼠的牙龈组织中能够通过抑制NF-κB减少TNF-α的释放。Kowalski等[19]发现在活化的J774.2巨噬细胞中山柰酚能够抑制TNF-α和IL-1β的表达。但是,目前关于它对肥大细胞所介导的过敏炎症反应的体外实验研究国内外文献却很少有报道。本次实验以HMC-1肥大细胞作为研究对象,首次研究山柰酚对肥大细胞炎症介质组胺、IL-6、IL-8、IL-1β和TNF-α释放的影响,并探讨其对NF-κB信号通路中相关蛋白的影响。
材料与方法材料和试剂 HMC-1肥大细胞株购于中国生命科学院上海细胞库; 胎牛血清 (Gibco,USA); DMEM培养基 (Gibco,USA); 脂多糖 (LPS)(Sigma,USA); 化合物48/80(Sigma,USA); 山柰酚 (Sigma,USA); MTT (Sigma,USA); 组胺、IL-6、IL-8、IL-1β和TNF-α ELISA试剂盒 (Cloud-Clone Corp,USA); Western blot试剂盒 (上海碧云天公司); 鼠抗人β-actin单克隆抗体 (Invitrogen,USA); 兔抗人Histone H3、p-IKKβ、IκBα、p-IκBα、NF-κB (p65) 单克隆抗体 (Invitrogen,USA); 辣根过氧化物酶标记羊抗小鼠IgG抗体 (北京中杉金桥生物技术有限公司); 辣根过氧化物酶标记羊抗兔IgG抗体 (北京中杉金桥生物技术有限公司); BCA 蛋白浓度测定试剂盒增强型 (上海碧云天公司); PVDF膜 (上海碧云天公司); ECL暗室化学发光试剂 (上海碧云天公司)。
细胞培养将HMC-1细胞用含10% 胎牛血清、青霉素100 u·mL-1、链霉素100 u·mL-1的DMEM完全培养基在37 ℃、5% CO2培养箱中培养,3~4天传代一次,取对数期细胞进行实验。
MTT法检测细胞毒性取培养至对数生长期的HMC-1细胞,接种于96孔板中,每孔100 μL,每孔中细胞数为5×103个。HMC-1细胞分为以下几组: 正常组; 0.1% DMSO组; 各种不同浓度的山柰酚药物组 (5、10、20、40、80和160 μmol·L-1),每组设5个复孔,置于37 ℃、5% CO2培养箱中培养24 h。随后每孔加入MTT 10 μL (5 mg·mL-1),继续培养4 h后弃上清液,向每孔中加入DMSO100 μL,振荡10 min,在酶标仪上检测490 nm波长处的吸光度值。根据上述实验方法重复5次。
HMC-1细胞中组胺含量的测定HMC-1细胞 (2×106个/孔) 与不同浓度的山柰酚 (10、20和40 μmol·L-1) 在37 ℃、5% CO2培养箱中培养1 h,随后加入化合物48/80 (终浓度为10 μg·mL-1) 共培养2 h。冰浴10 min,终止反应,1 000 r·min-1、4 ℃离心5 min,取上清液。根据ELISA试剂盒说明书进行操作,测定细胞上清液中组胺的含量。根据上述实验方法重复5次。
HMC-1细胞中IL-6、IL-8、IL-1β和TNF-α含量的测定HMC-1细胞 (2×106个/孔) 与不同浓度的山柰酚 (10、20和40 μmol·L-1) 在37 ℃、5% CO2培养箱中培养1 h,随后加入LPS (终浓度为0.1 μg·mL-1) 共培养24 h。冰浴10 min,终止反应,1 000 r·min-1、4 ℃离心5 min,取上清液。根据ELISA试剂盒说明书进行操作,测定细胞上清液中IL-6、IL-8、IL-1β和TNF-α的含量。根据上述实验方法重复5次。
Western blot测定蛋白的表达取对数期生长的HMC-1细胞(3×106个/孔) 与不同浓度的山柰酚 (10、20和40 μmol·L-1) 在37 ℃、5% CO2培养箱中培养1 h,随后加入LPS (终质量浓度为0.1 μg·mL-1) 共培养2 h。1 000 r·min-1、4 ℃离心5 min,去上清 液。按照细胞核和细胞质蛋白提取试剂盒说明书,分别提取胞质蛋白和胞核蛋白,BCA法测定蛋白质的浓度。取蛋白样品30 μg进行SDS-聚丙烯酰胺凝胶电泳。将凝胶中分离的蛋白转移至PVDF膜上,5% 脱脂奶室温封闭2 h后,分别加入抗p-IKKβ、IκBα、p-IκBα、NF-κB (p65)、β-actin、HistoneH3一抗溶液,4 ℃温育过夜,加入辣根过氧化物酶标记的相应二抗溶液,温育2 h,ECL暗室化学发光显影,凝胶成像分析系统摄像分析,采用Quantity One分析软件分析条带灰度值,蛋白表达相对值=目的蛋白灰度值/内参蛋白灰度值。根据上述实验方法重复5次。
统计学方法采用SPSS 19.0统计软件,实验数据以x± s表示,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P < 0.05为差异有显著性。
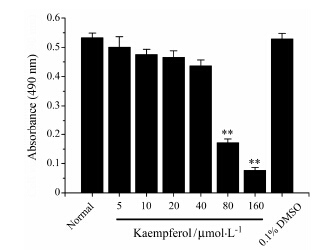
结果 1 山柰酚对HMC-1细胞的细胞毒性作用通过MTT法检测山柰酚对HMC-1细胞的细胞毒性作用并确定山柰酚的给药浓度。如图 1所示,与正常组相比,山柰酚 (5~160 μmol·L-1) 可降低HMC-1细胞的生存率,高浓度的山柰酚 (80和160 μmol·L-1) 会显著降低细胞的生存率 (P < 0.01)。因此,山柰酚的给药浓度确定在5~40 μmol·L-1内,根据实验选择给药浓度为10、20和40 μmol·L-1。
|
Figure 1 Effects ofkaempferol on cytotoxicity of HMC-1 mast cells. The cells were treatedwith various of concentrations of kaempferol for 24 h. Thecytotoxicity of kaempferol for HMC-1 mast cells was analyzed by MTT assay. n = 5,x± s. **P < 0.01 vs normal group |
通过ELISA实验评估山柰酚对化合物48/80刺激的HMC-1细胞组胺释放的影响。如图 2所示,与正常组比较,用化合物48/80刺激的模型对照组中组胺的释放量会显著上升 (P < 0.01)。与模型对照组比较,给药组会显著降低组胺的释放量 (P < 0.01)。因此,山柰酚可以抑制活化的肥大细胞中组胺的释放。

|
Figure 2 Effects ofkaempferol on the release of histamine in compound 48/80-stimulated HMC-1 mastcells. The cells were pretreated with kaempferol (10,20,40 μmol∙L-1)for 1 h and then incubated with compound 48/80(10 μg·mL-1) for 2 h. The concentration of histamine wasmeasured by ELISA assay. n = 5,x± s. ##P < 0.01 vs normal group; **P < 0.01 vs compound 48/80 alonegroup |
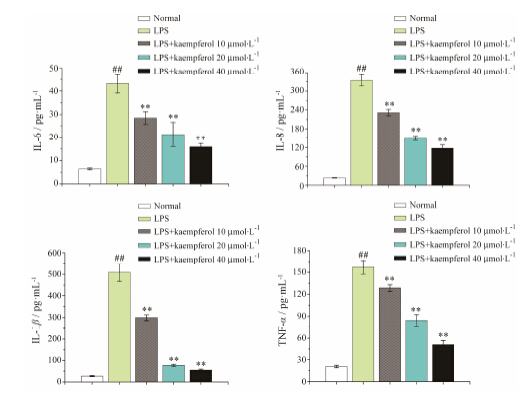
通过ELISA实验研究山柰酚对LPS诱导的HMC-1肥大细胞IL-6、IL-8、IL-1β和TNF-α等细胞因子释放的影响。如图 3所示,与正常组比较,用LPS诱导的模型对照组中IL-6、IL-8、IL-1β和TNF-α等细胞因子的释放量会显著上升 (P < 0.01)。与模型对照组比较,给药组会显著降低细胞因子的释放量 (P < 0.01)。结果表明,山柰酚能够显著抑制肥大细胞中IL-6、IL-8、IL-1β和TNF-α等细胞因子的分泌。
|
Figure 3 Effects ofkaempferol on the secretion of inflammatory cytokines in LPS-induced HMC-1 mastcells. The cells were pretreated with kaempferol(10,20,40 μmol∙L-1) for 1 h and then incubated with LPS (0.1 μg·mL-1)for 24 h. The concentrations of IL-6,IL-8,IL-1β and TNF-αwere measured by ELISA assay. n = 5,x± s. ##P < 0.01 vs normal group; **P < 0.01 vs LPS alone group |
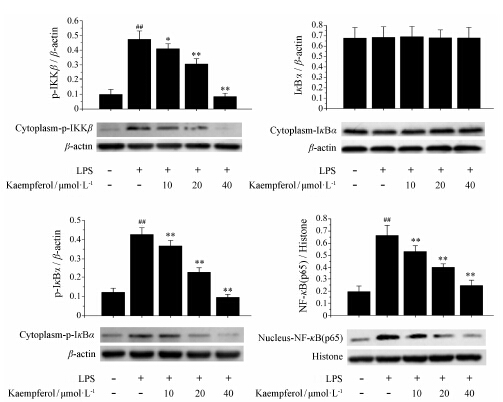
根据Western blot结果显示,在LPS诱导的HMC-1细胞中,山柰酚会显著降低胞质中p-IKKβ、p-IkBα和胞核中NF-κB (p65) 的蛋白表达水平 (P < 0.01),而胞质中IκBα蛋白的表达水平基本没有显著性差异 (图 4)。结果表明,山柰酚能够使活化的HMC-1细胞中p-IKKβ下调,降低IκBα的磷酸化,进而减少胞核中NF-κB (p65) 的蛋白水平。
|
Figure 4 Effects ofkaempferol on protein expression of p-IKKβ,IκBα,p-IκBαand NF-κB(p65) in LPS-induced HMC-1 mast cells. The cells werepretreated with kaempferol (10,20,40 μmol∙L-1) for 1 h and thenincubated with LPS (0.1 μg·mL-1) for 2 h. The proteinexpressions of p-IKKβ,IκBα,p-IκBα and NF-κB(p65) were analyzed by Western blot,β-actin and histone were used asendogenous control. n = 5,x± s. ##P < 0.01 vs normal group; P < 0.05,**P < 0.01 vs LPS alone group |
革兰阴性菌细胞壁的主要成分脂多糖是诱导人炎性疾病的主要致病原之一,因此利用脂多糖建立体外细胞炎症模型是一种常见方法[20]。本次实验主要以HMC-1细胞作为研究对象,利用LPS建立体外细胞炎症模型,观察山柰酚对HMC-1细胞炎症反应的抑制作用。研究结果显示,LPS能够刺激HMC-1细胞产生大量的IL-6、IL-8、IL-1β和TNF-α等相关细胞因子,这与体内所发生的炎性疾病机制非常相似,进一步验证了利用LPS建立体外细胞炎症模型的可行性。同时,本研究结果显示,不同浓度的山柰酚对LPS活化的HMC-1细胞炎症因子的分泌有明显的抑制作用,并呈现出剂量依赖效应,提示山柰酚具有潜在的抗过敏炎症反应的药理作用。炎症介质组胺是在结缔组织周围肥大细胞和嗜碱性粒细胞中发现的一种物质,它与靶细胞上的H1受体结合收缩肠道和支气管平滑肌[21, 22]。因此,组胺在炎症反应过程中扮演着重要的角色。为了确定山柰酚对HMC-1细胞脱颗粒产生组胺是否有一定的影响,在本次实验中还使用化合物48/80刺激HMC-1细胞,结果显示化合物48/80刺激HMC-1细胞以后细胞中组胺的释放量会明显升高。用山柰酚作用于被刺激的HMC-1细胞以后,组胺的释放量会明显下降。目前常用的一些抗过敏炎症反应药物如地氯雷他定为抗组胺药,Weller等[23]研究发现地氯雷他定在体外实验时能够抑制肥大细胞的活化,同时抑制组胺的释放。Zhao等[24]认为地氯雷他定能够抑制活化的肥大细胞中IL-6、IL-8、和TNF-α等细胞因子的释放,但是它除了对TNF-α的释放有较强的抑制效应以外,对IL-6和IL-8的释放抑制效应均比较弱。这就限制了地氯雷他定成为抗过敏炎症反应的多靶点性药物。相比于地氯雷他定,山柰酚不仅对组胺有显著的抑制效应,同时对相关炎症介质如细胞因子IL-6、IL-8、IL-1β和TNF-α均有很强的抑制效应,这就为山柰酚治疗多种炎症介质所介导的炎性疾病提供了一些理论依据。
NF-κB信号通路作为炎症反应主要信号通路,在炎症反应的发生过程中发挥着重要的作用。其中NF- κB信号通路中的主要蛋白NF-κB (p65) 的核位移是信号通路被激活的关键。NF-κB信号通路的激活对于细胞因子IL-6、IL-8、IL-1β和TNF-α的释放起着关键的调控作用[25, 26, 27]。本研究显示,LPS诱导HMC-1细胞以后,NF-κB信号通路中的相关蛋白IKKβ和IκBα的磷酸化水平升高,同时NF-κB (p65) 的核位移也明显增加,提示LPS会激活HMC-1细胞NF-κB信号通路。当不同浓度的山柰酚作用于LPS诱导的HMC-1细胞以后,IKKβ和IκBα的磷酸化水平会明显降低,NF-κB (p65)的核位移也会明显减少,提示山柰酚能够通过抑制NF-κB信号通路相关蛋白IKKβ和IκBα的磷酸化,减少NF-κB (p65) 的核位移,进而抑制相关炎症介质的释放。基于NF-κB信号通路相关蛋白对炎症介质的调控作用和上述实验结果,抑制NF-κB (p65) 的核位移,减少相关炎症介质的释 放,可能是山柰酚抑制肥大细胞介导炎症反应的原因之一。
肥大细胞参与到多种炎性疾病的致病过程中,因此,有效抑制肥大细胞炎症反应对炎性疾病的治疗至关重要。本实验探讨了山柰酚对肥大细胞介导 的炎症反应的影响,证明山柰酚能够抑制肥大细胞中相关炎症介质的释放和相关信号通路蛋白的活化,提示山柰酚对肥大细胞参与的炎性疾病可能有一定的治疗作用。山柰酚对其他的炎性细胞如嗜酸性粒 细胞、淋巴细胞是否也有类似的影响等问题将会在 以后的实验中做进一步探究。
综上所述,山柰酚能够抑制肥大细胞介导的炎症反应,其原因是抑制NF-κB信号通路相关蛋白的活化,抑制相关炎症介质的释放,进而发挥其抗过敏炎症反应的药理作用。本实验结果为阐明山柰酚的体外抗炎效应提供了可靠的实验依据,为进一步探讨山柰酚的体内抗炎效应提供了理论基础。
| [1] | Jin GR, Hong H, Jin GY, et al. Anthocyanidin inhibits immunoglobulin E-mediated allergic response in mast cells [J]. Acta Pharm Sin (药学学报), 2012, 47: 34-38. |
| [2] | Kim BR, Seo HS, Ku JM, et al. Silibinin inhibits the production of pro-inflammatory cytokines through inhibition of NF-κB signaling pathway in HMC-1 human mast cells [J]. Inflamm Res, 2013, 62: 941-950. |
| [3] | Olivera A, Rivera J. An emerging role for the lipid mediator sphingosine-1-phosphate in mast cell effector function and allergic disease [J]. Adv Exp Med Biol, 2011, 716: 123-142. |
| [4] | Wei ZQ, Yan L, Deng JG, et al. Mangiferin protects rats against chronic bronchitis via regulating NF-κB (P65) and IκBα expression in mononuclear cells [J]. Acta Pharm Sin (药学学报), 2014, 49: 596-601. |
| [5] | Choi EY, Kim HJ, Han JS. Anti-inflammatory effects of calcium citrate in RAW 264.7cells via suppression of NF-κB activation [J]. Environ Toxicol Pharmacol, 2014, 39: 27-34. |
| [6] | Mercurio F, Zhu H, Murray BW, et al. IKK-1 and IKK-2: cytokine-activated IκB kinases essential for NF-κB activation [J]. Science, 1997, 278: 860-866. |
| [7] | DiDonato JA, Hayakawa M, Rothwarf DM, et al. A cytokine-responsive IκB kinase that activates the transcription factor NF-κB [J]. Nature, 1997, 388: 548-554. |
| [8] | Li ZW, Chu W, Hu Y, et al. The IKKβ subunit of IκB kinase (IKK) is essential for nuclear factor κB activation and prevention of apoptosis [J]. J Exp Med, 1999, 189: 1839-1845. |
| [9] | Tanaka H, Fujita N, Tsuruo T. 3-Phosphoinositide-dependent protein kinase-1-mediated IκB kinase β (IKKB) phosphorylation activates NF-κB signaling [J]. J Biol Chem, 2005, 280: 40965-40973. |
| [10] | Beg AA, Ruben SM, Scheinman RI, et al. IκB interacts with the nuclear localization sequences of the subunits of NF-κB: a mechanism for cytoplasmic retention [J]. Genes Dev, 1992, 6: 1899-1913. |
| [11] | Brown K, Gerstberger S, Carlson L, et al. Control of IκB-α proteolysis by site-specific, signal-induced phosphorylation [J]. Science, 1995, 267: 1485-1488. |
| [12] | Marfe G, Tafani M, Indelicato M, et al. Kaempferol induces apoptosis in two different cell lines via Akt inactivation, Bax and SIRT3 activation, and mitochondrial dysfunction [J]. J Cell Biochem, 2009, 106: 643-650. |
| [13] | Liu ZK, Xiao HB, Fang J. Anti-inflammatory properties of kaempferol via its inhibition of aldosterone signaling and aldosterone-induced gene expression [J]. Can J Physiol Pharmacol, 2014, 92: 117-123. |
| [14] | Huang YB, Lin MW, Chao Y, et al. Anti-oxidant activity and attenuation of bladder hyperactivity by the flavonoid compound kaempferol [J]. Int J Urol, 2014, 21: 94-98. |
| [15] | Chen X, Yang X, Liu T, et al. Kaempferol regulates MAPKs and NF-κB signaling pathways to attenuate LPS-induced acute lung injury in mice [J]. Int Immunopharmacol, 2012, 14: 209-216. |
| [16] | Cao R, Fu K, Lv X, et al. Protective effects of kaempferol on lipopolysaccharide-induced mastitis in mice [J]. Inflammation, 2014, 37: 1453-1458. |
| [17] | Lee WS, Lee EG, Sung MS, et al. Kaempferol inhibits IL-1β-stimulated, RANKL-mediated osteoclastogenesis via downregulation of MAPKs, c-Fos, and NFATc1 [J]. Inflammation, 2014, 37: 1221-1230. |
| [18] | Kim HK, Park HR, Lee JS, et al. Down-regulation of iNOS and TNF-α expression by kaempferol via NF-κB inactivation in aged rat gingival tissues [J]. Biogerontology, 2007, 8: 399-408. |
| [19] | Kowalski J, Samojedny A, Paul M, et al. Effect of apigenin, kaempferol and resveratrol on the expression of interleukin-1β and tumor necrosis factor-α genes in J774.2 macrophages [J]. Pharmacol Rep, 2005, 57: 390-394. |
| [20] | Kim BW, Koppula S, Park SY, et al. Attenuation of inflammatory-mediated neurotoxicity by Saururus chinensis extract in LPS-induced BV-2 microglia cells via regulation of NF-κB signaling and anti-oxidant properties [J]. BMC Complement Altern Med, 2014, 14: 502. |
| [21] | Kuna P, Reddigari SR, Rucinski D, et al. Monocyte chemotactic and activating factor is a potent histamine-releasing factor for human basophils [J]. J Exp Med, 1992, 175: 489-493. |
| [22] | Wang SL, Malany S, Wang Q, et al. Histamine induces interleukin-6 expression in the human synovial sarcoma cell line (SW982) through the H1 receptor [J]. Inflamm Res, 2006, 55: 393-398. |
| [23] | Weller K, Maurer M. Desloratadine inhibits human skin mast cell activation and histamine release [J]. J Invest Dermatol, 2009, 129: 2723-2726. |
| [24] | Zhao Y, Leung PC, Woo KS, et al. Inhibitory effects of budesonide, desloratadine and dexamethasone on cytokine release from human mast cell line (HMC-1) [J]. Inflamm Res, 2004, 53: 664-669. |
| [25] | Epanchintsev A, Shyamsunder P, Verma RS, et al. IL-6, IL-8, MMP-2, MMP-9 are overexpressed in Fanconi anemia cells through a NF-κB/TNF-α dependent mechanism [J]. Mol Carcinog, 2014. doi: 10.1002/mc.22240 |
| [26] | Wang YW, Zhang HH, Wang YL, et al. Effect of Huangqin Tang on the regulatory NF-κB p65 signal pathway in rats with ulcerative colitis [J]. Acta Pharm Sin (药学学报), 2015, 50: 21-27. |
| [27] | Zhu T, Zhang L, Ling S, et al. Scropolioside B inhibits IL-1β and cytokines expression through NF-κB and inflammasome NLRP3 pathways [J]. Mediators Inflamm, 2014, 2014: 819053. |
 2015,Vol. 50
2015,Vol. 50


