2. Department of Anatomy and Neurobiology, Dalhousie University, Canada, 15000
2. Department of Anatomy and Neurobiology, Dalhousie University, Canada, 15000
通常状态下,动物新陈代谢及体温会维持在一个相对稳定的水平,为维持动物的生理活动或者酶反应提供了适宜的机体环境。但在寒冷或食物供给不足的状态下,动物会进入蛰伏或冬眠状态,这个状态表现为体温的下降及代谢速率的降低。这意味着动物可以节约维持正常体温所需要耗费的能量,从而在极端条件下提高自身生存的能力[1]。蛰伏状态下的体温调节是一个有序的过程,可能腺苷系统参与了该状态的引发和维持[2],同时这一状态也受到外在环境温度的影响。
对于人类而言,目前临床治疗条件下,患者可以在人工冬眠状态中维持1周左右。而一些来自其他 方面的需求会推动人工冬眠领域的进一步研究: 比如在2014年10月,美国航空航天局 (NASA) 宣布,他们将进行一项“深度睡眠”研究,将人工冬眠状态延长至90或180天,从而大幅度地降低宇宙飞船机组人员在飞往火星过程中的新陈代谢及生命保障的最低要求[3]。
腺苷作为内源性的神经递质,在调节机体生理状态的过程中扮演了重要的角色。整体水平给予小鼠腺苷可以导致一系列的生理反应,包括自主活动的减少[4]、镇静[5]及体温的降低[6]。腺苷的这些作用可能由不同类型的细胞外受体所介导。根据受体的组织分布、与腺苷环化酶的相互作用、与不同类型G-蛋白的相互关联以及与特定激动剂或拮抗剂的亲和力,腺苷受体被划分为3大类: A1R、A2R (A2a,A2b) 以及A3R[7,8]。其中,A2b受体的含量与病理状态相关,在生理状态下不足以与腺苷结合发挥效应[9]; 而A3受体主要参与慢性的生理调节而非急性的调节过程[10]。本文主要研究化合物的急性体温调节作用,因此A1受体及A2a受体是本研究的主要关注点。
前人的研究表明,腺苷类似物对动物体温的影响可能通过中枢腺苷受体介导,也有可能通过分布于外周 (心脏及血管)的腺苷受体介导[11, 12, 13]。A1受体在中枢神经系统分布广泛,在外周神经系统主要分布于心脏产生负性变时及负性变力作用[11];A2a受体在中枢神经系统主要分布在纹状体内,但在调控心血管的脑区 (如孤束核)也有较高的分布[14]; 在外周A2a受体主要位于脉管系统,参与外周压力感受器的反馈调节,从而调控血管的舒张[12]。
本实验室的前期工作针对腺苷母核进行了一系列设计和优化,得到了化合物YZG-330 [(2R,3S,4R,5R)- 2-(hydroxymethyl)-5-(6-(((R)-1-phenylpropyl) amino)- 9H-purin-9-yl) tetrahydrofuran-3,4-diol],该化合物具有镇静催眠作用并且能够增加小鼠大脑皮层细胞的氯离子内流[15]。在整体动物水平的研究过程中,注意到YZG-330可以显著降低动物的体温。
鉴于中枢或外周的A1或A2a受体都有可能在YZG-330引发的小鼠降温现象中发挥作用。因此,本研究通过使用不同类型的腺苷受体拮抗剂,来阐明参与YZG-330降温作用的受体亚型及分布区域。
材料与方法 实验动物雄性ICR小鼠,SPF级,体重18~22 g; 购自北京维通利华实验动物技术有限公司 [许可证编号: SCXK (京) 2011-2014]。动物饲养于中国医学科学院药物研究所SPF级动物实验中心,保持12 h昼夜 节律,室温保持在 (24 ± 1) ℃,相对湿度为 (60 ± 5) %。标准小鼠饲养盒内喂养动物,每5只一盒,自由进食和进水。实验前动物适应环境至少3天,适应期间每天对小鼠进行抚摸及抓取练习。
药品与试剂N6-取代腺苷衍生物YZG-330 (化学结构见图 1),由中国医学科学院药物研究所石建功教授实验室合成。HPLC检测纯度大于99%。DPCPX (批号: 9A/70155) 及SCH58261(批号: 2A/83421) (Tocris公司); 8-SPT (批号:120M4718V,Sigma公司)。氨茶碱 (aminophylline) 为实验室储备工具药。以上各试剂用1% Tween 80 (批号: 900222,中国医药公司北京分公司) 润湿后,再用蒸馏水配成相应浓度。1% Tween 80水溶液作为溶剂对照。
|
Figure 1 Chemical structureof YZG-330 [(2R,3S,4R,5R)-2- (hydroxymethyl)-5-(6-(((R)-1-phenylpropyl) amino)-9H-purin-9-yl)tetrahydrofuran-3,4-diol]. Molecular weight:385.42 |
数字测温仪 (温度传感器直径2 mm,北京业之恒科技有限公司),使用水银温度计在33 ℃、37 ℃及40 ℃下进行校准。测定动物肛温时涂少量凡士林润滑传感器,将传感器探头插入约1.5 cm,1 min内读数稳定,记录此时温度。
动物体温测定实验设计① 雄性ICR小鼠随机分为6组,每组10只,分别为溶剂对照组、YZG-330 (0.2和0.6 mg·kg-1,ig) 剂量组、拮抗剂对照组 (氨 茶碱,5 mg·kg-1,ip) 及拮抗实验组YZG-330 (0.2和0.6 mg·kg-1,ig) + 氨茶碱 (5 mg·kg-1,ip)。实验时,首先腹腔注射氨茶碱或溶剂,20min后灌胃给予化合物YZG-330溶液或溶剂,30min后抓拿固定动物,记录动物的肛温。②雄性ICR小鼠随机分为10组,每组6只,分别为溶剂对照组、YZG-330 (0.25、1和4 mg·kg-1,ig) 剂量组、拮抗剂对照组3组 (DPCPX,5 mg·kg-1; SCH-58261,5 mg·kg-1; 8-SPT,50mg·kg-1,ip) 及拮抗实验组3组YZG-330(4 mg·kg-1,ig) + DPCPX/SCH-58261/8-SPT (ip)。本系列实验在13∶00~18∶00进行,每10 min捉拿动物测定肛温,首先记录3个值作为初始水平,然后按照组别腹腔注射拮抗剂或溶剂对照,20 min后灌胃化合物溶液或溶剂对照,记录随后3 h动物的体温。计算动物肛温变化的幅度以及低温状态 (低于34 ℃) 的持续时间。
统计与分析数据以均数 ± 标准误表示,应用SPSS19.0软件进行统计学分析。氨茶碱对YZG-330的拮抗作用实验采用双因素方差分析 (two-way ANOVA),为保证两两比较结果的准确性,选择严格的Bonferroni’stest校正α值进行post-hoc差异比较。给药后体温随时间变化规律的分析方法采用重复测量数据的方差分析(repeted-mesures ANOVA),因为进一步比较的主要关注点在于同一时间点下的多对比较,因此可以结合Dunnett’s test进行post-hoc差异比较。此外,YZG-330体温变化极值数据使用单因素方差分析 (one-way ANOVA),结合Dunnett’s test进行post-hoc差异比较。对于DPCPX、SCH-58261及8-SPT拮抗实验中的体温变化极值,不同拮抗剂之间的数据不进行比较,所以双因素方差分析 (two-way ANOVA) 后,选择效能与配对t检验相当的LSD’s test进行post-hoc差异比较。对于体温低于34 ℃的时间,由于拮抗剂对照组无此现象,因此仅将YZG-330 + 拮抗剂组与YZG-330组比较,进行配对t检验。
结果 1 YZG-330显著降低小鼠的体温给予YZG-330后,30 min时小鼠体温呈现剂量相关性降低 (图 2); 而提前20min注射氨茶碱 (5 mg·kg-1,ip) 可以有效拮抗YZG-330在0.2和0.6mg·kg-1剂量下的降温作用 (P < 0.001),并且该作用可被非选择性腺苷受体拮抗剂氨茶碱拮抗。
|
Figure 2 Body temperature afterYZG-330 administration at the presence or absence of aminophylline. Micewere injected with aminophylline,20 minutes later,YZG-330 (0.2 or 0.6 mg·kg-1)was orally administered. The body temperature 30 min after YZG-330administration was recorded and evaluated. n = 10,x± s. P < 0.05,**P < 0.01,***P < 0.001 vsvehicle group; ###P < 0.001 vs counterpartin YZG-330-only group; △△P < 0.01,△△△P < 0.001 vs antagonist-controlgroup |
以上预实验结果表明,腺苷受体与YZG-330的降温作用相关。因此,在进行后续选择性受体拮抗实验前,重新进行YZG-330的降温实验,以0.25、1、4 mg·kg-1作为口服给药的浓度梯度,每隔10分钟记录数据,选择最适于进一步拮抗实验的YZG-330剂量。
与溶剂对照组相比,灌胃给予YZG-330后小鼠体温显著下降 (图 3)。随YZG-330剂量增加,小鼠体温下降的幅度变大、持续时间延长。在0.25 mg·kg-1剂量下,YZG-330组小鼠体温的均值在给药后20 min 开始表现出显著下降 (P < 0.05),30 min处到达最低 (P < 0.01),此后回升,60 min后与对照组比较无统计学差异; 在1 mg·kg-1剂量下,YZG-330组小鼠的体温自给药后10 min开始表现出极显著降低 (P < 0.001),30 min到达最低 (与基础水平相比降低3.6 ℃,P < 0.001) 后开始回升,极显著的降低趋势持续至给药后120 min。最终在给药后150 min统计学无显著差异。体温低于34 ℃的时间为 (10 ± 5) min; 在4 mg·kg-1剂量下,YZG-330组小鼠体温的均值自给药后10 min测量时就表现出极显著降低 (P < 0.001),给药后110 min降至最小值 (与基础水平相比降低7.4 ℃,P < 0.001),180 min时动物体温稍有回升。体温低于34 ℃的时间为 (153 ± 4)min,8 h动物体温为 (37.7 ± 0.1) ℃,与基础水平相比,无显著性差异 (数据未在图中标示)。
|
Figure 3 YZG-330 could inducehypothermia in a dose- dependent manner. Micewere treated with vehicle or YZG-330 (0.25,1 or 4 mg·kg-1,ig). Thebody temperatures prior and post to the administration were recorded andevaluated for every 10 minutes. n = 6,x± s. P < 0.05,**P < 0.01,***P < 0.001 vs vehicle group |
鉴于在4 mg·kg-1剂量下小鼠的低温状态能够维持在一个平台水平,因此4 mg·kg-1作为YZG-330后续拮抗实验的用量。
3 腺苷A1受体拮抗剂DPCPX对YZG-330降温作用的拮抗作用
与空白对照相比,单独给予DPCPX (5 mg·kg-1,ip) 后,小鼠体温在注射后10 min显著下降 (P < 0.05),但持续时间较短,20 min后DPCPX组与空白组动 物体温无显著性差异 (图 4A)。间隔20min依次给予
|
Figure 4 Effect of different typesof adenosine receptor antagonists on YZG-330induced hypothermia. Mice were injectedwith DPCPX (8-cyclopentyl-1,3-dipropylxanthine) (A),SCH-58261(7-(2-phenylethyl)-5-amino-2-(2-furyl)-pyrazolo-[4,3- e]-1,2,4-triazolo[1,5-c]pyrimidine) (B)or 8-SPT (8-(p-sulfophenyl)- theophylline hydrate) (C),20 minutes later YZG-330 (4 mg·kg-1) was orally administered. Thebody temperatures prior and post to the administration were recorded andevaluated for every 10 minutes. n = 6,x± s. P < 0.05,**P < 0.01,***P < 0.001 vs vehicle group; #P < 0.05,##P < 0.01,###P < 0.001 vs YZG-330 + antagonist group |
DPCPX(5 mg·kg-1,ip) 和YZG-330 (4 mg·kg-1,ig) 后,联合用药组小鼠的体温在10 min内显著下降,在20 min时降至最小值,随后表现出回升趋势。50~180 min期间DPCPX+YZG-330联合用药组小鼠的 体温与YZG-330组体温具有极显著的差异 (图 5B)。
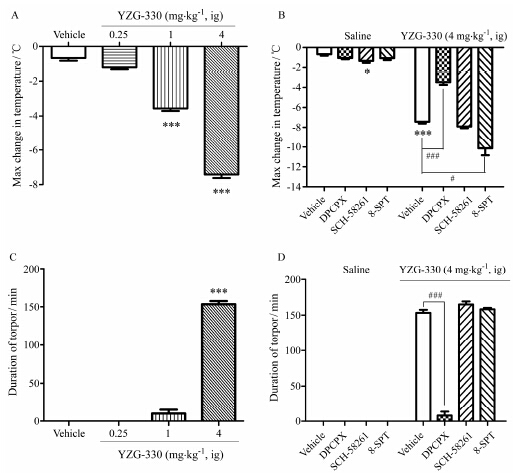
|
Figure 5 Effect of YZG-330 andadenosine receptor antagonists on the maximum change on mouse body temperature(A,B) and torpor-duration (C,D). Thecondition when body temperature below 34 ℃ is defined as torpor. Antagonistswere intraperitoneally given to the mice (B,D) for each group 20 min beforethe intragastrical administration of YZG-330. n = 6,x± s. *P < 0.05,***P < 0.001 vs vehicle group; #P < 0.05,###P < 0.001 vs YZG-330 group |
DPCPX可以部分拮抗YZG-330对体温降低极值的影响 (P < 0.001)。该组小鼠体温处于34 ℃以下的时间为 (8 ± 6)min,与单给YZG-330组 [(153 ± 4) min] 相比显著缩短 (P < 0.001)。与DPCPX组相比,联合用药组动物的体温在给药后120min存在极显著差异,随着联合用药组动物的恢复,差异在给药170 min后消失。
4 腺苷A2a受体拮抗剂对YZG-330的降温作用与空白对照相比,单独给予SCH-58261 (5mg·kg-1,ip) 后,小鼠体温在注射后10和20 min时表现出一过性下降 (P < 0.01),但持续时间较短 (图 4B)。间隔20 min依次给予SCH-58261 (5 mg·kg-1,ip) 和YZG-330 (4 mg·kg-1,ig) 后,联合用药组小鼠的体温低于或等于单纯给予YZG-330的动物。在给药后120~180 min,联合给药组小鼠的体温低于YZG-330组,但变化极值与单纯灌胃YZG-330组相比无显著性差异 (图 5B)。联合给药组小鼠体温处于34 ℃以下的时间为 (165 ± 4)min,与单独给予YZG-330组 [(153 ± 4) min] 相比也无显著差异。提示腺苷A2a受体拮抗剂SCH- 58261完全不能拮抗YZG-330的降温作用。
5 非选择性、非血脑屏障透过性腺苷受体拮抗剂8-SPT不能逆转YZG-330的降温作用与空白对照相比,单独给予8-SPT (50 mg·kg-1,ip) 后,小鼠体温在注射后10 min表现出一过性的小幅下降 (图 4C),但无统计学意义。间隔20 min依次给予8-SPT (50 mg·kg-1,ip) 和YZG-330 (4mg·kg-1,ig) 后,联合用药组小鼠的体温低于单纯给予YZG- 330的动物,从第50min起,差异具有非常显著的统计学意义,联合给药组小鼠体温下降的极值明显大于单纯灌胃YZG-330组 (图 5B)。联合给药组动物体温处于34 ℃以下的时间为 (158 ± 2)min,与YZG-330组 [(153 ± 4) min] 相比,无显著统计学意义。
讨论本文通过拮抗中枢神经系统的腺苷A1受体可以抑制YZG-330降低小鼠体温的作用,确认了中枢腺苷A1受体参与YZG-330对小鼠体温的调控。
在寒冷环境下通过侧脑室注射给予AMP (adenosinemonophosphate)可以通过激活下丘脑视交叉前区的A1受体神经元降低小鼠体温[16]、中枢给予
dbcyclic AMP (dibutyryl adenosine 3',5'-cyclic mono phosphate) 可以使大鼠与家兔的体温更加容易趋近环境温度[17]; 腹腔及中枢给予腺苷A1受体激动剂CHA (N6-cyclohexyladenosine)[18,19]可以诱导动物进入蛰伏或冬眠状态。孤束核中间神经元的中枢腺苷A1受体激活后,通过抑制棕色脂肪组织对寒冷环境的防御机制及肌肉颤动产生的热量抑制细胞代谢最终使动物体温趋近环境温度[19]。而将腺苷A1受体拮抗剂DPCPX (175 ng/100 nL)定位注射至前腹侧视前区可以抑制缺氧导致的体温下降[20]。在常温环境下,与野生型动物相比,雌性A1RKO小鼠体温略有升高,但雄性基因敲除小鼠并未表现出相应的差异[21],此外,该实验组结合A2aRKO与A1-A2aRKO小鼠证明腺苷在正常生理条件下激活A1与A2a受体,参与对心率、体温、自主活动及耗氧量的调节。此外,根据A1RKO小鼠对定位注射在睡眠相关脑区结节乳头核 (TMN,tuberomammillary nucleus) 的A1受体激动剂CPA(N6- cyclopentyladenosine) 睡眠诱导作用没有响应[22],推测腺苷A1受体敲除小鼠对于寒冷环境下的CPA诱导的降温作用有可能也会表现出相应的抗性。
本实验中一个特殊而有趣的现象是腹腔注射8-SPT不能逆转YZG-330对小鼠体温的降低,反而使体温进一步下降,这可能与外周腺苷A1受体的调控作用有关。咖啡因、8-SPT、腺苷A1受体拮抗剂CPT (8- cyclopentyl-1,3-dimethyl-xanthine)可以拮抗CPA诱导的血压与心率下降; 而腺苷A2a受体拮抗剂MSX-3 (3-(3-hydroxypropyl)-8-(m-methoxystyryl)-7-methyl-1-propargylxanthine phosphate disodium salt) 对CPA的降压、降心率作用没有拮抗效果[23]。这说明腺苷A1受体也可以在外周神经系统发挥优势,对循环系统的血压和心率等参数进行调控。结合YZG-330的作用特点,推测腹腔注射8-SPT加剧YZG-330降温作用的原因: 腺苷A1受体参与对循环系统的调控,在维持动物的代谢和热量平衡发挥了重要作用。一方面,中枢A1受体激活后,可以通过抑制棕色脂肪组织的代谢及肌肉的颤动来抑制热量的生成; 另一方面,外周A1受体的激活,可以通过降低心率和血压等循环系统的功能来抑制热量的耗散。反之亦然。不论是激动剂还是拮抗剂只要能够同时作用于中枢和外周的腺苷A1受体,其在体温、心率和血压等参数上的药效就是和谐的。然而,作为不能透过血脑屏障的腺苷受体拮抗剂,8-SPT的存在割裂了YZG-330中枢与外周药效的协调性: 中枢A1受体激活抑制了热量产生,而外周A1受体被拮抗使热量耗散相对加快。于是,能量的动态平衡改变,外周给予8-SPT加剧了YZG-330导致的体温降低。
本实验共使用了4种腺苷受体拮抗剂对不同亚型、分布区域不同的腺苷受体进行调节,研究YZG-330的降温作用和对应受体。作为腺苷A1R、A2aR非选择性拮抗剂,8-SPT是在氨茶碱的结构母核8位上对磺苯基取代,增加了拮抗剂极性从而降低其血脑屏障通透能力。这对拮抗剂的同时使用,能够更好的区分中枢作用与外周作用。而血脑屏障的存在,通过侧脑室途径给予8-SPT来拮抗中枢腺苷受体,也可以增加对中枢作用和外周作用的辨识度[2]。
通过一系列的实验清晰地描绘出腺苷衍生物YZG-330对动物体温的影响,进一步明确其作用的受体亚型及分布,增加对其温控作用的了解和掌控。腺苷受体自身同时参与蛰伏状态的引发环节和维持环节,前人的研究表明,通过给予腺苷受体拮抗剂可以抑制小鼠进入蛰伏状态或直接打断此状态[2],这意味着通过监测生理指标,调节给予DPCPX的时间和剂量,并调节环境温度,可以控制YZG-330作用的强度和时间。这使得YZG-330在人工冬眠及载人航天等领域具有潜在的应用价值。
| [1] | Geiser F. Metabolic rate and body temperature reduction during hibernation and daily torpor [J]. Annu Rev Physiol, 2004, 66: 239-274. |
| [2] | Iliff BW, Swoap SJ. Central adenosine receptor signaling is necessary for daily torpor in mice [J]. Am J Physiol Regul Integr Comp Physiol, 2012, 303: R477-484. |
| [3] | Klotz I. Eyes Crew Deep Sleep Option for Mars Mission [M/OL]. 2014. DISCOVERY Communications, LLC. 2014 [2014-10-3]. http://news.discovery.com/space/nasa-eyes-crew-deep-sleep-option-for-mission-to-mars-141003.htm. |
| [4] | Barraco RA, Coffin VL, Altman HJ, et al. Central effects of adenosine analogs on locomotor activity in mice and antagonism of caffeine [J]. Brain Res, 1983, 272: 392-395. |
| [5] | Yarbrough GG, McGuffin-Clineschmidt JC. In vivo bahavioral assessment of central nervous system purinergic receptors [J]. Eur J Pharmacol, 1981, 76: 137-144. |
| [6] | Zarrindast MR, Heidari MR. Involvement of adenosine receptors in mouse thermoregulation [J]. J Psychopharmacol, 1993, 7: 365-370. |
| [7] | Gurden MF, Coates J, Ellis F, et al. Functional characterization of three adenosine receptor types [J]. Br J Pharmacol, 1993, 109: 693-698. |
| [8] | Fredholm BB, IJzerman AP, Jacobson KA, et al. International union of basic and clinical pharmacology. LXXXI. Nomenclature and classification of adenosine receptors -an update [J]. Pharmacol Rev, 2011, 63: 1-34. |
| [9] | Fredholm BB, Irenius E, Kull B, et al. Comparison of the potency of adenosine as an agonist at human adenosine receptors expressed in Chinese hamster ovary cells [J]. Biochem Pharmacol, 2001, 61: 443-448. |
| [10] | Hasko G, Linden J, Cronstein B, et al. Adenosine receptors: therapeutic aspects for inflammatory and immune diseases [J]. Nat Rev Drug Discov, 2008, 7: 759-770. |
| [11] | Shryock JC, Belardinelli L. Adenosine and adenosine receptors in the cardiovascular system: biochemistry, physiology, and pharmacology [J]. Am J Cardiol, 1997, 79: 2-10. |
| [12] | Tabrizchi R, Bedi S. Pharmacology of adenosine receptors in the vasculature [J]. Pharmacol Ther, 2001, 91: 133-147. |
| [13] | Dhalla AK, Shryock JC, Shreeniwas R, et al. Pharmacology and therapeutic applications of A1 adenosine receptor ligands [J]. Curr Top Med Chem, 2003, 3: 369-385. |
| [14] | Thomas T, St Lambert JH, Dashwood MR, et al. Localization and action of adenosine A2a receptors in regions of the brainstem important in cardiovascular control [J]. Neuroscience, 1999, 95: 513-518. |
| [15] | Liu L, Jia S, Dong J, et al. Sedative-hypnotic effect of YZG-330 and its effect on chloride influx in mouse brain cortical cells [J]. Acta Pharm Sin B, 2013, 3: 234-238. |
| [16] | Muzzi M, Blasi F, Masi A, et al. Neurological basis of AMP-dependent thermoregulation and its relevance to central and peripheral hyperthermia [J]. J Cereb Blood Flow Metab, 2013, 33: 183-190. |
| [17] | Lin MT, Chern YF, Chandra A, et al. Effects of adenosine 3', 5'-cyclic monophosphate on thermoregulation in both rats and rabbits [J]. J Neural Trans, 1981, 51: 257-269. |
| [18] | Olson JM, Jinka TR, Larson LK, et al. Circannual rhythm in body temperature, torpor, and sensitivity to A1 adenosine receptor agonist in arctic ground squirrels [J]. J Biol Rhythms, 2013, 28: 201-207. |
| [19] | Tupone D, Madden CJ, Morrison SF. Central activation of the A1 adenosine receptor (A1AR) induces a hypothermic, torpor-like state in the rat [J]. J Neurosci, 2013, 33: 14512-14525. |
| [20] | Barros RCH, Branco LGS, Cárnio EC. Respiratory and body temperature modulation by adenosine A1 receptors in the anteroventral preoptic region during normoxia and hypoxia [J]. Respir Physiol Neurobiol, 2006, 153: 115-125. |
| [21] | Yang JN, Chen JF, Fredholm BB. Physiological roles of A1 and A2A adenosine receptors in regulating heart rate, body temperature, and locomotion as revealed using knockout mice and caffeine [J]. Am J Physiol Heart Circ Physiol, 2009, 296: H1141-H1149. |
| [22] | Oishi Y, Huang ZL, Fredholm BB, et al. Adenosine in the tuberomammillary nucleus inhibits the histaminergic system via A1 receptors and promotes non-rapid eye movement sleep [J]. Proc Natl Acad Sci U S A, 2008, 105: 19992-19997. |
| [23] | Schindler CW, Karcz-Kubicha M, Thorndike EB, et al. Role of central and peripheral adenosine receptors in the cardiovascular responses to intraperitoneal injections of adenosine A1 and A2A subtype receptor agonists [J]. Br J Pharmacol, 2005, 144: 642-650. |
 2015, Vol. 50
2015, Vol. 50


