药代动力学是指药物在生物体内发生的吸收、分布、代谢和排泄的动力学过程,由多个药物代谢酶和转运体的共同作用完成。药物代谢酶和转运体蛋白的表达量和功能受环境因素和遗传因素的影响,从而导致药物在体内代谢的差异,影响药物的疗效和安全性[1]。因此,实现对药物代谢酶和转运体的定量描述,对阐明用药个体差异的原因,实现临床安全用药具有重要意义。
目前,对药物代谢酶和转运体定量和活性评价常采用逆转录聚合酶链式反应法 (RT-PCR)[2, 3]、2-维凝胶电泳法 (2D-PAGE)[4]、免疫印迹法 (Western blot)[5, 6]及探针底物法[7, 8],但这些方法存在许多不足: ① 由于mRNA翻译水平调控及蛋白质翻译后转移和修饰受多种因素的影响,因此所测得的mRNA的量不能准确代表药物代谢酶和转运体的表达水平; ② 由于药物代谢酶和转运体具有高度的序列同源性,因此现有免疫印迹法缺乏专属性,伴有一定的抗原-抗体交叉反应,导致定量准确性差; ③ 化学探针底物法可用于测定酶活性,并进一步预测酶对底物的催化作用,是药物研发的常用手段,但由于同一个探针底物可被多个酶催化,同一个酶可催化多个化合物,因此探针底物法的交叉反应导致其专属性较差。近几年来,随着生物质谱技术在定量蛋白质组学中的应用[9, 10, 11]及同位素标记技术的引入,可以更加准确和灵敏地对药物代谢酶和转运体进行定量分析,为传统的方法提供了重要的补充。本文将从蛋白质组学的角度出发,结合近年来生物质谱技术的发展,对药物代谢酶和转运体的定量研究做一综述介绍。
通常,蛋白的定量可以通过两种途径进行: 一是比较几个不同的生物样本中同一个蛋白的倍数关系,即蛋白的相对定量; 二是分析混合物中一种蛋白的绝对含量,即蛋白的绝对定量。目前,基于生物质谱的蛋白质组学定量方法主要步骤如下: ① 将来自于生物样本 (组织、细胞培养液、体液) 中的目标蛋白进行提取溶解; ② 通过电泳、液相色谱或等电聚焦方法对目标蛋白进行分离纯化; ③ 在蛋白酶的作用下,将目标蛋白进行消化酶解,得到相应的特征肽段; ④ 通过质谱对目标蛋白的特征肽段的分析,实现对蛋白的相对或绝对定量[12]。
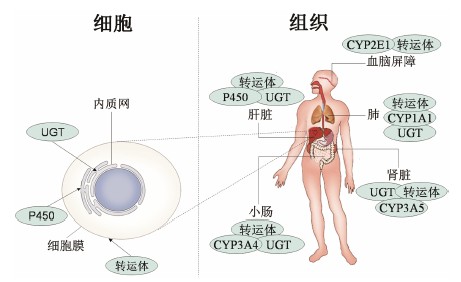
1 P450酶的定量分析细胞色素P450 (cytochrome P450,P450)是哺乳动物最主要的I相药物代谢酶,能够对大多数药物进行生物转化。在人体内,除肝脏含有丰富的P450酶外,肾、脑、肺、胃肠等器官和组织均有P450酶系存在,其主要分布在细胞的内质网上,图 1是P450酶在人体组织和细胞中的主要分布图[13, 14]。与体内许多其他酶一样,P450酶既可以被底物诱导,也可以被底物抑制,其结果是P450酶的表达量增加或减少,从而改变药物在体内的代谢途径和代谢程度。因此,越早阐明药物对P450酶表达量的影响,对于新药研发就具有越强的针对性,也就能更有效地减少新药研发的失败率。下面从相对定量和绝对定量两个方面来对近年来P450酶的定量研究加以介绍。
|
图 1 人体组织和细胞P450酶 (亚型)、UGT和转运体的主要分布图 |
Alterman等[15]采用基质辅助激光解析电离-飞行时间质谱 (matrix-assistedlaser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS) 对5种人P450酶亚型 (CYP2B1、CYP2B2、CYP1A2、CYP2E1和CYP2C19) 进行了定量分析。对于上述5种P450酶亚型各选择了一个特征肽段,通过测定特征肽段质谱峰面积的比值,实现了对P450酶亚型的相对定量。但由于生物样品中胰蛋白酶酶解所产生肽段的质荷比(m/z) 大约都在400~2 500之间,质谱检测很容易产生重叠的干扰信号,尤其在没有进行色谱分离的情况下,很难将重叠的干扰信号区分开,从而导致这种方法的特异性降低。Langenfeld等[12]研究发现,CYP2D6的特征肽段FSVSTLR [m/z405.225 6 (M+2H)2+] 和线粒体加工肽酶的特征肽段FTGSEIR [m/z 405.206 2 (M+2H)2+] 具有重叠的信号。因此,为了避免这种干扰,应该考虑其他特异性更高的方法。基于生物质谱的同位素亲和标签 (isotope coded affinity tag,ICAT) 法就是对上述方法的一个补充,并成功用于小鼠肝微粒体P450酶的相对定量[16]。尽管CYP1A1和CYP1A2具有80% 的序列同源性,但通过这种方法仍可有效区分,展示了生物质谱在具有高度序列同源性的P450酶分析上的强大优势。
Lane等[17]采用液相色谱-质谱 (liquidchromatography-mass spectrometry,LC-MS) 联用技术,通过16O/18O标记法获得了小鼠肝脏中CYP酶的谱图,测得小鼠肝脏中16种P450酶的相对含量,成功区分具有高度序列同源性的CYP2B10和CYP2B20 (87%) 以及CYP2C29、CYP2C37、CYP2C38和CYP2C40 (71%)。然而,未能区分具有更高序列同源性的CYP2A4和CYP2A5 (98%)。Wang等[18]采用同位素标记相对与 绝对定量技术 (isobaric tags for relative and absolute quantification,iTRAQ) 对人胆管癌组织中CYP2A6的调节规律的研究发现: 在肿瘤组织中,CYP2A6的表达是上调的。Jia等[19]通过对多肽N-末端的残基进行乙酰化修饰和对赖氨酸的ε-氨基进行胍基反应的方法,研究了四氯化碳对大鼠P450酶表达水平的影响,并对17种P450酶在四氯化碳作用下表达水平的变化进行了鉴定,得到的数据与文献[20, 21, 22, 23]报道一致。
1.2 P450酶的绝对定量由于P450酶的表达水平在一定范围内波动,因此其绝对定量必须考虑标准品的加入量与酶表达量相符合,从而保证混合物中二者数量可以比较。Duan等[24]采用液相色谱-串联质谱 (liquid chromatography-tandem mass spectrometry,LC-MS/MS) 技术,通过对待测物和标准品进行柱 前衍生化的方法,成功地对人CYP2D6、CYP2C9、CYP2C19、CYP2E1和CYP3A4进行了定量分析。但由于待测物和标准品所用的衍生化试剂不同 (依次为2-溴代-4'-氯苯乙酮和2,4'-二溴苯乙酮),导致二者在色谱柱上的保留时间不同,对结果的精密度产生了一定影响。Wang等[18]采用LC-MS/MS技术,通过应用同位素标记的特征肽段测得了一个66岁妇女肝脏样品中CYP2E1绝对量为100 fmol·μg-1 (蛋白)。Elmar等[25]采用LC-MS/MS联用技术测得26个肝脏样品CYP2D6的绝对量为0~80 fmol·μg-1蛋白,并且通过定量免疫印迹和活性分析实验对该结果进行了验证。
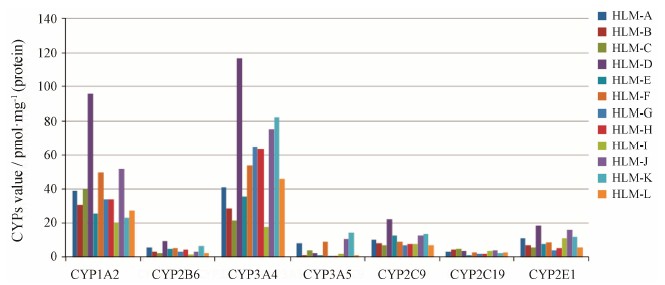
作者[26]采用蛋白质组学和稳定同位素稀释相结合方法以及MRM检测模式,测得12例黄种人肝微粒体样本中7种P450酶亚型CYP1A2、2B6、3A4、3A5、2C9、2C19和2E1平均绝对含量依次为39.3、4.3、54.0、4.6、10.3、3.0和9.3 pmol·mg−1 (蛋白),结果如图 2所示。同时,采用CYP3A4特异性探针底 物—蟾毒灵,对CYP3A4功能活性研究发现,CYP3A4表达水平与功能活性具有很好的相关性 (r = 0.943,P< 0.000 1),表明基于生物质谱技术的定量和传统的化学探针方法有着较好的一致性,为药物代谢酶的研究提供了新的方法。
|
图 2 12例不同个体肝微粒体 (HLM) 7种P450酶亚型CYP1A2、2B6、3A4、3A5、2C9、2C19和2E1绝对含量比较 |
从理论上讲,标准蛋白定量技术 (proteinstandard for absolute quantification,PSAQ) 是蛋白绝对定量的最优选择,但实际操作中,却并不适合于所有P450酶的分析,因为有些P450酶亚型并不适合异源性表达,如CYP3A4。除此之外,需要翻译后修饰的蛋白质也可能会表现出不同的理化性质。目前,还没有PSAQ技术在P450酶定量应用的相关报道,但是已有许多关于P450酶表达条件和纯化的报道[27, 28, 29, 30]。在PSAQ的情况下,标准品和分析物以相同的方式进行消化,化学修饰和消化限制对二者都是同时存在的。可以预期,这种方法对P450酶可进行准确定量。
2 UGT的定量分析尿苷二磷酸-葡萄糖醛酸转移酶 (uridine-diphosphate glucuronosyl transferases,UGT) 是哺乳动物的II相代谢酶,主要参与化学物质在生物体内的结合反应。UGT广泛分布于机体内各个组织器官,包括肝脏、肠道、肾脏等,在肝脏中的表达最高 (如图 1所示)。UGT参与多种内源性物质、外源性物质和有毒物质的生物转化,从而使化合物极性增加,利于经肾脏排出体外,起到“解毒”的作用[31]。与P450酶一样,UGT的基因表达同样受外来物质的调控,UGT所催化的葡萄糖醛酸结合反应受到特定酶亚型的表达水平和功能活性的双重调节。基因缺陷和多态性可影响各个同工酶的活性,由此产生十分有害的甚至是潜在的致命性作用。因此,UGT的定量分析及定量分析方法研究是十分重要的。
Harbourt等[32]采用LC-MS/MS法对人体内肝、肾以及肠微粒体中UGT1A亚家族中的9种亚型的定量研究发现: 肝和肠微粒体UGT1A亚家族的表达水平为3~96 pmol·mg-1蛋白,但肝微粒体中UGT1A7、1A8和1A10亚型的含量却低于检测限 [1 pmol·mg-1 (蛋白)]; 肾微粒体中UGT1A3含量低于检测限,但UGT1A4、1A7、1A9及1A10含量却高于肝微粒体,表明肾脏葡萄糖醛酸化反应是葡萄糖醛酸结合物消除过程中一个很关键的因素。Sato等[33]采用LC-MS/MS法对16例个体肝微粒体UGT1A1和2B7的测定显示: UGT1A1含量为6.50~44.6 pmol·mg-1(蛋白),UGT2B7含量为4.45~18.2 pmol·mg-1 (蛋白); 同时发现,雌二醇3β-葡萄糖醛酸化反应与UGT1A1的表达水平密 切相关,表明雌二醇是UGT1A1的一个相对专一的反应底物; 吗啡的3-O-和6-O-葡萄糖醛酸化反应与UGT2B7的表达水平也具有重要相关性,但线性回归分析却显示,吗啡的葡萄糖醛酸化反应并非仅由UGT2B7介导,其他UGT亚型也有一定作用。如同P450酶的功能活性分析,同样需要开发每个UGT亚型专一性的探针底物,以便对UGT的表达水平和功能活性进行更深入的研究。
Fallon等[34]用同位素稀释法对UGT1A和2B亚家族的14种亚型进行了定量研究,对于每一个亚型,他们都选择了两个或两个以上的特征肽段来进行分析,避免了由于蛋白酶解不完全而对结果产生的影响。在他们的实验中,对来自60个人的肝微粒体样本和相应的S9组分进行了分析,检测了肝脏中10种UGT亚型,并且发现所得到的每一种亚型的含量与文献报道的相应mRNA的表达水平是一致的。在所有测试的样本中,30% 的肝微粒体中检测不到UGT2B17,这与UGT2B17的多态性一致。除此之外,他们还发现,肝S9组分中UGT亚型的含量大约是肝微粒体中相应亚型的10%~15%,这一结果与酶活性检测和免疫印迹法所得到的结果符合。
3 药物转运体的定量分析转运体是一种介导分子或离子跨膜转运的膜蛋白,主要表达在小肠、肝脏、肾脏和血脑屏障等生物膜上 (如图 1所示),介导机体对药物的摄取和外排过程,在药物的吸收、分布和消除过程中发挥着重要作用,对于维持人正常生理功能具有重要意义。转运体的突变会引发一系列疾病,如系统性肉碱缺乏、囊胞性纤维症等,转运体也是肿瘤细胞产生耐药机制的主要原因。传统的免疫测定不能真实地反映体内转运体蛋白的表达水平,如采用RT-PCR进行定量转运体的前提是mRNA的含量与转运体的表达量呈现正相关,但文献[35]研究表明,在考察的22种转运体中,只有有机阴离子转运聚合肽段 (OATP1B1) 的mRNA的含量与蛋白表达量呈正相关,其余的几乎无相关性; 相对而言,Western blott的方法更适合评价转运体的表达水平,但是由于部分转运体缺乏特异性抗体,使该方法的应用受到了限制。高效、快速和灵敏的LC-MS/MS定量方法规避了上述方法的缺点,正在逐渐被广泛使用。人体中的转运体主要分为3类: ABC转运体 (ATP-binding cassettetransporters)、可溶性物质转运蛋白 (solute carriers,SLC) 家族和质子/寡肽转运体 (POT)。人类ABC转运体由7个亚家族组成,共有49个成员,其中P-糖蛋白 (P-gp) 属于B亚家族,多药耐药蛋白 (MRPs) 属于C亚家族,乳腺癌耐药蛋白 (BCRP) 属于G亚家族的第二位成员; SLC家族由48个亚家族组成,共有364个成员; 而POT家族仅发现两个成员。
Kamiie等[36]采用LC-MS/MS法,对大鼠组织中的转运体进行了定量分析。他们先将组织样品酶解,再将酶解液与同位素标记的特征肽段混合,最后通过质谱进行分析。通过纳升液相色谱的分离和质谱的MRM检测模式相结合的方法,成功地对大鼠脑组织、肝脏组织和肾脏组织中的34种膜蛋白转运体进行了定量分析。血液和脑组织间存在血脑屏障,可影响药物在中枢神经系统中的浓度和效应。而内皮细胞上发现的一系列控制着药物进入脑实质速度和程度的转运体,使人们更倾向于将血脑屏障认为是一种药理学屏障。因此,对血脑屏障上的转运体进行分析测定,对于评价用药安全性和有效性具有重要意义,目前已有相关文献[37]对此研究进行了报道,他们采用RT-PCR和LC-MS/MS相结合的方法考察了离体脑组织微管中71种SLC及有机溶质转运体 (OST),34种ABC转运体的mRNA和蛋白含量,为药物在血脑屏障中的摄取和代谢研究提供了新的生物分子机制。
3.1 ABC转运体的定量分析P-糖蛋白 (P-glycoprotein,P-gp/ABCB1)广泛存在于肝脏、肾脏、肝胆通道和血脑屏障的细胞膜上,能将许多具有药理活性的底物排出细胞外,进而影响药物的治疗效果,这也是许多细胞具有耐药性的原因所在。因此,P-糖蛋白的定量分析,对于研究药物在体内的处置、器官靶向和药物耐受等方面至关重要。Kamiie等[36]利用LC-MS/MS方法,同时定量了34种膜蛋白转运体,但由于分析成分过多,大大降低了检测的灵敏度。对于MDCK野生型细胞而言,P-gp的含量很低,Zhang等[38]采用LC-MS/MS法,在硅元素的条件下,通过对细胞和组织样品的酶解,实现了对P-糖蛋白的定量分析。
多药耐药现象 (multi-drug resistance,MDR)主要是由ABC转运体家族引起的,它们利用ATP水 解提供的能量将药物泵出细胞外,导致癌细胞呈现一定的抗药性。MRP2/ABCC2和BCRP/ABCG2都 是ABC转运体家族的重要成员,它们是造成多种癌细胞产生MDR的主要原因。MRP2/ABCC2在许多药物及其代谢产物的肝胆外排中起着重要作用,对该转运体的定量至关重要。Li等[39]采用LC-MS/MS方法,通过对特定的胰蛋白酶水解片段的定量,实现了对该转运体的定量,并且还将该方法成功应用于被MRP2/ABCC2基因转染的MDCK细胞中MRP2/ABCC2的绝对含量分析中,成功测定了MDCK细胞中MRP2/ABCC2的基底水平。Li等[40]用上述开发的方法,又进一步分析了大鼠、狗、猴和人类肝脏组织及其肝细胞中MRP2的含量。结果发现: 新鲜分离的肝细胞中MRP2的含量和肝脏组织中MRP2含量相当,但当分离出的大鼠肝细胞被冻存后,转运体含量降低很多; 大鼠MRP2的含量大概是其他种属的10倍。该结果不仅为药物的种间差异提供了数据支撑,而且为建立体内外数据的相关性奠定了基础。Deo等[41]利用LC-MS/MS方法对MRP2/ABCC2的个体 间差异进行了研究,通过对51例人空白肝脏的考察,发现人体内MRP2的含量为 (1.54 ± 0.64)fmol·μg-1 (蛋白),且结果与志愿者的年龄和性别无关。
BCRP/ABCG2位于胆管膜上,是很多药物通过胆汁外排的原因,也是很多药物具有个体差异性的原因。Prasad等[42]采用LC-MS/MS方法,成功地对50例肝脏样本中的BCRP表达水平进行了测定,平均含量为 (137.9 ± 42.1)atmol·μg-1 (蛋白),且BCPR的表达水平与年龄、性别以及mRNA表达水平无相关性。Li等[43]建立了一种同时定量分析BCRP和胆盐输出泵 (BSEP/ABCG11) 的LC-MS/MS分析方法,并用该方法测定了不同种属间BCRP和BSEP的含量差异,得到的结果分别是狗 > 大鼠 > 猴 ≈ 人和大鼠 ≈ 猴 > 狗 ≈ 人。另外,他们还发现新鲜分离的肝脏细胞和冷冻保存的肝脏细胞中BCRP的表达水平与肝脏组织中的表达水平相当,这些研究结果为临床前动物实验数据外推到人奠定了基础。
3.2 SLC转运体的定量分析OATP1B1、OATP1B3和OATP2B1是OATP家族中重要的膜蛋白转运体,在肝脏对内源性和外源性物质的降解过程中发挥着重要作用。Ji等[44]开发了一种同时测定被OATP质粒 (SLCO1B1、SLCO1B3和SLCO2B1) 转染的HEK细胞体系、人类肝细胞体系、人类大脑毛细血管内皮细胞体系和人源化的大鼠肝脏组织体系内的OATP1B1、OATP1B3和OATP2B1含量的LC-MS/MS方法,为OATP家族的研究奠定了坚实的基础。
4 结论与展望药物在体内的代谢过程由药物代谢酶和转运体共同介导,而它们的活性及表达水平决定了药物的药代动力学过程。对相关的药物代谢酶和转运体进行研究,可以为药物研发和临床上药物-药物相互作用研究提供科学依据。基于液相色谱-质谱联用技术的定量分析方法,克服了传统分析方法灵敏度低、专属性差的不足,实现了对药物代谢酶和转运体的定量研究。这将为深入研究其修饰形态和活性的关系[45]、肿瘤组织中酶的表达与药物代谢的相关性[46]等提供新的方法和思路。
| [1] | Liu Y, Hong L, Yu LS, et al. The role of ADME evaluation in translation research of innovative drug [J]. Acta Pharm Sin (药学学报), 2011, 46: 19-29. |
| [2] | Caron E, Rioux N, Nicolas O, et al. Quantification of the expression and inducibility of 12 rat cytochrome P450 isoforms by quantitative RT-PCR [J]. J Biochem Mol Toxicol, 2005, 19: 368-378. |
| [3] | Rodriguez-Antona C, Jover R, Gomez-Lechon MJ, et al. Quantitative RT-PCR measurement of human cytochrome P-450s: application to drug induction studies [J]. Arch Biochem Biophys, 2000, 376: 109-116. |
| [4] | Rabilloud T, Chevallet M, Luche S, et al. Fully denaturing two-dimensional electrophoresis of membrane proteins: a critical update [J]. Proteomics, 2008, 8: 3965-3973. |
| [5] | Rasmussen MK, Ekstrand B, Zamaratskaia G. Comparison of cytochrome P450 concentrations and metabolic activities in porcine hepatic microsomes prepared with two different methods [J]. Toxicol In Vitro, 2011, 25: 343-346. |
| [6] | Serron SC, Dwivedi N, Backes WL. Ethylbenzene induces microsomal oxygen free radical generation: antibody-directed characterization of the responsible cytochrome P450 enzymes [J]. Toxicol Appl Pharmacol, 2000, 164: 305-311. |
| [7] | Rhodes SP, Otten JN, Hingorani GP, et al. Simultaneous assessment of cytochrome P450 activity in cultured human hepatocytes for compound-mediated induction of CYP3A4, CYP2B6, and CYP1A2 [J]. J Pharmacol Toxicol Methods, 2011, 63: 223-226. |
| [8] | Yuan R, Madani S, Wei XX, et al. Evaluation of cytochrome P450 probe substrates commonly used by the pharmaceutical industry to study in vitro drug interactions [J]. Drug Metab Dispos, 2002, 30: 1311-1319. |
| [9] | Villanueva J, Carrascal M, Abian J. Isotope dilution mass spectrometry for absolute quantification in proteomics: concepts and strategies [J]. J Proteomics, 2014, 96: 184-199. |
| [10] | Yu Y, Xu J, Liu Y, et al. Quantification of human serum transferrin using liquid chromatography-tandem mass spectrometry based targeted proteomics [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2012, 902: 10-15. |
| [11] | Bronstrup M. Absolute quantification strategies in proteomics based on mass spectrometry [J]. Expert Rev Proteomics, 2004, 1: 503-512. |
| [12] | Langenfeld E, Meyer HE, Marcus K. Quantitative analysis of highly homologous proteins: the challenge of assaying the “CYP-ome” by mass spectrometry [J]. Anal Bioanal Chem, 2008, 392: 1123-1134. |
| [13] | Scripture CD, Figg WD. Drug interactions in cancer therapy [J]. Nat Rev Cancer, 2006, 6: 546-558. |
| [14] | Holmström KM, Finkel T. Cellular mechanisms and physiological consequences of redox-dependent signaling [J]. Nat Rev Mol Cell Biol, 2014, 15: 411-421. |
| [15] | Alterman MA. Quantitative analysis of cytochrome P450 isozymes by means of unique isozyme-specific tryptic peptides: a proteomic approach [J]. Drug Metab Dispos, 2005, 33: 1399-1407. |
| [16] | Jenkins RE, Kitteringham NR, Hunter CL, et al. Relative and absolute quantitative expression profiling of cytochromes P450 using isotope-coded affinity tags [J]. Proteomics, 2006, 6: 1934-1947. |
| [17] | Lane CS, Wang Y, Betts R, et al. Comparative cytochrome P450 proteomics in the livers of immunodeficient mice using 18O stable isotope labeling [J]. Mol Cell Proteomics, 2007, 6: 953-962. |
| [18] | Wang Y, Al-Gazzar A, Seibert C, et al. Proteomic analysis of cytochromes P450: a mass spectrometry approach [J]. Biochem Soc Trans, 2006, 34: 1246-1251. |
| [19] | Jia N, Liu X, Wen J, et al. A proteomic method for analysis of CYP450s protein expression changes in carbon tetrachloride induced male rat liver microsomes [J]. Toxicology, 2007, 237: 1-11. |
| [20] | Jeong HG, You HJ, Park SJ, et al. Hepatoprotective effects of 18beta-glycyrrhetinic acid on carbon tetrachloride-induced liver injury: inhibition of cytochrome P450 2E1 expression [J]. Pharmacol Res, 2002, 46: 221-227. |
| [21] | Junnila M, Rahko T, Sukura A, et al. Reduction of carbon tetrachloride-induced hepatotoxic effects by oral administration of betaine in male Han-Wistar rats: a morphometric histological study [J]. Vet Pathol, 2000, 37: 231-238. |
| [22] | Wong FW, Chan WY, Lee SS. Resistance to carbon tetrachloride-induced hepatotoxicity in mice which lack CYP2E1 expression [J]. Toxicol Appl Pharmacol, 1998, 153: 109-118. |
| [23] | Yokogawa K, Watanabe M, Takeshita H, et al. Serum aminotransferase activity as a predictor of clearance of drugs metabolized by CYP isoforms in rats with acute hepatic failure induced by carbon tetrachloride [J]. Int J Pharm, 2004, 269: 479-489. |
| [24] | Duan X, Chen X, Yang Y, et al. Precolumn derivatization of cysteine residues for quantitative analysis of five major cytochrome P450 isoenzymes by liquid chromatography/tandem mass spectrometry [J]. Rapid Commun Mass Spectrom, 2007, 21: 3234-3244. |
| [25] | Langenfeld E, Zanger UM, Jung K, et al. Mass spectrometry-based absolute quantification of microsomal cytochrome P450 2D6 in human liver [J]. Proteomics, 2009, 9: 2313-2323. |
| [26] | Liu X, Hu L, Ge G, et al. Quantitative analysis of cytochrome P450 isoforms in human liver microsomes by the combination of proteomics and chemical probe-based assay [J]. Proteomics, 2014, 14: 1943-1951. |
| [27] | Yu A, Kneller BM, Rettie AE, et al. Expression, purification, biochemical characterization, and comparative function of human cytochrome P450 2D6.1, 2D6.2, 2D6.10, and 2D6.17 allelic isoforms [J]. J Pharmacol Exp Ther, 2002, 303: 1291-1300. |
| [28] | Matsuda F, Miyazawa H, Wakasa K, et al. Quantification of indole-3-acetic acid and amino acid conjugates in rice by liquid chromatography-electrospray ionization-tandem mass spectrometry [J]. Biosci Biotechnol Biochem, 2005, 69: 778-783. |
| [29] | Dutton DR, McMillen SK, Parkinson A. Purification of rat liver microsomal cytochrome P-450b without the use of nonionic detergent [J]. J Biochem Toxicol, 1988, 3: 131-145. |
| [30] | Wei JY, Ding C, Zhang J, et al. High-throughput absolute quantification of proteins using an improved two-dimensional reversed-phase separation and quantification concatemer (QconCAT) approach [J]. Anal Bioanal Chem, 2014, 406: 4183-4193. |
| [31] | Gao CY, Cheng XY, Zhong DF. Role of transporters in hepatic drug disposition [J]. Acta Pharm Sin (药学学报), 2012, 47: 565-572. |
| [32] | Harbourt DE, Fallon JK, Ito S, et al. Quantification of human uridine-diphosphate glucuronosyl transferase 1A isoforms in liver, intestine, and kidney using nanobore liquid chromatography-tandem mass spectrometry [J]. Anal Chem, 2012, 84: 98-105. |
| [33] | Sato Y, Nagata M, Kawamura A, et al. Protein quantification of UDP-glucuronosyltransferases 1A1 and 2B7 in human liver microsomes by LC-MS/MS and correlation with glucuronidation activities [J]. Xenobiotica, 2012, 42: 823-829. |
| [34] | Fallon JK, Neubert H, Hyland R, et al. Targeted quantitative proteomics for the analysis of 14 UGT1As and -2Bs in human liver using nano UPLC-MS/MS with selected reaction monitoring [J]. J Proteome Res, 2013, 12: 4402-4413. |
| [35] | Ohtsuki S, Schaefer O, Kawakami H, et al. Simultaneous absolute protein quantification of transporters, cytochromes P450, and UDP-glucuronosyltransferases as a novel approach for the characterization of individual human liver: comparison with mRNA levels and activities [J]. Drug Metab Dispos, 2011, 40: 83-92. |
| [36] | Kamiie J, Ohtsuki S, Iwase R, et al. Quantitative atlas of membrane transporter proteins: development and application of a highly sensitive simultaneous LC/MS/MS method combined with novel in-silico peptide selection criteria [J]. Pharm Res, 2008, 25: 1469-1483. |
| [37] | Shawahna R, Uchida Y, Declèves X, et al. Transcriptomic and quantitative proteomic analysis of transporters and drug metabolizing enzymes in freshly isolated human brain microvessels [J]. Mol Pharm, 2011, 8: 1332-1341. |
| [38] | Zhang Y, Li N, Brown PW, et al. Liquid chromatography/ tandem mass spectrometry based targeted proteomics quantification of P-glycoprotein in various biological samples [J]. Rapid Commun Mass Spectrom, 2011, 25: 1715-1724. |
| [39] | Li N, Nemirovskiy OV, Zhang Y, et al. Absolute quantification of multidrug resistance-associated protein 2 (MRP2/ABCC2) using liquid chromatography tandem mass spectrometry [J]. Anal Biochem, 2008, 380: 211-222. |
| [40] | Li N, Zhang Y, Hua F, et al. Absolute difference of hepatobiliary transporter multidrug resistance-associated protein (MRP2/Mrp2) in liver tissues and isolated hepatocytes from rat, dog, monkey, and human [J]. Drug Metab Dispos, 2008, 37: 66-73. |
| [41] | Deo AK, Prasad B, Balogh L, et al. Interindividual variability in hepatic expression of the multidrug resistance-associated protein 2 (MRP2/ABCC2): quantification by liquid chromatography/tandem mass spectrometry [J]. Drug Metab Dispos, 2012, 40: 852-855. |
| [42] | Prasad B, Lai Y, Lin Y, et al. Interindividual variability in the hepatic expression of the human breast cancer resistance protein (BCRP/ABCG2): effect of age, sex, and genotype [J]. J Pharm Sci, 2013, 102: 787-793. |
| [43] | Li N, Palandra J, Nemirovskiy OV, et al. LC-MS/MS mediated absolute quantification and comparison of bile salt export pump and breast cancer resistance protein in livers and hepatocytes across species [J]. Anal Chem, 2009, 81: 2251-2259. |
| [44] | Ji C, Tschantz WR, Pfeifer ND, et al. Development of a multiplex UPLC-MRM MS method for quantification of human membrane transport proteins OATP1B1, OATP1B3 and OATP2B1 in in vitro systems and tissues [J]. Anal Chim Acta, 2012, 717: 67-76. |
| [45] | Li YH, Bi HC, Huang M. CYP450 Effects of posttranslational modification on the activity of cytochrome P450: current progress [J]. Acta Pharm Sin (药学学报), 2011, 46: 487-492. |
| [46] | Xiao WJ, Wang GJ, A JY. A review of the expression and activity of drug metabolism enzymes in tumorous cells [J]. Acta Pharm Sin (药学学报), 2014, 49: 1377-1386. |
 2015, Vol. 50
2015, Vol. 50


