2. 昆明理工大学材料科学与工程学院, 云南 昆明 650500;
3. 云南省先进电池及材料工程实验室, 云南 昆明 650500
2. Faculty of Materials Science and Engineering, Kunming University of Science and Technology, Kunmimg 650500, China;
3. Engineering Laboratory for Advanced Battery and Material of Yunnan Province, Kunming 650500, China
由于独特的抗癌机制、较强的抗癌活性以及较宽的抗癌谱,铂类药物一直是临床治疗恶性肿瘤的重要药物之一,据统计,目前在化疗或联合化疗治疗恶性肿瘤的方案中,70%~80% 都要用到铂类药物[1, 2, 3]。继顺铂后,有卡铂 (carboplatin)、奈达铂 (nedaplatin)、奥沙利铂 (oxaliplatin)、舒铂 (sunplatin,SKI-2053R)、乐铂 (lobaplatin) 和米铂 (miriplatin) 等6个铂类抗肿瘤药物 (图 1) 先后在各国上市。尽管铂类抗肿瘤药物取得了巨大的成功,但同时也存在很多临床应用的障碍,如无靶向性、易产生毒副作用、耐药性或交叉耐药性等问题[4]。
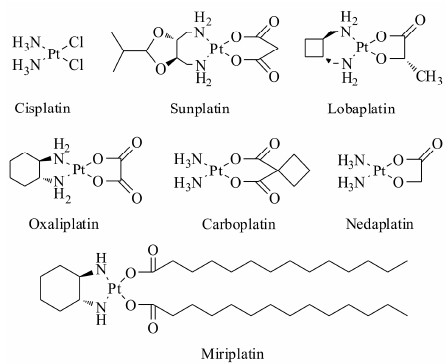
|
图 1 7个经典顺铂类抗肿瘤药物 |
人体内复杂的生理环境决定了很多药物在到达作用部位前的体内运转过程中会发生分解或降解,因而降低药物的治疗效果,随之而来出现各种毒副作用。超分子大环化合物在诸如自组装、分子识别与仿生研究、药学等领域得到了广泛的应用,尤其是超分子给药体系的研究与开发尤为引人注目。最初的超分子给药体系研究以第一代和第二代超分子化合物冠醚和环糊精等为主体分子; 随后,第三代大环化合物葫芦脲、杯芳烃等给药体系的研究也开始被人们所关注[5]。构建超分子给药体系不仅能在药物控制释放、手性识别、模拟酶、分子开关等方面起着重要作用,而且能大大改善客体药物的溶解度,消除药物异味,提高药物体内生物利用度,降低不良反应,克服耐药性; 同时还可实现特定组织和器官的靶向给药,提高生物相容性等。超分子给药体系具有的稳定性、安全性、低毒性和靶向性等优点,使得其在当前新药研究和开发中,特别是在抗肿瘤药物的研发中,受到了广泛的关注。典型的如抗癌药物阿霉素与甲基-β-环糊精在水溶液中形成主-客体1∶1的包合物,增大了阿霉素的水溶性,阿霉素经过甲基-β-环糊精包合后IC50值由自身的3.1 μmol·L-1增加到了14.3 μmol·L-1,从而提高了药效[6]; 利用冠醚的两亲衍生物形成的类脂质体包合5-氟尿嘧啶,能够长时间控制药物的释放,提高了所负载药物的稳定性[7]。研究者将超分子给药体系运用在铂类抗肿瘤药物中,利用其增溶、增效、低毒等优势,弥补目前传统铂类药物的缺点,提高治疗效果。下面主要介绍三代超分子化学主体大环类化合物冠醚、环糊精、葫芦脲和杯芳烃与铂类抗肿瘤药物构建新型给药体系的研究进展。
1 冠醚与铂类药物冠醚又叫“大环醚”,是一种包含有多个氧原子的大环有机化合物 (图 2)。最常见的冠醚是乙撑氧的低聚物,其中重复的单位是乙烯氧基,属于第一代超分子大环化合物,其中四聚体、五聚体和六聚体应用最为广泛,其合成方法很多,比较具有代表性的是二氯三亚乙基二醚与三甘醇在碱性条件下利用威廉森合成法制备18-冠-6。冠醚与金属离子和小的有机分子有很强的结合能力,能作为离子载体转运离子透过疏水的生物膜。利用冠醚的优良特性对药物进行改良,构建药物−冠醚给药体系,从而使药物在理化性质以及体内生物利用度方面得到较大的改善[8]。

|
图 2 常见冠醚的一般结构及其衍生物 |
Keppler等[9]用联吡啶冠醚作为载体基团合成了一系列顺铂衍生物 (图 3),体外抗肿瘤活性测试结果表明其在结直肠癌和卵巢癌中都显示了很好的抑癌活性。这类化合物采用氯离子作为离去基团,通过调节冠醚环的大小,化合物的亲水性也能相应有所改变,庞大的冠醚结构减缓了配合物的降解过程,亲水性和亲脂性的平衡使得其膜通透性得到提高。
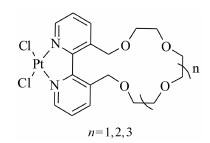
|
图 3 联吡啶冠醚-铂配合物 |
Yoo等[10]利用联吡啶冠醚得到顺铂 (在L1210细胞系中IC50 = 0.11 μg·mL-1) 衍生物,其中当n = 2,3时的顺铂衍生物的抑制作用最强 (n = 3在P188细胞系中的ED50 = 19.7μg·mL-1,n = 2时在L1210细胞系中的ED50 = 28.0μg·mL-1),采用酯基作为联吡啶与冠醚的连接桥,并尝试用环丁基二羧酸作为离去基团,得到一组卡铂的冠醚衍生物 (图 4);在L1210和P388白血病细胞系中均显示一定的细胞抑制作用,其中当n = 3时,化合物显示了良好的水溶性 (10倍于顺铂)。

|
图 4 新型联吡啶-冠醚酯键-铂配合物 |
Jansen等[11]利用氮杂-15(18)-冠醚作为载体基团,直接与铂配合,得到一组单核及多核的冠醚-铂配合物。研究发现,其中15元环化合物 (图 5) 在人卵巢癌A278细胞系 (IC50分别为21 μmol·L-1和 > 100 μmol·L-1) 中的细胞毒性要高于顺铂(IC50 = 0.37μmol·L-1),表明了冠醚在其中起到了关键作用。

|
图 5 氮杂冠醚顺铂衍生物 |
环糊精作为第二代超分子主体化合物,是由6~12个D-吡喃葡萄糖基以α-1,4-葡萄糖苷键连接而成的环状低聚糖,具有亲水的外壁和疏水的空腔,能够包合一些水溶性较差的小分子药物如双氢青蒿素,用以改善和增强它们的水溶性和稳定性[12]。自然界中存在的环糊精主要有3种,分别是α-、β-、γ-环糊精,其中β-环糊精的空腔大小与大多数小分子药物较为匹配[13]。近年来,化学修饰的改性环糊精衍生物拓展了环糊精的优良理化性质,增强了其包合能力; 这些无定形非晶体环糊精衍生物因具有更佳的水溶性和稳定性,且相比环糊精体内毒性更小,而被广泛应用于新型药物剂型的研究和开发中[14]。
Olivi等[15]利用α-环糊精包合卡铂,得到的1∶1包合物增强了卡铂在脑肿瘤治疗中的疗效。利用羧 基-β-环糊精包合[(5,6-dimethyl-1,10-phenanthroline) (1S,2S-diaminocyclohexane)platinum(II)]2+ (56MESS)、[(5,6-dimethyl-1,10-phenanthroline) (1R,2R-diaminocy- clohexane)platinum (II)]2+ (56MERR)、[(5,6-dimethyl- 1,10-phenanthroline)(ethylenediamine)platinum (II)]2+ (56MEE) 3种铂类配合物 (图 6),结果显示环糊精空腔与这些化合物的邻二氮杂菲基团能形成稳定的1∶1包合物。56MESS经过包合后,由于β-环糊精形成的空间位阻,明显降低了L-谷胱甘肽导致的铂药物降解,并且56MESS在结直肠癌细胞系中的细胞毒性没有降低,因此羧基-β-环糊精作为该类铂药物的转运载体具有较好的发展前景。
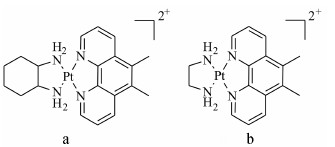
|
图 6 56MESS/56MERR (a)、56MEEN (b) 的结构式 |
反式二吡啶二氯合铂在一些传统顺铂类药物耐药的肿瘤株上显示了良好的抑癌活性,但是极低的水溶性 (几乎不能溶解)和低生物利用度极大地限制了其进一步的研究开发。Horvath等[16]利用β-环糊精包合反式二吡啶二氯合铂,这种包合物不仅在水溶性 (1.6 mg·mL-1) 方面与顺铂(约1mg·mL-1) 相比得到了一定的改善,在抗肿瘤活性方面,对于结直肠癌细胞系CT26与黑色素瘤细胞系B16F10的抗肿瘤活性分别达到了顺铂的4.6和6.1倍。Xia等[17]通过计算得出反式二吡啶二氯合铂是从β-环糊精的窄端进入,形成1∶1包合模式,β-环糊精-反铂包合物给药体系的构建对于其进一步的开发提供了新的思路。
Anconi等[18]对于环糊精与铂类药物的包合行为进行了更深入的研究,选取了3种已上市的经典铂类药物: 卡铂、奥沙利铂和奈达铂与α-环糊精进行包合,B3LYP/6-31G的交互能量参数评价显示出这3种顺铂类药物能与α-环糊精形成稳定的1∶1包合体。
金刚烷与β-环糊精的内部空腔有着极佳的匹配度,能形成非常稳定的主客体包合结构。Prashar等[19]将金刚烷醇与丙二酸通过长的烷烃链联接,作为离去基团,得到了一种新型的卡铂衍生物1 (图 7),其制备方法如图 8。体外抗肿瘤活性测试表明,化合物1在成神经细胞瘤细胞系中表现出的抗肿瘤活性要明显优于卡铂,SK-N-SH细胞系的存活率比给予卡铂刺激时下降约6%,原因可能是由于环糊精包合物作为大分子可以很好的利用ERP (enhancedpermeability and retention effect) 效应以内吞的形式进入肿瘤细胞内部,从而避开了载体蛋白介导的顺铂耐药性问题[20]。Dabrowiak等[21]类似地利用甲胺金刚烷与四价的c,t,c-[PtCl2(OH)(O2CCH2CH2CO2H)(NH3)2]键接,得到的化合物2再与β-环糊精形成1∶1的包合物 (图 7),这种药物在人体成神经瘤细胞系中也显示出了一定的抗肿瘤活性。
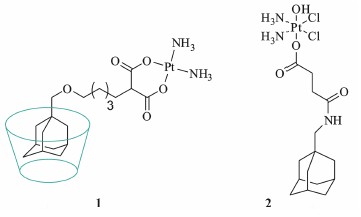
|
图 7 铂类金刚烷衍生物以及其环糊精包合模型 |
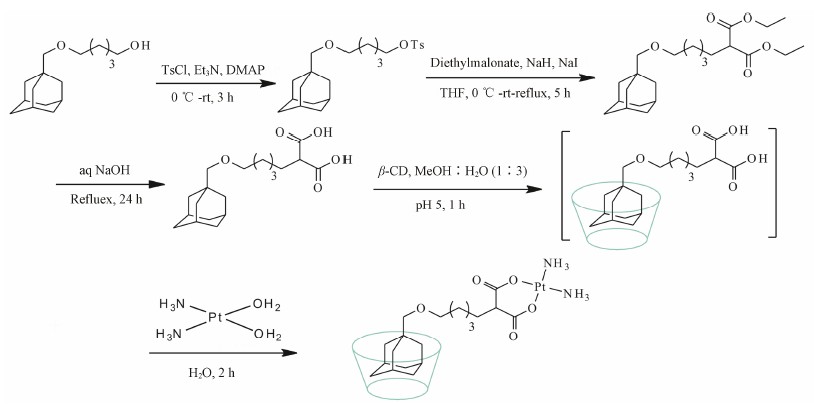
|
图 8 β-环糊精包合金刚烷卡铂衍生物的制备过程 |
Matsumoto等[22]利用氨基环糊精及乙二胺环糊精与铂配合,得到不同的环糊精-铂键接物,其中氨基环糊精与乙二胺环糊精作为载体基团,预期可以提高铂配合物的水溶性和细胞膜穿透能力。但是该类铂配合物的细胞毒性测试结果并不乐观,环糊精较大的结构以及其产生的空间位阻效应反而阻碍了细胞对铂单元的摄取,并导致化合物难以与DNA很好的结合[22]。Egloff等[23]合成了6A,6D位咪唑基双取代的甲基化α、β环糊精,并进一步与铂配合,得到了两组环糊精-铂配合物 (图 9),对于这些化合物的后续研究尚在进行中。
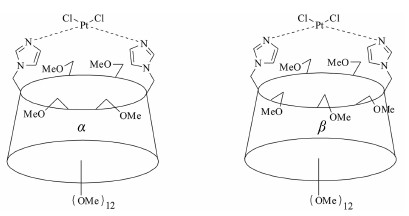
|
图 9 6A,6D位咪唑基双取代的甲基化α、β环糊精-铂配合物 |
葫芦脲是一类拥有内腔的大环穴状配体(图 10),得名于其特殊的类似南瓜的形状。1905年Behrend等[24]首次发现了葫芦[6]脲环 (cucurbit[6]uril,CB[6]),通过乙二醛和尿素在酸性条件下反应,得到的甘脲与甲醛在强酸溶液中缩合可以方便的制得。葫芦脲疏水内腔和由极性羰基基团形成的端口,使其具有极强的高度专一的主-客体键合能力。经X射线晶体衍射及光谱分析,表明葫芦[6, 7, 8]脲的空腔尺寸分别与α-、β-、γ-环糊精相似[25]。
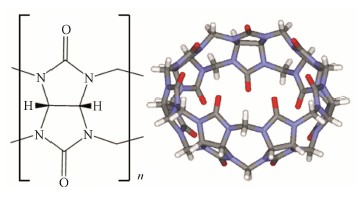
|
Figure 10 葫芦脲的基本单元 (n = 5,6,7,8,10) 和葫芦[7]脲 |
作为铂类药物载体,葫芦[5]脲的口径明显要小于一般铂的有机配体结构大小,而葫芦[10]脲基本上无法和绝大多数铂类化合物形成稳固的包合模式,因此葫芦[6, 7, 8]脲是比较理想的主体化合物。葫芦脲微溶于水,但是与一些铂类化合物 (尤其是阳离子型铂类化合物或者多核铂类化合物) 形成包合体后,水溶性能得到一定程度的改善[26]。顺铂能被葫芦[7]脲完全地包合进空腔,卡铂则无法与葫芦[7]脲形成包合物,而奥沙利铂则是部分被葫芦[7]脲所包合,另一部分则暴露在葫芦[7]脲的外部 (图 11)。通过X射线晶体结构看出,奥沙利铂与葫芦脲依靠1R,2R-环己二胺与葫芦脲内腔之间的疏水间相互作用紧密联结在一起的,同时氨基与葫芦脲上的羰基形成的氢键也使得该结构进一步稳固,而此时的铂原子则是处于葫芦脲的内腔的门口[27]。关于葫芦[n]脲与经典铂类药物的包合结构模型各项参数Nojini小组有相关文献报道[28]。

|
图 11 奥沙利铂的葫芦[7]脲包合模型 |
葫芦[7]脲和葫芦[8]脲具有足够大的内腔口径,能够允许一些分子尺寸较大的反式单核、双核和三核铂类化合物进入内腔形成包合结构。以上铂类化合物之所以能够与葫芦脲形成稳定包合物结构,其原因主要是铂类化合物上的氨基与葫芦脲的羰基之间的氢键作用以及铂类化合物自身配体的空间结构与葫芦脲内腔的匹配程度[29],这同时也成为在合成葫芦脲与铂类化合物包合物时所首要考虑的因素。
铂类药物在体内的降解失活是阻碍其临床应用的重要关键[30],铂单元容易受到亲核物质的进攻,例如谷胱甘肽、半胱氨酸、蛋氨酸、游离的腺嘌呤以及一些阴离子如磷酸盐、硫酸盐、氨基甲酸盐等,从而导致大量铂单元失去与肿瘤细胞DNA结合的机会[29]。利用葫芦脲作为铂药物转运载体,能够保护药物免于水解或者亲核物质的进攻,使得药物能够顺利到达药效部位。奥沙利铂是一种光敏的化合物,但是葫芦[7]脲包合的奥沙利铂能稳定地保存一年,并且在37 ℃的环境下与谷胱甘肽的结合速率下降到一般情况下的2~3倍,与蛋氨酸的结合速率下降了15倍。di-Pt(trans-[{PtCl(NH3)2}2μ-dpzm]2+)(di-Pt) 在小鼠白血病细胞系L1210以及耐药细胞系L1210/DDP的IC50值分别为3.8和8.8 μmol·L-1,而葫芦[7]脲与di-Pt的1∶1包合物在上述细胞系的IC50值分别为2.6和16.5 μmol·L-1,可以看出,葫芦[7]脲并没有使得铂类化合物的细胞毒性发生明显改变[31]。同样的,葫芦[7]脲包合的BBR3571在L1210细胞系的IC50值与BBR3571本身的IC50值相比也没有明显的减小,而在L1210/DDP细胞系中IC50只有微弱的减小[32, 33, 34]。
不同于顺铂的非经典三核铂类化合物BBR3464在治疗非小细胞肺癌的Ⅱ期临床试验中显示出较好的抗肿瘤活性,但是由于临床试验毒性太大[35],并没有进入Ⅲ期临床试验[1]。Hegmans等[34]利用它研究了葫芦脲分子大小与铂类药物细胞毒性的关系。采用葫芦[7, 8, 10]脲分别与BBR3464形成包合物,经过细胞测试后发现,葫芦脲不同程度地降低了BBR3464的细胞毒性,并且葫芦脲的环越大,降低的程度越小,可能是由于药物更容易从空腔大的葫芦脲分子中释放出来。
葫芦[7]脲包合的奥沙利铂在针对于肺癌、卵巢癌、黑色素瘤和结肠癌细胞系的的抗癌活性测试中,和奥沙利铂相比下降了6~19倍。葫芦脲包合的铂类化合物细胞毒性下降的原因可能有两点[26]: ① 葫芦脲在减少亲核物质对铂类化合物的进攻的同时也阻碍了铂类化合物与肿瘤细胞DNA形成加合物;② 葫芦脲可能影响了肿瘤细胞对铂类化合物的摄取,导致铂类药物无法以理想的浓度在细胞内积累。
在未来的以葫芦脲作为铂类药物转运载体的研究中,一些功能性的葫芦脲 (例如靶向葫芦脲) 尤其值得关注,键接上某些DNA或者RNA的寡核苷酸 适配子,并与肿瘤组织过量表达的蛋白相结合,这样就能达到靶向给药目的,从而降低铂类药物的副作用[36, 37]。
4 杯芳烃与铂类药物杯芳烃是由多个苯酚单元和甲醛在碱性条件下缩合得到的大环低聚化合物,根据苯酚单元数,将其命名为杯[n]芳烃。现在常见的杯芳烃主要有杯[4, 6, 8]芳烃[38]。这类聚合物具有独特的大小可调控的空腔结构,已成为继冠醚和环糊精之后的第三代大环超分子主体化合物,具有如下的突出特性[39]: ① 是一类合成的环状低聚体,空穴结构具有较大的调节自由度; ② 兼有冠醚和环糊精两者之长,既有疏水性的空腔以包合中性分子,又有极性的酚羟基,可与离子形成络合物; ③ 通过有机合成,可获得各种衍生物; ④ 具有多种构象异构体并可以进行构象转换,这对于分子识别和模拟酶具有重要意义。
由于杯芳烃的水溶性差,因此需要通过结构修饰,改变功能性基团来增强其水溶性,对磺酸基杯芳烃 (p-sulphonatocalix[4]arene,s-CX[4]) (图 12) 就是杯芳烃化合物家族中非常值得关注的一例[39]。s-CX[4]上4个磺酸基结构极大地增强了化合物分子的水溶性,并且与一些小分子化合物或蛋白质有很好的亲和性。体外实验中,并没有观察到s-CX[4]的任何溶血性毒性反应,而在活体实验中,给予100 mg·kg-1的剂量下也没有任何毒性产生,因此s-CX[4]在作为药物转运载体领域具有非常大的潜力[40]。
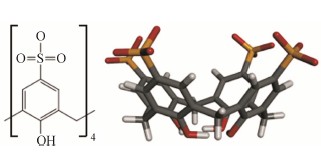
|
图 12 磺酸基杯芳烃的结构式及其碗状分子模型 |
Wheate小组利用未修饰的杯[6]芳烃对56MESS、56MERR、56MEEN三种铂类DNA嵌入剂进行包合尝试,没有成功得到预想的包合产物。后采用s-CX[4]作为主体,由于磺酸基与铂原子的离子-偶极和离子-离子的相互作用,轻松地得到了s-CX[4]与这3种铂类化合物的包合物[40]。通过NOESY二维核磁谱可以看出两个56MESS分子是以头对尾的形式被两个s-CX[4]分子包合,形成一种2∶2的包合模式。56MESS被L-谷胱甘肽降解的半衰期是68 h,顺铂是3.3 h; 当56MESS与1摩尔量的s-CX[4]形成包合物后,在4倍摩尔量的L-谷胱甘肽中半衰期增长至9天[41],这得益于这种2∶2的结构,十分充分的包合了铂原子上所有的配体,足够的空间位阻效应很好地降低了L-谷胱甘肽对于铂单元降解的速度。在56MESS与s-CX[4]包合物的体外活性测试中,选取人类结直肠癌细胞系为对象,发现s-CX[4]对56MESS的IC50值几乎没有影响,而相比于之前葫芦脲包合的这3种化合物,s-CX[4]的包合物具有更好的水溶性[41]。
杯芳烃也可以被用来包合多核铂化合物,并且远远高出葫芦脲与铂类化合物形成的包合物的水溶性 (不足1 mg·mL-1)。起初Wheate认为s-CX[4]与di-Pt包合模式是将铂原子中心包合进去,同时包含两个氨基,由于离子-离子间作用力加上氢键作用,这种结构是一种最稳定的结构。但是后期通过核磁共振谱研究显示,s-CX[4]实际上是将其二吡唑甲烷配体包合进去,通过疏水效应形成更稳定的包合物[42] (图 13)。最近报道利用杯[4]芳烃包合一组新型双核铂化合物a1~a3 (图 14),该化合物在人体卵巢癌细胞系中表现出10倍于顺铂的活性,这类化合物与杯[4]芳烃的包合模式也是类似于di-Pt/s-CX[4]的包合模式。
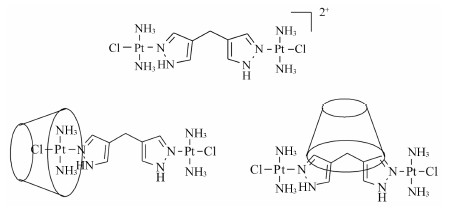
|
图 13 di-Pt及其s-CX[4]包合模型 |
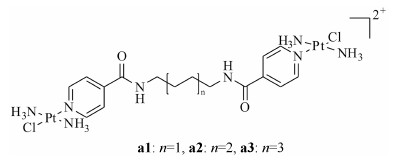
|
图 14 a1~a3 (n = 1,2,3) 的结构式 |
在人体卵巢癌细胞系A2780以及耐药性细胞系A2780cisR活性测试中,经过s-CX[4]包合后,a1~a3的细胞毒性并未受到显著的影响,其在人卵巢癌细胞系A2780和A2780cp70中测得IC50值分别为 (0.030 ± 0.004) μmol·L-1、(0.026 ± 0.004)μmol·L-1、(0.052 ± 0.018) μmol·L-1,而顺铂的IC50值为 (0.22 ± 0.03)μmol·L-1,di-Pt的细胞毒性略有提升,56MESS经过s-CX[4]包合后显著降低了L-谷胱甘肽对其的降解速率 (t1/2 > 9天)。这也意味着作为一个良好的药物载体,s-CX[4]在不降低药物活性的前提下已经达到了增加水溶性、提升稳定性的目的。但是体外实验的成功并不能代表复杂的体内实验也能收到良好的结果,因此对于s-CX[4]的研究仍需要大量的体内实验数据来提供可靠的支持[43]。
5 总结及展望超分子大环化合物应用到铂类药物研发中,构建铂抗肿瘤药物-大环化合物给药体系,为解决目前铂药物临床应用中的诸多问题以及发现新型的铂抗肿瘤药物提供了新的思路和方法。通过超分子化学主体环糊精以及杯芳烃衍生物等构建的新型给药体系在水溶性和稳定性等方面都有了显著的改善,对于解决一些抗癌活性突出的新型铂类药物水溶性差、容易降解等问题具有十分重要的意义。
未来关于铂类药物-大环化合物给药体系的构建,应不仅仅局限在改善客体药物理化性质上,具有明确肿瘤靶向基团的超分子键接物如叶酸-环糊精键接物[44]、胆固醇-环糊精键接物以及叶酸-葫芦脲键接物等,都可以作为铂类药物的主体化合物或配体基团,用来准确地将铂类药物带入到靶肿瘤组织和器官,这样不仅能有效地降低铂类抗肿瘤药物在体内运转过程中因降解失活带来的损失,还能因其靶向性明确而降低铂药物对于正常器官和组织的毒副作用,同时也为靶向给药研究[45]提供一定指导作用。另一方面,因为超分子大环化合物构建的铂载药体系可以更好的利用肿瘤细胞表面的ERP效应,这就与传统小分子铂类药物的跨膜运转机制具有明显的差别,在克服经典顺铂类药物耐药性问题方面也能取得良好的效果。
| [1] | Oberoi HS, Nukolova NV, Kabanov AV, et al. Nanocarriers for delivery of platinum anticancer drugs [J]. Adv Drug Deliv Rev, 2013, 65: 1667-1685. |
| [2] | P Farrell N. Platinum formulations as anticancer drugs clinical and pre-clinical studies [J]. Curr Top Med Chem, 2011, 11: 2623-2631. |
| [3] | Muggia F. Platinum compounds 30 years after the introduction of cisplatin: implications for the treatment of ovarian cancer [J]. Gynecol Oncol, 2009, 112: 275-281. |
| [4] | Wang XY, Guo ZJ. Targeting and delivery of platinum-based anticancer drugs [J]. Chem Soc Rev, 2013, 42: 202-224. |
| [5] | Chen Y, Liu Y. Cyclodextrin-based bioactive supramolecular assemblies [J]. Chem Soc Rev, 2010, 39: 495-505. |
| [6] | Laza-Knoerr AL, Gref R, Couvreur P. Cyclodextrins for drug delivery [J]. J Drug Target, 2010, 18: 645-656. |
| [7] | Muzzalupo R, Nicoletta FP, Trombino S, et al. A new crown ether as vesicular carrier for 5-fluoruracil: synthesis, characterization and drug delivery evaluation [J]. Colloid Surface B, 2007, 58: 197-202. |
| [8] | Lee SF, Zhu XM, Wang YXJ, et al. Ultrasound, pH, and magnetically responsive crown-ether-coated core/shell nanoparticles as drug encapsulation and release systems [J]. ACS Appl Mater Interfaces, 2013, 5: 1566-1574. |
| [9] | Gund A, Keppler BK. Structure of an antineoplastic platinum complex with a bipyridyl-crown ether [J]. Angew Chem Int Edit, 1994, 33: 186-188. |
| [10] | Yoo J, Sohn YS, Do Y. Synthesis, structures and antitumor activity of the first crown ester-linked bipyridyl platinum complexes [J]. J Inorg Biochem, 1999, 73: 187-193. |
| [11] | Jansen BAJ, Wielaard P, den Dulk H, et al. Oxa-aza crown ethers as ligands for mixed-ligand cisplatin derivatives and dinuclear platinum anticancer drugs [J]. Eur J Inorg Chem, 2002, 2002: 2375-2379. |
| [12] | Chen FW, Guo T, Li HY, et al. Preparation and characterization of dihydroartemisinin/hydroxypropyl-β-cyclodextrin inclusion complex [J]. Acta Pharm Sin (药学学报), 2012, 47: 529-534. |
| [13] | Del Valle EM. Cyclodextrins and their uses: a review [J]. Proc Biochem, 2004, 39: 1033-1046. |
| [14] | Matsuda H, Arima H. Cyclodextrins in transdermal and rectal delivery [J]. Adv Drug Deliv Rev, 1999, 36: 81-99. |
| [15] | Olivi A, Ewend MG, Utsuki T, et al. Interstitial delivery of carboplatin via biodegradable polymers is effective against experimental glioma in the rat [J]. Cancer Chemother Pharmacol, 1996, 39: 90-96. |
| [16] | Horvath G, Premkumar T, Boztas A, et al. Supramolecular nanoencapsulation as a tool: solubilization of the anticancer drug trans-dichloro (dipyridine) platinum (II) by complexation with β-cyclodextrin [J]. Mol Pharm, 2008, 5: 358-363. |
| [17] | Xia Y, Wang X, Zhang Y, et al. Complexation of alkali-metal cations by conformationally rigid, stereoisomeric calix [4] arene crown ethers: a density functional theory study [J]. Comput Theor Chem, 2011, 967: 235-242. |
| [18] | Anconi C, da Silva Delgado L, Alves dos Reis JB, et al. Inclusion complexes of α-cyclodextrin and the cisplatin analogues oxaliplatin, carboplatin and nedaplatin: a theoretical approach [J]. Chem Phys Lett, 2011, 515: 127-131. |
| [19] | Prashar D, Shi Y, Bandyopadhyay D, et al. Adamantane-platinum conjugate hosted in β-cyclodextrin: enhancing transport and cytotoxicity by noncovalent modification [J]. Bioorg Med Chem, 2011, 21: 7421-7425. |
| [20] | Rosenbaum AI, Zhang G, Warren DJ, et al. Endocytosis of beta-cyclodextrins is responsible for cholesterol reduction in Niemann-Pick type C mutant cells [J]. Proc Natl Acad Sci USA, 2010, 107: 5477-5482. |
| [21] | Shi Y, Goodisman J, Dabrowiak JC. Cyclodextrin capped gold nanoparticles as a delivery vehicle for a prodrug of cisplatin [J]. Inorg Chem, 2013, 52: 9418-9426. |
| [22] | Matsumoto K, Noguchi Y, Yoshida N. Synthesis and antitumor activity of platinum (II) complexes of amino-cyclodextrin [J]. Inorg Chim Acta, 1998, 272: 162-167. |
| [23] | Egloff C, Gramage-Doria R, Jouffroy M, et al. Chelating properties of permethylated 6A, 6D-dideoxy-6A, 6D-bis(1-imidazolyl) cyclodextrins towards Pt (II) and Ru (III) [J]. CR Chim, 2013, 16: 509-514. |
| [24] | Behrend R, Meyer E, Rusche F. Condensation products of glycoluril and formaldehyde [J]. Ann Chem, 1905, 339: 1-37. |
| [25] | Sindelar V, Silvi S, Parker SE, et al. Proton and electron transfer control of the position of cucurbit[n]uril wheels in pseudorotaxanes [J]. Adv Funct Mater, 2007, 17: 694-701. |
| [26] | Wheate NJ, Buck DP, Day AI, et al. Cucurbit [n] uril binding of platinum anticancer complexes [J]. Dalton Trans, 2006, 3: 451-458. |
| [27] | Jeon YJ, Kim SY, Ko YH, et al. Novel molecular drug carrier: encapsulation of oxaliplatin in cucurbit [7] uril and its effects on stability and reactivity of the drug [J]. Org Biomol Chem, 2005, 3: 2122-2125. |
| [28] | Nojini ZB, Yavari F, Bagherifar S. Preference prediction for the stable inclusion complex formation between cucurbit [n=5-7] urils with anticancer drugs based on platinum (II): computational study [J]. J Mol Liq, 2012, 166: 53-61. |
| [29] | Wheate NJ. Improving platinum (II)-based anticancer drug delivery using cucurbit [n] urils [J]. J Inorg Biochem, 2008, 102: 2060-2066. |
| [30] | Reedijk J. Why does cisplatin reach guanine-N7 with competing S-donor ligands available in the cell? [J]. Chem Rev, 1999, 99: 2499-2510. |
| [31] | áGrant Collins J. Multi-nuclear platinum complexes encapsulated in cucurbit [n] urils as an approach to reduce toxicity in cancer treatment [J]. Chem Commun, 2004, 12: 1424-1425. |
| [32] | Roberts JD, Beggiolin G, Manzotti C, et al. Comparison of cytotoxicity and cellular accumulation of polynuclear platinum complexes in L1210 murine leukemia cell lines [J]. J Inorg Biochem, 1999, 77: 47-50. |
| [33] | Billecke C, Finniss S, Tahash L, et al. Polynuclear platinum anticancer drugs are more potent than cisplatin and induce cell cycle arrest in glioma [J]. Neuro Oncol, 2006, 8: 215-226. |
| [34] | Hegmans A, Kasparkova J, Vrana O, et al. Aptamers: an emerging class of therapeutics [J]. J Med Chem, 2008, 51: 2254-2260. |
| [35] | Hensing TA, Hanna NH, Gillenwater HH, et al. Phase II study of BBR 3464 as treatment in patients with sensitive or refractory small cell lung cancer [J]. Anti-Cancer Drug, 2006, 17: 697-704. |
| [36] | Nimjee SM, Rusconi CP, Sullenger BA. Aptamers: an emerging class of therapeutics [J]. Annu Rev Med, 2005, 56: 555-583. |
| [37] | Butler JS, Sadler PJ. Targeted delivery of platinum-based anticancer complexes [J]. Curr Opin Chem Biol, 2013, 17: 175-188. |
| [38] | Redshaw C. Coordination chemistry of the larger calixarenes [J]. Coordin Chem Rev, 2003, 244: 45-70. |
| [39] | Ryu EH, Zhao Y. Efficient synthesis of water-soluble calixarenes using click chemistry [J]. Org Lett, 2005, 7: 1035-1037. |
| [40] | Davis F. Calixarenes [M] // Higson S. Macrocycles: Constructions, Chemistry and Nanotechnology Applications. Berlin: Springer-Verlag, 2011: 77-117. |
| [41] | Krause-Heuer AM, Wheate NJ, Tilby MJ, et al. Substituted β-cyclodextrin and calyx [4] arene as encapsulatory vehicles for platinum (II)-based DNA intercalators [J]. Inorg Chem, 2008, 47: 6880-6888. |
| [42] | Wheate NJ, Buck DP, Day AI, et al. Cucurbit [n] uril binding of platinum anticancer complexes [J]. Dalton Trans, 2006, 3: 451-458. |
| [43] | Brown S, Plumb JA, Johnston BF, et al. Folding of dinuclear platinum anticancer complexes within the cavity of para-1 sulphonatocalix arene [J]. Inorg Chim Acta, 2012, 393: 182-186. |
| [44] | Zhao MX, Li Y, Wang CJ. Synthesis and bioactivity of the folate receptor targeted β-cyclodextrin-folate inclusion-coated CdSe/ZnS quantum dots [J]. Acta Pharm Sin (药学学报), 2013, 48: 566-572. |
| [45] | Zhou PJ, Deng SQ, Gong QF. Recent development of targeted drug delivery system [J]. Acta Pharm Sin (药学学报), 2010, 45: 300-306. |
 2015, Vol. 50
2015, Vol. 50


