缺血性脑中风是老年人常见的一种疾病, 由于脑内动脉阻塞等原因引起相应脑区缺血缺氧, 进而导致神经元损伤及神经系统功能失调, 较高的致死率和致残率已使其成为危害公共健康的主要疾病之一[1]。由于确切的病因和发病机制尚不十分清楚, 所以目前缺乏有效的治疗措施。临床上常用溶栓药物 重组组织型纤溶酶原激活剂(recombinant tissue plasminogenactivator, rtPA) 治疗急性缺血性脑中风[2], 以期溶解血栓, 重建脑内血液循环, 改善预后。然而, rtPA疗效的发挥常受限于治疗时间窗和较多的副作用, 所以, 寻找一种新型的治疗缺血性脑中风的药物已成为当务之急。传统中药丹参 (Radix Salviae Miltiorrhizae) 及丹参提取物广泛用于治疗心脑血管疾病如冠心病、粥样硬化、脑中风等[3]已有多年的历史。在缺血、缺氧致脑损伤的动物模型研究发现丹参中含有的丹参酮类物质能够有效对抗中枢神经系统缺血性损伤, 保护缺血区神经元, 降低缺血再灌注所造成的迟发性神经元凋亡, 减轻水肿, 减小脑梗死范围, 改善脑缺血引发的神经功能学症状。其中, 丹参酮IIA作为丹参的主要活性成分之一, 对短暂的局灶性大鼠脑缺血损伤具有保护作用[4], 对永久性的局灶性脑缺血也表现出较好的保护作用[5]。目前, 有关丹参酮IIA及其结构类似物的神经保护作用的研究越来越多, 本文综述了近年来丹参酮IIA对缺血性脑中风的神经保护作用研究进展。
1 抗炎作用炎症反应在缺血所致的脑损伤病理过程中起着重要的作用[6]。脑缺血后发生炎症反应的重要标志之一是胶质细胞的活化[7]。胶质细胞是中枢神经系统内数量最多的一类免疫细胞, 不仅能为神经元提供营养和支持, 而且还能调节神经递质的释放, 维持脑内稳态的平衡, 因此在神经系统疾病中发挥着极其重要的作用。当其被大量激活时也会分泌产生大量的炎症因子和神经毒性物质, 引发炎症反应。在局灶性脑缺血损伤的大鼠脑内发现星型胶质细胞活化标志物神经胶质纤维酸性蛋白 (glial fibrillary acidic protein, GFAP) 表达明显提高, 而提前给予丹参酮IIA磺酸钠可减少由于脑缺血引起的GFAP表达增加[8], 表明丹参酮IIA可通过抑制星形胶质细胞的活化和增殖, 减轻中枢神经系统内炎症反应而缓解缺血和缺氧引起的神经元损伤。此外,在缺血性脑中风患者脑内可见大量活化的小胶质细胞[9], 表明小胶质细胞与脑缺血的发病过程密切相关, 虽然小胶质细胞在脑缺血损伤中的作用目前尚存在争议[10], 但是抑制脑缺血损伤中小胶质细胞的过度活化, 阻断小胶质细胞介导的炎症反应将为缺血性脑中风的治疗提供新的思路和途径。
众所周知, 炎症反应是由促炎因子和炎症抑制因子之间的平衡来决定的。促炎因子如肿瘤坏死因子 (tumor necrosis factor-α, TNF-α) 和白介素-6 (lnterleukin-6, IL-6) 等释放会诱发和加重炎症反应, 而炎症抑制因子如IL-10和转化生长因子等则会抑制促炎因子的表达, 减轻炎症反应,参与受损组织的修复。脑缺血发生时, 激活的小胶质细胞和星型胶质细胞会释放出大量的促炎因子, 加剧神经元的损伤。此外, 脑缺血还会引起血脑屏障通透性的改变, 导致大量外周炎症细胞浸润, 加重局部的神经元损伤。在动脉结扎所致脑缺血再灌注的大鼠模型中, 丹参酮IIA可明显降低脑内TNF-α和IL-6的水平。同时, 发现丹参酮IIA还可明显抑制外周中性粒细胞的浸润[11]。本实验室的研究还发现, 在用脂多糖刺激BV2小胶质细胞引起的炎症模型中, 丹参酮IIA可明显抑制一氧化氮 (nitric oxide, NO) 和TNF-α的释放 (数据尚未发表)。
核转录因子-κB (nuclear factor-κB, NF-κB) 信号通路是介导炎症反应的重要信号通路[12]。NF-κB是与炎症及凋亡有关的重要转录因子, 静息状态下与其抑制子 (inhibitor of κB, IκB) 结合以二聚体形式存在于细胞浆内, 激活后IκB降解, NF-κB从胞浆转移到核内并与相应的DNA反应元件结合, 启动相关炎症因子基因的转录和表达。脑缺血能激活NF-κB[13], 促进多种炎症因子及凋亡基因的表达。研究发现, 丹参酮IIA可抑制NF-κB的核转位, 进而抑制炎症反应[14]。
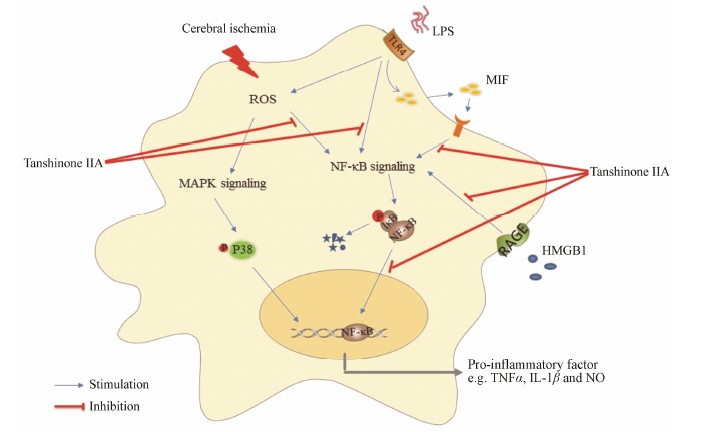
NF-κB作为多条炎症信号通路的共同作用靶点, 可被多种上游分子激活。有证据表明高迁移率族蛋白Bl (high mobility group box l, HMGB-l) 诱导的核转录因子信号通路激活在炎症应答反应中起着重要的作用[15]。在正常状态下, HMGB-1存在于多种细胞核内并与DNA结合, 参与核小体的形成并调节基因转录过程。当细胞损伤或坏死时, HMGB-1会释放到细胞外, 与细胞膜上相应受体结合, 进而激活NF-κB合成并释放大量细胞黏附分子和促炎因子, 损伤神经元。研究发现丹参酮IIA可明显减少HMGB-1的生成和降低炎症反应, 所以认为通过抑制HMGB-1的生成而减轻对下游炎症信号通路的激活可能是丹参酮IIA在脑缺血中发挥神经保护作用的机制之一[14]。巨噬细胞游走抑制因子 (macrophage migration inhibitory factor, MIF) 诱导的核转录因子信号通路也在缺血性脑损伤中起着重要作用。MIF是一种促炎因子, 参与众多炎症反应[16], 在脑缺血的动物实验中, MIF可以促进神经元死亡, 加重神经功能损伤[17]。由于炎症 参与了脑缺血再灌注损伤的过程, 有学者认为丹参酮IIA在小鼠局灶性脑缺血再灌注损伤过程中的神经保护作用可能与抑制MIF的表达有关,并用实验证实了丹参酮IIA确实可以减少脑内MIF表达, 同时抑制NF-κB活性, 减少TNF-α和IL-6释放。以上研究表明, 丹参酮IIA是一种较强的神经炎症抑制剂, 可通过抑制炎症反应而保护神经元, 见图 1。
2 抗氧化及清除自由基作用正常情况下体内氧自由基的生成和消除处于平衡状态。当脑缺血发生时, 组织供氧量减少, 再灌注恢复了组织氧供应, 使活性氧自由基如羟自由基、过氧化氢、NO和过氧硝酸盐等在短时间内爆发性增多[18],当超过了机体自身的清除能力时, 便会与细胞的各种成分反应, 引起脂质过氧化、细胞膜损伤和基因突变等造成细胞代谢和功能障碍。此外, 经线粒体氧化呼吸链产生的活性氧自由基还可作为重要的信号分子, 通过激活NF-κB信号通路导致一系列促炎因子的产生, 加重细胞毒性作用和氧化应激损伤[19]。
|
Figure 1 Schematic diagramillustrating the signaling pathways involved in tanshinone IIA’santi-inflammatory activity. Microglial cells are activated during brain ischemia and produce neurotoxic inflammatory mediators such as TNF-α and IL-1β. Tanshinone IIA decreases the expression of HMGB1and MIF, suppresses NF-κB translocation into nuclear, consequently reduces theproduction of inflammatory cytokines. HMGB1: Highmobility group box 1; MIF: Macrophage migration inhibitory factor; LPS: Lipopolysaccharide;TLR4: Toll-like receptor 4; RAGE:Receptor for advanced glycation end products |
体外和体内实验均表明, 丹参酮IIA具有显著的抗氧化作用。在体外丹参酮IIA具有较强的抑制低 密度脂蛋白 (low density lipoprotein, LDL) 氧化的作用,其机制可能与清除羟基自由基、改变LDL结构有关[20]。在急性脑缺血患者的血清内可检测到丙二醛的大量升高, 表明体内氧自由基的大量生成。过氧化物歧化酶 (superoxidedismutase, SOD) 是一种内源性的抗氧化剂, 具有清除体内氧自由基的作用。大鼠大脑中动脉结扎致脑缺血模型中可检测到血清中丙二醛的水平明显上升, SOD的活性明显下降, 而丹参酮IIA可显著增强SOD活性, 降低丙二醛水平, 表明丹参酮IIA在体内亦具有较强的抗氧化活性[5]。
3 抗凋亡作用细胞凋亡是引起神经元死亡的主要途径之一[21], 对机体清除受损细胞、维持正常新陈代谢等具有重 要意义。缺血性脑损伤时神经元同时有坏死和凋亡的发生, 坏死主要发生在缺血中心区, 而凋亡主要位于半暗带区。半暗带区是梗塞灶周围的脑组织, 部分功能受损,但仍为可修复的脑组织。丹参酮IIA正是通过保护此部位的神经元, 减小脑梗死的面积。在脑缺血的半暗带区常可见神经元的选择性死亡, 且在缺血损伤后3~4天才发生, 该现象称为神经元延迟性死亡(delayed neuronal death, DND)。神经元的延迟性死亡和细胞凋亡的发生密切相关[22]。
目前已发现众多参与细胞凋亡信号调节的蛋白, 其中Bcl-2基因家族在细胞凋亡的线粒体途径中起着重要的调控作用, 该家族同时包括凋亡促进蛋白和凋亡抑制蛋白。抑制凋亡的蛋白有Bcl-2、Bcl-xl等, 促进凋亡的蛋白有Bax、Bak、Bad等。半胱氨酸天冬氨酸蛋白酶 (Caspase 3) 则被认为是细胞凋亡最关键的凋亡蛋白酶,Caspase 3的激活将最终导致细胞凋亡。如果能通过抑制细胞凋亡基因或降低细胞凋亡相关蛋白的表达从而抑制细胞凋亡过程的发生, 将有可能减少脑缺血过程中神经元死亡的数量, 而丹参酮IIA可以明显降低大鼠缺血梗死灶周边神经元凋亡数量, 抑制Caspase-3的活性, 提高Bcl-2的表 达[23]。表明丹参酮IIA可通过抑制细胞凋亡而保护缺血和缺氧引起的神经元损伤。
很多研究表明, 丝裂原活化蛋白激酶信号通路 (mitogen-activated protein kinases, MAPKs) 参与细胞内炎症反应和细胞存活的调节[24], 其中胞外信号调节激酶 (extracellular signal-regulated kinase, ERK) 介导的信号通路通过调节Bax/Bcl-2/Bcl-xL的表达在脑缺血再灌注损伤导致的细胞凋亡过程中起到重要的作用[25]。进一步研究表明, 给予结合阳离子化牛血清白蛋白的聚乙二醇纳米丹参酮IIA治疗, 可明显降低ERK1/2基因的表达水平及相应的蛋白表达量[26], 说明丹参酮IIA的抗凋亡作用与调节MAPK信号通路有关。
4 其他作用脑缺血时坏死的细胞会释放出大量的谷氨酸, 激活临近神经元上的N-甲基-D-天冬氨酸 (N-methyl- D-aspartate receptors,NMDA) 受体, 导致大量的钙离子、钠离子和氯离子内流, 引起神经元去极化和 渗透压的改变, 最终导致神经元水肿和死亡。在丹 参酮IIA对新生大鼠缺血缺氧性脑损伤皮层神经元NMDA-1受体亚基表达以及细胞内游离钙离子浓度影响的研究中, 发现丹参酮IIA可通过降低NMDA-1受体的表达, 减少细胞内游离钙的聚集, 从而拮抗谷氨酸释放造成的兴奋性神经毒性[27]。
TORC1-CREB-BDNF信号通路对脑缺血后神经元的恢复和存活起着重要的作用[28]。cAMP反应元件结合蛋白(response element binding protein, CREB) 是一种广泛存在的核转录因子, 可因各种细胞外刺激磷酸化而激活, 磷酸化的CREB可直接或间接促进相关基因的转录, 进而表达某些神经营养因子如脑源性神经营养因子 (brain derived neurotrophic factor, BDNF) 和碱性成纤维细胞生长因子等, 这些基因产物对神经元在应激性损伤后的再生、存活和修复过程起着重要的作用。CREB往往需要和一些共激活因子相互作用协调发挥激活效应, CREB活性调节转导子(transducers of regulated CREB, TORCs) 就是近年来新发现的一类特异性较强的CREB共激活因子, 其对CREB-BDNF通路的调控作用已成为研究热点之一。对丹参酮IIA的研究表明, 它可抑制缺血性脑中风急性期TORC1的核转移, 上调TORC1的表达及CREB的磷酸化[29], 从而揭示一种全新的丹参酮IIA的神经保护作用机制。
5 结语与展望丹参酮IIA可通过抑制炎症、氧化应激和细胞凋亡等在缺血性脑损伤动物模型中发挥显著的神经保护作用, 是一种新型的神经保护剂。此外, 由于脑内炎症反应、氧化应激、细胞凋亡等也参与神经退行性疾病的发生和发展, 所以推测丹参酮IIA可能对神经退行性疾病也有一定的保护作用, 已有相关的文献报道丹参酮IIA可以明显减轻老年痴呆模型大鼠脑内的氧化损伤[30]及抑制Aβ引起的神经元的凋亡[31]。但目前对丹参酮IIA的研究仍停留在临床前研究阶段, 丹参酮IIA的开发还面临着很多问题。临床研究中缺血性脑中风的影响因素远没有动物模型那么简单[32], 单纯一种干预手段也不能有效减轻神经退行性疾病的症状。如何明确丹参酮IIA的作用靶点、解决水溶性问题、建立新的临床研究思路等将是今后更重要的课题。尽管如此, 从动物实验得到的实验数据对丹参酮IIA用于治疗缺血性脑中风和神经退行性疾病有了初步了解, 为以后的研究打下坚实的基础。鉴于其在体内外实验中表现出的生物学活性, 丹参酮IIA的神经保护作用及作用机制值得深入研究。
| [1] | Pendlebury ST, Rothwell PM. Prevalence, incidence and factors associated with pre-stroke and post-stroke dementia: a systematic review and meta-analysis [J]. Lancet Neurol, 2009, 8: 1006-1018. |
| [2] | Fugate JE, Rabinstein AA. Update on intravenous recombinant tissue plasminogen activator for acute ischemic stroke [J]. Mayo Clin Proc, 2014, 89: 960-972. |
| [3] | Zhou L, Zuo Z, Chow MS. Danshen: an overview of its chemistry, pharmacology, pharmacokinetics and clinical use [J]. J Clin Pharmacol, 2005, 45: 1345-1359. |
| [4] | Lam BY, Lo AC, Sun X, et al. Neuroprotective effects of tanshinones on transient focal cerebral ischemia in mice [J]. Phytomedicine, 2003, 10: 286-291. |
| [5] | Dong K, Xu W, Yang J, et al. Neuroprotective effects of Tahshinone IIA on permanent focal cerebral ischemia in mice [J]. Phytother Res, 2009, 23: 608-613. |
| [6] | Huang J, Upadhyay UM, Tamargo RJ. Inflammation in stroke and focal cerebral ischemia [J]. Surg Neurol, 2006, 66: 232-245. |
| [7] | Schilling M, Besselmann M, Leonhard C, et al. Microglial activation precedes and predominates over macrophage infiltration intransient focal cerebral ischemia: a study in green fluorescent protein transgenicbone marrow chimeric mice [J]. Exp Neurol, 2003, 183: 25-33. |
| [8] | Chen WM, Sun CM, Wang HM, et al. Effects of tanshinone IIA pretreatment on neuroprotectant and GFAP expression in rats of focal cerebral ischemia-reperfusion injury [J]. Shandong Med J (山东医药), 2011, 51: 35-37. |
| [9] | Price CJ, Wang D, Menon DK, et al. Intrinsic activate dmicroglia map to the peri-infarct zone in the subacute phase of ischemic stroke [J]. Stroke, 2006, 37: 1749-1753. |
| [10] | Tai WJ, Ye X, Bao XQ, et al. Research progress of the relationship between microglia and cerebral ischemia [J]. Acta Pharm Sin (药学学报), 2012, 47: 346-353. |
| [11] | Chen Y, Wu X, Yu S, et al. Neuroprotection of tanshinone IIA against cerebral ischemia/reperfusion injury through inhibition of macrophage migration inhibitory factor in rats [J]. PLoS One, 2012, 7: e40165. |
| [12] | Nomura Y. NF-κB activation and IκBα dynamism involved in iNOS and chemokine induction in astroglial cells [J]. Life Sci, 2001, 68: 1695-1701. |
| [13] | Ridder DA, Schwaninger M. NF-κB signaling in cerebral ischemia [J]. Neuroscience, 2009, 158: 995-1006. |
| [14] | Wang JG, Bondy SC, Zhou L, et al. Protective effect of tanshinone IIA against infarct size and increased HMGB1, NFκB, GFAP and apoptosis consequent to transient middle cerebral artery occlusion [J]. Neurochem Res, 2014, 39: 295-304. |
| [15] | Yang D, Chen Q, Yang H, et al. High mobility group box-1 protein induces the migration and activation of human dendritic cells and acts as an alarmin [J]. J Leukocyte Biol, 2007, 81: 59-66. |
| [16] | Javeed A, Zhao Y, Zhao Y. Macrophage-migration inhibitory factor: role in inflammatory diseases and graft rejection [J]. Inflamm Res, 2008, 57: 45-50. |
| [17] | Inacio AR, Ruscher K, Leng L, et al. Macrophage migration inhibitory factor promotes cell death and aggravates neurologic deficits after experimental stroke [J]. Cereb Blood Flow Metab, 2011, 31: 1093-1106. |
| [18] | Dirnagl U, Iadecola C, Moskowitz MA. Pathobiology of ischemic stroke: an integrated view [J]. Trends Neurosci, 1999, 22: 391-397. |
| [19] | Crack PJ, Taylor JM. Reactive oxygen species and the modulation of stroke [J]. Free Radic Boil Med, 2005, 38: 1433-1444. |
| [20] | Niu XL, Ichimori K, Yang X, et al. Tanshinone IIA inhibits low density lipoprotein oxidation in vitro [J]. Free Radic Res, 2000, 33: 305-312. |
| [21] | Martin LJ, Al-Abdulla NA, Brambrink AM, et al. Neurodegeneration in excitotoxicity, global cerebral ischemia and target deprivation: a perspective on the contributionns of apoptosis and necrosis [J]. Brain Res Bull, 1998, 46: 281-309. |
| [22] | Cho BB, Toledo-Pereyra LH. Caspase-independent programmed cell death following ischemic stroke [J]. J Invest Surg, 2008, 21: 141-147. |
| [23] | Chen Y, Wu X, Yu S, et al. Neuroprotective capabilities of tanshinone IIA against cerebral is chemia/reperfusion injury via anti-apoptotic pathway in rats [J]. Biol Pharm Bull, 2012, 35: 164-170. |
| [24] | Qiao HM, Zhang XJ, Zhu CH, et al. Luteolin downregulates TLR4, TLR5, NF-κB and p-p38MAPK expression, upregulates the p-ERK expression, and protects rat brains against focal ischemia [J]. Brain Res, 2012, 1448: 71-81. |
| [25] | Li DY, Tao L, Liu H, et al. Role of ERK1/2 in the anti-apoptotic and cardioprotective effects of nitric oxide after myocardial ischemia and reperfusion [J]. Apoptosis, 2006, 11: 923-930. |
| [26] | Liu X, Ye M, An C, et al. The effect of cationic albumin-conjugated PEGylated tanshinone IIA nanoparticles on neuronal signal pathways and neuroprotection in cerebral ischemia [J]. Biomaterials, 2013, 34: 6893-6905. |
| [27] | Hei M, Liu F, Luo Y. Effect of tanshinone IIA on phosphorylated NMDA receptor 1 expression and intracellular free calcium concentration in neonatal SD rats with hypoxic ischemic brain damage [J]. J Cent South Univ Med Sci (中南大学学报 医学版), 2010, 35: 940-946. |
| [28] | Sasaki T, Takemori H, Yagita Y, et al. SIK2 is a key regulator for neuronal survival after ischemia via TORC1-CREB [J]. Neuron, 2011, 69: 106-119. |
| [29] | Liu L, Zhang X, Wang L, et al. The neuroprotective effects of tanshinone IIA are associated with induced nuclear translocation of TORC1 and upregulated expression of TORC1, pCREB and BDNF in the acute stage of ischemic stroke [J]. Brain Res Bull, 2010, 82: 228-233. |
| [30] | Jiang P, Chen M, Lü J, et al. Effect of tanshinone II A on MMP-2 and iNOS expression and free radical release in hippocampus of rat Alzheimer's disease model [J]. Acad J Second Mil Med Univ (第二军医大学学报), 2010, 31: 380-384. |
| [31] | Dong HM, Mao SP, Wei JJ, et al. Tanshinone IIA protects PC12 cells from β-amyloid25-35-induced apoptosis via PI3K/ Akt signaling pathway [J]. Mol Biol Rep, 2012, 39: 6495-6503. |
| [32] | Minnerup J, Sutherland BA, Buchan AM, et al. Neuroprotection for stroke: current status and future perspectives [J]. Int J Mol Sci, 2012, 13: 11753-11772. |
 2015, Vol. 50
2015, Vol. 50


