2. 西南大学-西藏大学农牧学院药用植物联合研发中心, 重庆 400715;
3. 西南大学药学院, 重庆 400715;
4. 西藏农牧学院食品科学学院, 西藏 林芝 860000
2. SWU-TAAHC Medicinal Plant Joint R&D Centre, Chongqing 400715, China;
3. College of Pharmaceutical Sciences, Southwest University, Chongqing 400715, China;
4. School of Food Sciences, Tibet Agricultural and Animal Husbandry College, Nyingchi 860000, China
紫杉醇 (taxol) 是20世纪70年代由Wani等[1]从短叶红豆杉 (Taxus brevifolia) 中提取出来的具有抗癌作用的天然药物,是治疗卵巢癌、乳腺癌的首选药物,对直肠癌、脑癌、白血病、肺癌和其他的一些实体瘤等均有显著疗效[1,2]。因此,紫杉醇及红豆杉在诸多领域均有广泛而深入的研究[3, 4, 5, 6]。目前,紫杉醇的提取原料主要是天然的红豆杉植物,但是红豆杉属植物生长缓慢,且树皮中紫杉醇的含量低 (0.01% 干重)[7]。因此,寻找及扩大紫杉醇药源成为亟待解决的难题。利用基因工程技术,对紫杉醇生物合成的代谢网络进行调控,是解决紫杉醇药源匮乏的根本途径。目前,紫杉醇生物合成途径所涉及到的基因的分子遗传学和酶的生物化学研究已经取得了较大的突破。
紫杉醇是一种二萜化合物,其生物合成由经典的MVA途径[8,9]和位于质体的5-磷酸脱氧木酮糖 (DXP) 途径[10]组成。MVA途径和DXP途径共同合成紫杉 醇的5碳前体: 异戊烯基焦磷酸 (IPP) 和它的异构物—二甲基烯丙基焦磷酸 (DMAPP)。紫杉醇的20碳二萜骨架是由4个单位的IPP连接而成,异戊烯基焦磷酸异构酶 (isopentenyl diphosphate isomerase,IPI) 催化IPP和DMAPP之间进行可逆的转化[11]。据文 献[12]报道,植物中的IPI基因都是以家族基因形式存在,例如在拟南芥中存在2个IPI基因[13]。与MVA途径上其他严格定位在细胞质中的基因或酶不一样,IPI存在于多种植物亚细胞结构中,例如拟南芥中IPI在线粒体、质体、细胞质和过氧化物体均存在[14, 15, 16]。
IPP和DMAPP不仅是各种萜类化合物的前体,也是β-胡萝卜素 (β-carotene) 的前体,IPI的超量表达会导致植物中β-胡萝卜素含量的上升。大肠杆菌 本来不生产β-胡萝卜素,但Cunningham的研究组[12]将来自于Erwinia herbicola的与β-胡萝卜素生物合 成相关的4个基因,包括香叶基香叶基焦磷酸合成酶 (geranylgeranyl diphosphate synthase,GGPPS)、八氢蕃茄红素合成酶 (phytoene synthase,PSY)、八氢蕃茄红素脱饱和酶 (phytoene desaturase gene,crtI) 和蕃茄红素环化酶 (lycopene cyclase,crtY) 共同构建到同一个大肠杆菌表达载体 (pAC-BETA) 上,使得可以在大肠杆菌中生产β-胡萝卜素,但是含量很低; 当再转入植物来源的IPI基因并在大肠杆菌中超量表达时,代谢流 (metabolic flux) 明显往合成类胡萝卜素 (carotenoid) 的方向流动,使得β-胡萝卜素大量积累,而出现鲜艳的橘黄色菌斑; 而没有转入IPI基因的菌斑还是大肠杆菌本生的颜色[17]。基于这个原理,通过替换IPI可以验证红豆杉中萜类生物合成途径上IPI功能。既然IPI在植物细胞质和质体中均存在,可以推断,IPI在紫杉醇生物合成的两条途径中,都起到重要作用。迄今为止,还没有裸子植物 (包括红豆杉) IPI和相关研究的报道。为了深入研究IPI在紫杉醇和其他相关次生代谢产物生物合成中的作用和提供紫杉醇代谢工程所需的靶点,本研究以曼地亚红豆杉 (Taxus media) 为研究对象,采用RACE技术首次克隆了IPI基因cDNA全长; 并运用生物信息学软件对IPI基因及其编码的蛋白质进行了详细的生物信息学分析; 同时采用Southern杂交技术分析IPI是否属于紫杉醇等萜类生物合成途径IPI家族成员,最后通过在大肠杆菌中超量表达IPI验证其是否参与紫杉醇等萜类化合物的合成以及β-胡萝卜素的合成。
材料与方法 材料、菌株和质粒曼地亚红豆杉树苗由西南师范大学生命科学学院谈锋教授提供。大肠杆菌菌株XL1-Blue由本实验室保存。pAC-BETA、pTrcAtIPI质粒由Francis X Cunningham博士赠送 (University of Maryland)。
RNA、DNA的提取和cDNA的合成曼地亚 红豆杉总RNA提取按廖志华教授方法操作[18],紫 外分光光度计测定其在260 nm和280 nm处的吸光 度,A260/A280均大于1.8小于2.1,表明RNA无 蛋白 和DNA污染,将质量合格的RNA用Clontech公司SMARTTM RACE cDNA Amplification Kit试剂盒进行第一链cDNA的合成用于基因克隆。取1.00 g幼苗真叶采用CTAB法抽提总DNA[19]。
基因克隆根据已报道的被子植物和细菌的IPI基因的保守序列设计简并引物 (DF-IPI,DR-IPI),利用温度梯度PCR (51 ℃~59 ℃) 获得核心片段; 根据已获得的核心片段设计RACE基因特异性引物 (IPI5-1、IPI5-2、IPI3-1、IPI3-2),利用SMARTTM RACE cDNA Amplification Kit合成的曼地亚红豆杉5' RACE- Ready cDNA和3' RACE-Ready cDNA为模板分别进行5' RACE和3' RACE获得5' 端和3' 端片段; 将测序获得的核心片段 (3' 和5' 片段) 在Vector NTI Suite 11.5上进行拼接,获得cDNA全长序列; 根据获得的cDNA全长设计全长特异性引物 (F-IPI、R-IPI) 验证全长。引物如表 1所示。
生物信息学分析通过Vector NTI suite 11.5软件进行ORF的查找和翻译,在NCBI网站的BLAST进行核酸和氨基酸序列比对; 用ClustalX软件进行氨基酸序列多重比对; 用MEGA4.1的Neighbor-joining方法进行进化树的构建 (repeat 1000); ExPASy (http:// cn.expasy.org/tools/protparam.html) 预测蛋白质的基本性质; NCBI (http://www.ncbi.nlm.nih.gov/Structure/ cdd/wrpsb.cgi) 预测蛋白质结构域; SOPMA的GOR4 (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page =npsa_gor4.html) 预测二级结构; WoLF PSORT网站(http://www.genscript.com) 预测亚细胞定位情况。
Southern杂交以IPI基因的编码区作为模板,PCR扩增Southern杂交的探针 (PF-IPI,PF-IPI) (表 1)。使用Amersham Pharmacia公司Gene ImagesTM Contents CDP-StarTM labelling module,RPN3540),按照试剂盒所附说明书进行探针标记。按NEB公司的操作手册分别用Bam HI、Bgl II和 Nco I单酶切曼地亚红豆杉总DNA。
|
|
Table 1 The primers used in this report |
根据获得的IPI基因的编码区序列 设计功能互补的引物 (F-Bgl II、R-Not I) (表 1),通过PCR反应获得带酶切位点的IPI基因片段,亚克隆到pGEMT-easy测序验证。将pTrcAtIPI质粒用Pst I切去0.85 kb的Arabidopsis IPI基因,用T4 DNA ligase 将剩余片段重新环化为环状质粒 (pTrc),作为对照; BglII和Not I双酶切携带IPI基因的pGEMT-easy质粒和pTrcAtIPI,回收IPI基因 (~700 bp) 和pTrcAtIPI载体骨架 (~3 700 bp); 16 ℃连接获得pTrc-TmIPI。pTrc-TmIPI转化XL1-Blue (Amp 150 μg·mL-1),pAC- BETA转化XL1-Blue (Cm 50 μg·mL-1),pTrc转化已经携带pAC-BETA的XL1-Blue (Amp 150 μg·mL-1 + Cm 50 μg·mL-1),在其相应的选择培养基上获得单克隆。挑取在XL1-Blue、XL1-Blue + pTrc-TmIPI、XL1- Blue+ pAC-BETA、XL1-Blue + pTrc + pAC-BETA、XL1-Blue + pTrc-TmIPI + pAC-BETA的单克隆在LB (Amp+ + Cm+) 平板划线,28 ℃,倒置暗培养2~3天,比较携带不同质粒的XL1-Blue生长情况[20]。
结果1 TmIPI全长cDNA的分子克隆
以曼地亚红豆杉的cDNA为模板,利用简并引物、3' 和5' cDNA引物以及全长引物,通过PCR扩增获得IPI基因的全长cDNA序列。IPI基因的全长cDNA序列为1 232 bp (GenBank登录号: KP970677),包括5'、3' UTR和polyA尾部序列; 其ORF编码了一个233个氨基酸残基的多肽。
2 TmIPI的生物信息学分析ExPASy网站预测显示: IPI基因编码长度为233个氨基酸残基的多肽,其分子质量为27 kDa,等电 点为4.95,这与其他物种报道过的IPI很相似[6]; 在NCBI上对IPI氨基酸序列进行保守结构域分析,发现IPI含有Nudix结构域,属于Nudix水解酶超家族,在前期的研究中发现该结构域具有磷酸水解酶的活性; 对IPI氨基酸序列进行二级结构预测,发现该蛋白主要存在下列3种结构: α螺旋 (39.06%)、无规则卷曲 (42.06%) 和延伸链 (18.88%); WoLF PSORT预测该蛋白的亚细胞定位,发现其可能存在于细胞质或者叶绿体中。NCBI的Blast结果显示TmIPI属于IPI家族,并且与其他植物物种中的IPI有很高的相似性: Clarkia xantiana IPI (76% identities,89% positives)、Nicotiana tabacum IPI (81% identities,91% positives)、Adonis palaestina IPI (80% identities,89% positives)、Clarkia breweri IPI (80% identities,90% positives) 等; 各植物IPI氨基酸多重比对结果显示 (图 1): 植物IPI的N-端同源性不高,N-端区域后序列高度同源,该区域为IPI的功能区段。
 |
Figure 1 Multiple alignment of amino acid sequences of IPI of plant origin. The identical and conserved amino acid residues were denoted with black and gray backgrounds respectively. The sequences used were listed bellow with GenBank accession number: A. thaliana,BAB09611; C. acuminata,AAB94133; C. breweri I,Q39472; H. brasiliensis,AAD41765; C. breweri II,Q39471; N. tabacum,BAB40974; O. sativa,AAF29978; P. sepium,BAC65421; Z. mays,AAQ14869; T. media, KP970677. |
利用MEGA4.1 Neighbor-joining方法进行进化树的构建 (图 2) 结果显示: 在真核生物中,IPI的系统进化表现出与物种系统进化的相关性,可以分为真菌、动物和植物类群; 其中,藻类IPI和高等植物IPI并没有按照想象的聚到一起 (虽然它们都是植物),而是各自占据相隔较远的独立分支; TmIPI很好的和高等植物的IPI聚到一起,说明TmIPI属于高等植物IPI组群,但TmIPI在高等植物IPI类群中位于裸子植物的独立分支,TmIPI与其他所有被子植物的IPI分支间的Bootstrap值达到100% (1 000次重复),这个结果有力的表明高等植物的IPI可以分为裸子植物和被子植物两大平行类群。
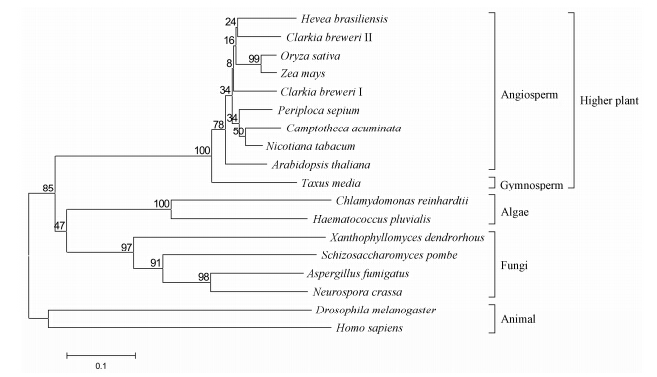 |
Figure 2 A phylogenetic tree of IPI from different organisms constructed by neighbor-joining method on MEGA 4.1. The sequences used were listed bellow with GenBank accession number: X. dendrorhous,BAA33979; S. pombe,AAA80596; A. fumigatus,CAD37150; N. crassa,EAA32733; C. reinhardtii,AAC32601; A. thaliana,BAB09611; C. acuminata,AAB94133; C. breweri I,Q39472; C. breweri II,Q39471; H. brasiliensis,AAD41765; N. tabacum,BAB40974; O. sativa,AAF29978; P. sepium,BAC65421; Z. mays,AAQ14869; D. melanogaster,AAM50284; H. sapiens,AAK29358; H. pluvialis,AAC32209; T. media, KP970677 |
Southern杂交实验结果显示了多个杂交条带(图 3),证明了曼地亚红豆杉基因组中有1个IPI基因家族,和其他植物中IPI基因的结果相似。
 |
Figure 3 Southern blot analysis of TmIPI. Genomic DNA was isolated from needles of Taxus media and digested with BamHI,BglII and NcoI separately followed by hybridization with the biotin-labeled TmIPI fragment |
功能验证的结果 (图 4): XL1-Blue + pAC-BETA +pTrc-TmIPI在氨苄霉素 (Amp) 和氯霉素 (Cm) 的双抗LB固体培养基上能够生长,并且出现鲜艳的橘黄色菌斑; 而XL1-Blue + pAC-BETA + pTrc在双抗培养基上虽然可以生长,但没有明显橘黄色; XL1-Blue、XL1-Blue + pAC-BETA、XL1-Blue + pTrc-TmIPI不能在双抗培养基上生长。该实验证明了IPI基因和pAC-BETA上携带的几个外源基因的共同作用下推动代谢流向下游流动,导致β-胡萝卜素的大量积累而呈现鲜艳的橘黄色。该研究表明IPI在萜类相关产物生物合成中是一个重要的调节因子,超量表达IPI基因,利于代谢流往更下游流动,促进下游相关产物的生物合成[10]。
 |
Figure 4 Overexpression of TmIPI harbored by pTrc in E. coli strain XL1-Blue,which cooperated with pAC-BETA and pushed the metabolic flux to go downstream to synthesize yellow β-carotene |
IPI是合成类异戊二烯类物质的关键酶,可以催化IPP和DMAPP间的可逆转化。有研究表明: 在大肠杆菌中超表达外源的IPI基因,能够增加类异戊二烯类物质的合成量[21]; 在拟南芥中,突变IPI基因后,植株表现为矮小和雄性不育,并且类异戊二烯类物质的含量较野生型下降50%[22]。上述在大肠杆菌和拟南芥的IPI基因功能的研究与本研究在大肠杆菌中对红豆杉的IPI基因的功能验证结果相似: 红豆杉的IPI基因在大肠杆菌中超量表达,在与合成β-类胡萝卜素的其他4个基因的共同作用下,使代谢流明显往合成类胡萝卜素的方向流动,大大促成了β-carotene的生物合成,这说明IPI在萜类相关产物生物合成中是一个重要的调节因子,它的超量表达,利于代谢流往更下游流动,促进下游相关产物的生物合成[17]。大肠杆菌中本来存在IPI基因,但是转pAC-BETA的XL1-Blue并没有大量积累类胡萝卜素,这说明IPI催化的IPP和DMAPP之间的转化反应对于萜类或异戊烯化合物的合成是一个重要的调节步骤,调节的积累机制可能需要IPP和DMAPP保持一定适合的比例才利于代谢流向下游流动。可以推测,IPP和DMAPP保持一定的比例可能会有利于包括紫杉醇在内的 二萜生 物合成。根据文献[13]报道,IPI基因在植物中以基因家族的形式存在,并且定位于多种亚细胞结构[14, 15, 16],参与IPP和DMAPP之间的转化。该结果与本研究的southern、亚细胞定位的预测结果相一致。对红豆杉IPI基因的克隆和鉴定将有助于在分子水平上更深入地了解IPI在紫杉醇生物合成中所扮演的角色; 由于IPI在大肠杆菌中的超量表达能够很好地推动代谢流向下游流动,因而IPI基因是紫杉醇生物合成途径 代谢工程一 个新的靶点基因。
| [1] | Wani MC, Taylor HL, Wall ME, et al. Plant antitumor agents. VI. Isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia [J]. J Am Chem Soc, 1971, 93: 2325-2327. |
| [2] | Kohler DR, Goldspiel BR. Paclitaxel (taxol) [J]. Pharmacotherapy, 1994, 14: 3-34. |
| [3] | Kong JQ, Wang W, Zhu P, et al. Recent advances in the biosynthesis of taxol [J]. Acta Pharm Sin (药学学报), 2007, 42: 358-365. |
| [4] | Wu D, Li YN, Wu LJ, et al. Isolation and identification of chemical constituents from Taxus cuspidata Sibe et Zucc [J]. Acta Pharm Sin (药学学报), 2010, 45: 1398-1401. |
| [5] | Chen XY, Liang JY. Studies on chemical constituents of planted Taxus mairei (III) [J]. Acta Pharm Sin (药学学报), 2008, 43: 1205-1207. |
| [6] | Zhan JX, Zhong JJ, Dai JG, et al. Microbial transformation of sinenxan A, a rich constituent in callus cultures of Taxus [J]. Acta Pharm Sin (药学学报), 2003, 38: 555-558. |
| [7] | Bai XY, Lu JM, Zhou YY, et al. Chemical constituents of Taxus chinensis var. mairei cell cultures [J]. Acta Pharm Sin (药学学报), 2015, 50: 70-74. |
| [8] | Lansing A, Haertel M, Gordon M, et al. Biosynthetic studies on taxol [J]. Planta Med, 1991, 57: 83. |
| [9] | Zamir LO, Nedea ME, Garneau FX. Biosynthetic building blocks of Taxus canadensis taxanes [J]. Tetrahedron Lett, 1992, 33: 5235-5236. |
| [10] | Eisenreich W, Menhard B, Hylands PJ, et al. Studies on the biosynthesis of taxol: the taxane carbon skeleton is not of mevalonoid origin [J]. Proc Natl Acad Sci USA, 1996, 93: 6431-6436. |
| [11] | Wouters J, Oudjama Y, Ghosh S, et al. Structure and mechanism of action of isopentenylpyrophosphate-dimethylallylpyrophosphate isomerase [J]. J Am Chem Soc, 2003, 125: 3198-3199. |
| [12] | Cunningham FX, Gantt E. Identification of multi-gene families encoding isopentenyl diphosphate isomerase in plants by heterologous complementation in Escherichia coli [J]. Plant Cell Physiol, 2000, 41: 119-123. |
| [13] | Campbell M, Hahn FM, Poulter CD, et al. Analysis of the isopentenyl diphosphate isomerase gene family from Arabidopsis thaliana [J]. Plant Mol Biol, 1997, 36: 323-328. |
| [14] | Phillips MA, D'Auria JC, Gershenzon J, et al. The Arabidopsis thaliana type I isopentenyl diphosphate isomerases are targeted to multiple subcellular compartments and have overlapping functions in isoprenoid biosynthesis [J]. Plant Cell, 2008, 20: 677-696. |
| [15] | Sapir-Mir M, Mett A, Belausov E, et al. Peroxisomal localization of Arabidopsis isopentenyl diphosphate isomerases suggests that part of the plant isoprenoid mevalonic acid pathway is compartmentalized to peroxisomes [J]. Plant Physiol, 2008, 148: 1219-1228. |
| [16] | Ramos-Valdivia AC, vanderHeijden R, Verpoorte R. Isopentenyl diphosphate isomerase: a core enzyme in isoprenoid biosynthesis. A review of its biochemistry and function [J]. Nat Prod Rep, 1997, 14: 591-603. |
| [17] | Gallagher CE, Cervantes-Cervantes M, Wurtzel ET. Surrogate biochemistry: use of Escherichia coli to identify plant cDNAs that impact metabolic engineering of carotenoid accumulation [J]. Appl Microbiol Biotechnol, 2003, 60: 713-719. |
| [18] | Liao ZH, Chen M, Guo L, et al. Rapid isolation of high- quality total RNA from Taxus and Ginkgo [J]. Prep Biochem Biotechnol, 2004, 34: 209-214. |
| [19] | Ausubel FM, Brent R, Kingston RE, et al. Short protocols in molecular biology [M]. 3rd Ed. New York: John Willey and Sons Inc., 1995. |
| [20] | Zou X, Liao ZH. Effect of temperature on lycopene production by recombinant E. coli and strategy [J]. Microbiol China (微生物学通报), 2005, 32: 19-23. |
| [21] | Kajiwara S, Fraser PD, Kondo K, et al. Expression of an exogenous isopentenyl diphosphate isomerase gene enhances isoprenoid biosynthesis in Escherichia coli [J]. Biochem J, 1997, 324: 421-426. |
| [22] | Okada K, Kasahara H, Yamaguchi S, et al. Genetic evidence for the role of isopentenyl diphosphate isomerases in the mevalonate pathway and plant development in Arabidopsis [J]. Plant Cell Physiol, 2008, 49: 604-616. |
 2015, Vol. 50
2015, Vol. 50


