2. 南京中医药大学 江苏省海洋药用生物资源研究与开发重点实验室, 江苏 南京 210023;
3. 南京中医药大学 江苏省方剂高技术研究重点实验室, 江苏 南京 210023
2. Jiangsu Key Laboratory of Research and Development in Marine Bio-resource Pharmaceutics, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. Jiangsu Key Laboratory for High Technology Research of TCM Formulae, Nanjing University of Chinese Medicine, Nanjing 210023, China
水牛角 (Bubali Cornu) 为牛科动物水牛 (Bubalus bubalis Linnaeus) 的角。始载于《名医别录》: “疗时气寒热头痛”。性味苦咸、寒,具清热、解毒、凉血、定惊之功效。现代研究表明水牛角具有良好的解热、镇静等功效。水牛角在中医临床用于治疗或辅助治疗热病头痛、高热神昏、发斑发疹、出血、小儿惊风及咽喉肿痛等症[1]。水牛角传统用法即单用或组方后以水煎煮得提取液使用,因此,水溶性物质可能是水牛角的主要功效物质基础。现代研究表明,水牛角中主要的水溶性物质包括蛋白质类、多肽类、氨基酸类、核苷类、氨基己糖等[2, 3, 4, 5],然而,目前研究主要集中于水牛角的无机元素、水解氨基酸、甾醇类等小分子类物质的分析,对其中水溶性大分子化学组成的分析鉴定仍缺乏较系统的研究方法与对策。
串联质谱技术广泛用于化学成分的定性定量分析,如基于LC-MS/MS的shotgun技术即是近年来发展起来的用于混合蛋白质、多肽的快速鉴定的方法手段,通过将质谱MS/MS图谱与数据库进行搜索比对,确定蛋白质或多肽的氨基酸序列或来源[6, 7, 8]。有研究报道表明,赛加羚羊角中主要蛋白质组成为I型角蛋白 (keratin,type I)、II型角蛋白 (keratin,type II)、I型胶原 (collagen I) 等[9]。水牛角小分子化学组成,如无机元素、甾醇等与羚羊角相似,而其中蛋白质类、肽类成分化学组成未有系统研究。因此,本文基于超滤与LC-MS/MS技术结合,对水牛角中水溶性蛋白质类、肽类物质的化学组成进行分析鉴定研究,亦对水牛角中核苷类成分进行了分析定性,为水牛角功效物质基础研究提供了参考与依据。
材料与方法试剂
主要有十二烷基硫酸钠 (SDS)、二硫苏糖醇 (DTT)、碳酸氢铵、胰蛋白酶 (Promega质谱测序级)。
仪器戴安U3000 NanoRSLC纳升液相系统 (美国DIONEX公司); Thermo LTQ Orbitrap XL质谱仪 (美国Thermo Fisher公司); Millipore Mini Pellicon超滤系统 (美国Merck Millipore公司); BP 211D电子天平 (德国Sartorius公司); Rotavapor R-210旋转蒸发仪 (瑞士,BUCHI公司); Freezone 4.5 plus冷冻干燥机 (美国,Labconco公司)。
水牛角药材水牛角药材收集于江苏省淮安市码头镇屠宰场,经南京中医药大学段金廒教授鉴定,均符合《中国药典》 (2010年版) 项下标准。
水牛角水提液制备将水牛角去角塞,洗净,粉碎后,参照《中国药典》(2010年版) 水牛角浓缩粉制备工艺,水牛角粉加10倍量水煎煮两次,第一次煎煮10 h,第二次煎煮8 h,合并滤液,10 000 r·min-1离心取上清液,得水牛角水提液,冷冻干燥后,置-20 ℃保存。
超滤分离以超滤系统对水牛角水提液进行分段处理,选择超滤膜的截留相对分子质量为1 000与3 000,经超滤分离后,获得3个部位: 相对分子质量 < 1 000部位 (I),相对分子质量1 000~3 000部位 (II) 及相对分子质量 > 3 000部位(III),各部位冷冻干燥后,置 -20 ℃保存。
水牛角水提液的酶解称取水牛角水提液冻干粉5 mg,用50 mmol·L-1碳酸氢氨溶液复溶,加入1% 的胰蛋白酶,37 ℃反应过夜。90 ℃孵育5 min灭活后,10 000 r·min-1离心,上清液保存留用。
纳升液相串联质谱分析蛋白质、肽类成分戴安U3000 NanoRSLC纳升液相系统,色谱柱为5 μm Reprosil C18AQ (75 μm × 150 mm),LC-MS/MS系 统分析水牛角不同样品。上样量为5 μL,流速400 nL·min-1,流动相A (乙腈-甲酸-水,2∶0.2∶98),流动相B (乙腈-甲酸-水,80∶0.2∶20),2%~30% B 线性梯度洗脱60 min。Thermo LTQ Orbitrap XL质 谱仪用于进行肽段分析,喷雾电压为2.5 kV,离子传输毛细管温度为200 ℃; 质谱一 级全扫描范围为m/z 100~2 000,分离宽度为3 Da; 串联质谱分析采用一级质谱数据依赖的二级质谱扫描模式,依次选取一级质谱中离子强度最高的5个离子进行碰撞诱导解离 (CID) 得到相应的二级串联质谱。采用Xcalibur软件进行数据分析。
数据库比对串联质谱数据用Proteome Discoverer 1.3软件,SEQUEST搜库,选择牛科 (Bovidae,Uniport下载,2014-4-10) 数据库,检索参数设置为: 前体离子误差10 ppm; 子离子误差1 Da; 半胱氨酸残基固定修饰 (氨甲酰甲基化57.021 5 Da); 甲硫氨酸残基可变修饰 (氧化+15.994 9 Da); 允许2个位点误切,假阳性率 (FDR) ≤1%; 根据水牛角水提液样品不同,选择不同酶切方式: 非酶切 (no enzyme) 或胰蛋白酶酶切 (trypsin); 其他参数为默认参数,在上述检索条件下所得分值有显著性意义 (P < 0.05) 被认定为有效的鉴定结果。
串联质谱分析核苷类成分UPLC-Q-TOF/MS分析水牛角水提液I部位中核苷类成分组成。色谱条件: Waters AcquityTM UPLC BEH C18色谱柱 (2.1 mm × 100 mm,1.7 μm); 柱温30 ℃; 流速0.4 mL·min-1; 进样量5 μL; 流动相: 甲醇 (A)-水 (B),梯度洗脱: 0~3 min,5% A; 3~15 min,5%~30% A; 15~17 min,30% A。质谱条件: ESI源,扫描方式: ESI正离子模 式,毛细管电压: 3 kV,锥孔电压: 30 V,离子源温度: 120 ℃,脱溶剂气温度: 350 ℃,锥孔气流量: 50 L·h-1,脱溶剂气流量: 600 L·h-1,碰撞能量 (6~40 V),离子能量: 1 V。
结果 1水牛角水提液中蛋白质鉴定基于shotgun蛋白质鉴定技术,从水牛角水提液中共鉴定了22个蛋白质,其中多数为角蛋白 (keratin,9个)、胶原蛋白 (collagen,4个)、桥粒蛋白 (desmoglein,2个)、热休克蛋白 (heat shock protein,1个)、其他蛋白6个。其中唯一肽段数≥2的蛋白质主要为胶原蛋白与角蛋白,胶原蛋白 (collagen alpha-1(I) chain) 的唯一肽段数目为6,覆盖率为4.78%; 角蛋白 (KRT86 protein) 的唯一肽段数目为4,覆盖率为11.93%。另一部分蛋白质的唯一肽段数为1,主要为角蛋白或角蛋白片段、桥粒蛋白、角质桥粒蛋白、热休克蛋白等。
2水牛角水提液中肽类成分分析与鉴定水牛角经煎煮后,一部分胶原蛋白与角蛋白溶出,此外,还含有一部分水溶性肽类,或经非特异性降解得到的肽段,为了鉴定水提液中肽类成分,采用超滤将水牛角水提液分段后质谱分析。I、II及III部位经质谱分析得MS/MS质谱碎片信息,采用非酶切模式进行数据库比对分析,从部位I中分析鉴定了3个多肽的氨基酸序列信息,从部位II中分析鉴定了5个多肽,从部位III中分析鉴定了6个多肽,这些肽类物质主要来源于角蛋白。以部位III中肽段GKVVSTHEQ IVRTKN为例,其 [M+H]+ 为1 695.97 Da,MS/MS图谱见图 1,其中主要的碎片离子峰包括: b7+ (709.399 2)、b8+ (838.441 8)、b10+ (1 079.584 4)、b11+ (1 178.652 8)、b122+ (667.880 6)、b132+ (718.404 5)、b142+ (782.452 0)、y4+ (518.304 5)、y5+ (617.373 0)、y8+ (987.558 2)、y9+ (1 124.617 1)、y10+ (1225.664 8)、y11+ (1 312.696 8)、y122+ (706.386 3)、y132+ (755.920 5)、y142+ (819.968 0)。经鉴定,GKVVSTHEQIVRTKN源于I型细胞 支架角蛋白Keratin,type I cytoskeletal 14 OS = Bos taurus的C末端的N402-N407肽段,见表 1,从水牛角水溶性提取物中鉴定的肽段TTTSSSSRKGYKH、SSTVRFV STTTSHRTKH、FVSTTTSHRTKH、GKIISSREHVQ PL亦分别来自不同蛋白质的C末端氨基酸残基。此外,肽段SSRDVSSSR、VKRDEKEQIK、LVAWYVE AIFPGEYGIP、KEIDAGLLSI、RSPS PSKN及LGTR VEARAR为非末端氨基酸序列。
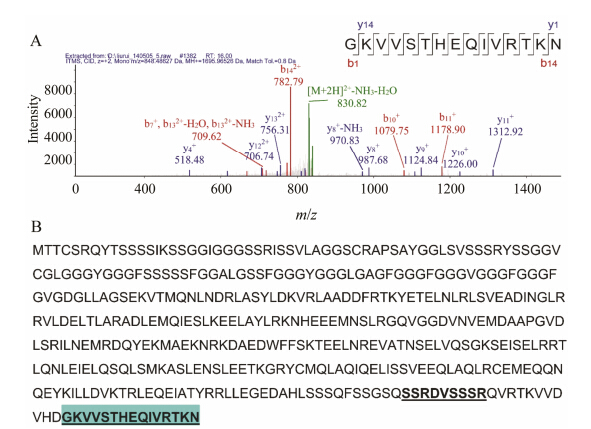 |
Figure 1 Identification of peptides GKVVSTHEQIVRTKN. A: MS/MS spectrum of GKVVSTHEQIVRTKN; B: Location of peptide GKVVSTHEQIVRTKN in keratin,type I cytoskeletal 14 |
|
|
Table 1 Identification results of peptides in water buffalo horn (WBH) aqueous extraction. I: Molecular weight < 1 kDa; II: 1 kDa < Molecular weight < 3 kDa; III: Molecular weight > 3 kDa; Non C-terminal peptides; 1: L1-Acetyl (42.010 6 Da); 2: A1-Acetyl (42.010 6 Da),C9-Carbamidomethyl (57.021 5 Da); KRT: Keratin |
水牛角中水溶性物质除了蛋白质类、多肽类之外,还有少量核苷类成分,从UPLC-Q-TOF/MS的谱图中分别检测到核苷的 [M+Na]+、[M+K]+、[M+Na-ribose]+ 等离子。以腺苷为例,其相对分子质量为267,质谱图 (图 2) 中有准分子离子 [M+H]+ (m/z 268) 和 [M+Na]+ 离子(m/z 290),还有丢失糖基后的 [M+H-ribose]+ 离子 (m/z 136),保留时间及紫外吸收均与对照品一致。根据这些碎片离子信息、保留时间及紫外吸收,可确定为腺苷。共鉴定了4个核苷类物质: 尿苷、次黄嘌呤、鸟苷和腺苷,结果见表 2。
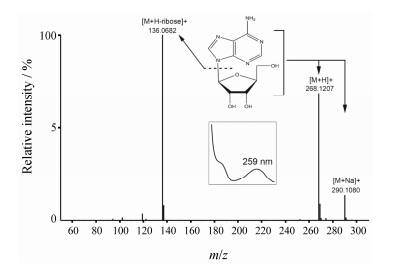 |
Figure 2 MS/MS spectrum of adenosine |
|
|
Table 2 Analysis of nucleosids in WBH aqueous extract |
水牛角中水溶性物质主要包括蛋白质类、肽类、核苷类等。蛋白质鉴定结果表明,水牛角水提液中含有的大分子蛋白质类成分主要为胶原蛋白和角蛋白,这两种蛋白质在动物表皮、蹄甲、角质等组织中含量丰富。水牛角在经过高温煎煮提取后,蛋白分子间或分子内的二硫键断裂、水解,会有少量胶原蛋白或角蛋白溶出,但通常这部分蛋白质分子量不会太大,亦可能是多肽混合物[10],而这些混合多肽通常为非特异性降解的产物,因此,为了进一步研究此类肽类成分,将水牛角水提液按不同分子量段进行分离,采用非酶切搜库鉴定模式分析不同分子量段的肽类物质组成。核苷类物质为生命体必需的成分,具有调节生理机能等多种生物活性,除了蛋白质类与肽类物质外,本文通过与对照品比对,鉴定了水牛角水提液中次黄嘌呤、尿苷、鸟苷及腺苷4种核苷类物质。
水牛角水溶性蛋白质主要属于结构蛋白,如角蛋白是外胚层细胞的结构蛋白,是动物体毛发、蹄甲、角、鳞片等重要组成成分,具有保护机体的作用[10]; 胶原蛋白是细胞外基质的结构蛋白,动物结缔组织中的主要成分; 桥粒蛋白是细胞骨架的组成部分,参与细胞的角质形成。
水牛角水溶性肽类物质也主要来源于这些结构蛋白,如本文鉴定得到的肽段为蛋白质非特异性降解的产物,这些肽段的形成可能由于: 高温煎煮使得蛋白质变性、溶出,而后这些蛋白质再水解释放出肽段。肽段VVSTHEQIVRTKN、GKVVSTHEQIVRTKN与DGKVVSTHEQIVRTKN,均源于角蛋白,type I cytoskeletal 14的C末端,只是N端断裂位点不同,TTTSSSSRKGYKH、SSTVRFVSTTTSHRTKH、FVST TTSHRTKH与GKIISSREHVQPL则源于其他角蛋白的C末端; 非C末端肽段有SSRDVSSSR、VKRDEK EQIK、LVAWYVEAIFPGEYGIP、KEIDAGLLSI、RSP SPSKN及LGTRVEARAR,非C末端肽段的形成相较于C末端肽段可能更复杂: 如SSRDVSSSR,源于角蛋白、type I cytoskeletal 14,经煎煮后角蛋白、type I cytoskeletal 14首先溶出,持续高温进一步促使蛋白质的非特异性降解从而释放出N3 8 3-N391的肽段SSRDVSSSR。
角类动物药的临床使用不可或缺,近年来的研究表明,水牛角中水溶性成分可能为其主要功效物质基础,具有解热、镇静等作用。然而,目前对水牛角水溶性物质的组成与分析缺乏系统研究,尤其是对蛋白质类、肽类物质的研究较少。本课题组前期研究通过二维电泳 (2-DE)、复合色谱、串联质谱等技术从水牛角中鉴定了2个蛋白质、3个肽类物质[2, 3]。采用传统的蛋白质类、多肽类成分的分离、纯化与鉴定研究角类动物药耗时耗力,且存在样品含量低、纯化、鉴定难等问题。对于角类动物药的研究,如何建立快速、准确、灵敏的分析与鉴定的方法至关重要,尤其是针对犀角、羚羊角等名贵珍稀药材的物质基础研究、替代资源寻找评价等研究方法的建立。本文的研究为水牛角水溶性物质化学组成分析与鉴定提供研究思路,为进一步系统揭示水牛角功效物质基础奠定实验基础,也为珍稀角类动物药资源研究提供借鉴。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人们共和国药典) Part I. [S]. Beijing: China Medical Science Press, 2010: 77. |
| [2] | Liu R, Wang M, Duan JA, et al. Purification and identification of three novel antioxidant peptides from Cornu Bubali (water buffalo horn) [J]. Peptides, 2010, 31: 786-793. |
| [3] | Liu R, Duan JA, Wang M, et al. Analysis of potential active components of rhinoceros, water buffalo and yak horn using two-dimensional electrophoresis and ethnopharmacological evaluation [J]. J Sep Sci, 2011, 34: 354-362. |
| [4] | Wang F, Duan JA, Qian DW, et al. Searching for substitutes for Cornu Rhinoceri Asiatici and Cornu Saigae Tataricae and evaluation (I) [J]. J Nanjing Tradit Chin Med Univ (南京中医药大学学报), 2005, 21: 163-165. |
| [5] | Wang F, Duan JA, Qian DW, et al. Searching for substitutes for Cornu Rhinoceri Asiatici and Cornu Saigae Tataricae and evaluation (II) [J]. J Nanjing Tradit Chin Med Univ (南京中医药大学学报), 2007, 23: 36-39. |
| [6] | Lee YJ, Rice RH, Lee YM. Proteome analysis of human hair shaft: from protein identification to posttranslational modification [J]. Mol Cell Proteomics, 2006, 5: 789-800. |
| [7] | Rice RH, Xia Y, Alvarado RJ, et al. Proteomic analysis of human nail plate [J]. J Proteome Res, 2010, 9: 6752-6758. |
| [8] | Wang J, Pérez-Santiago J, Katz JE, et al. Peptide identification from mixture tandem mass spectra [J]. Mol Cell Proteomics, 2010, 9: 1476-1485. |
| [9] | Mikulíková K, Romanov O, Miksik I, et al. Study of saiga horn using high-performance liquid chromatography with mass spectrometry [J]. Sci World J, 2012, 2012: 759604. |
| [10] | Jia RY, He YF, Wang RM, et al. Advanced in structure, extract and application of keratins [J]. Chemistry (化学通报), 2008, 4: 265-271. |
 2015, Vol. 50
2015, Vol. 50


