2. 河北北方学院应用化学研究所, 河北 张家口 075000)
2. Institute of Applied Chemistry of Hebei North University, Zhangjiakou 075000, China
川桑 (Morus notabilis) 是桑科 (Moraceae) 桑属 (Morus) 植物,又名圆叶桑,是一种高大的乔木,主要分布在云南省和四川省的西部。检索发现,曾有文献[1, 2]报道从川桑中分离得到了7个黄酮类新化合物和10个已知化合物,其中有的成分具有显著的促进脂肪细胞分 化,增加AP2和GLUT4基因在3T3L1细胞中的表达,并表现出对蘑菇酪氨酸酶的抑制作用。
除此之外没有发现有关川桑化学成分和药理作用的报道。本研究利用硅胶 (100~200目、200~300目) 柱色谱、D101大孔吸附树脂柱色谱、反相C18柱色谱、葡聚糖凝胶Sephadex LH-20柱色谱、硅胶GF254薄层色谱、制备型HPLC等多种分离手段,从川桑树枝的95% 乙醇提取物中发现了1个新的黄酮类化合物,命名为notabilisins K,和4个已知黄酮类化合物,分别为morusin (2)、mulberrofuran A (3)、neocyclomorusin (4) 和mornigrol F (5)。本文报道notabilisin H的结构解析,以及化合物1~5、notabilisin I和notabilisin J共7个化合物对5种人肿瘤细胞 (BGC823,A2780,HCT-116,HepG2,NCI-H1650) 的细胞毒活性。
化合物1,黄色无定形粉末。HR-ESI-MS m/z 419.147 6 [M+H]+ (Calcd. 419.141 6)、441.131 4 [M+ Na]+、837.321 4 [2M+H]+,分子式确定为C25H22O6。红外光谱 (IR) 显示有羟基 (3 385.4 cm-1)、羰基 (1 655.5 cm-1) 和苯环 (1 613.4、1 508.1和1 456.3 cm-1)。紫外光谱 (UV) (溶剂为甲醇) 显示: 在206.2 nm (logε,4.08)、270.0 nm (logε,3.89)、303.4 nm (logε,3.87) 和315.8 nm (logε,3.89) 有较大吸收。1H NMR (acetone- d6,600 MHz) 显示以下质子信号 (溶剂峰作为参考): 一组ABX自旋体系的芳香质子,化学位移分别为δ 6.60 (1H,d,J = 2.4 Hz,H-3')、6.48 (1H,dd,J = 1.8,8.4 Hz,H-5') 和7.21 (1H,d,J = 8.4 Hz,H-6'),解析为一个1,2,4-三取代苯环 (B环); 在δ 6.87 (1H,s,H-6) 有一个芳香质子 (A环); 在δ 5.71 (2H,s,17-H) 有2个烯烃质子,在δ6.97 (1H,s,H-14) 有1个烯烃质子; 在δ5.15 (1H,br t,J = 7.2 Hz,H-10)、3.19 (2H,d,J= 7.2 Hz,H-9) 和1.46、1.58 (各3H,s,11-CH3×2) 显示一组异戊烯基信号; 1H NMR还显示在δ 13.22 (1H,s,5-OH) 有1个氢键合的羟基,在8.85~8.87 (2H,br m,2'-OH,4'-OH) 有2个羟基质子。13C NMR (ac etone-d6,150 MHz) 谱显示有25个碳原子,其中包括3个甲基、1个sp3杂化的亚甲基、21个sp2杂化的碳 (1个亚甲基、6个次甲基、14个季碳)。以上NMR数据(表 1) 与已知化合物artoindonesianin G[3]相似,不同之处是没有C-14亚甲基、C-15氧化次甲基、以及连接在C-6的异戊烯基,而存在D14双键基团和H-6。通过HMBC数据 (图 1) 分析存在1个2-(1-甲基,乙烯基)-呋喃环,HMBC显示H -14与C-7、C-8、C-8a和C-16相关,H-17与C-15和C-16相关,H3-18与C-15和C-16相关,因此推测2-(1-甲基,乙烯基)-呋喃环结合在C-7和C-8。其他碳氢的连接位置也都通过HMBC和HMQC得到了证实。综上所述,确定化合物1结构式如图 1所示,命名为notabilisin K。
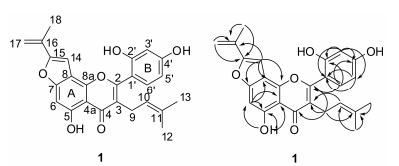
|
Figure 1 The structure and key HMBC correlations of compound 1 |
|
|
Table 1 1H (600 MHz) and 13C NMR (150 MHz) spectral data of compound 1 (in acetone-d6,J in Hz) |
采用MTT法测定了化合物1~5、notabilisin I和notabilisin J对5种人肿瘤细胞 (HCT-116、HepG2、BGC-823、NCI-H1650和A2780) 的抑制作用。结果表明,notabilisin I和notabilisin J对HCT-116、HepG2、A2780细胞有一定的杀伤作用,IC50为1.47~5.46 μmol·L-1; Morusin对这5种人肿瘤细胞都有较强的杀伤作用,IC50为0.74~1.58 μmol·L-1; 其他化合物对这5种人肿瘤细胞无效。实验结果见表 2。
|
|
Table 2 Cytotoxicities of obtained compounds against human cancer cell lines |
紫外光谱 (JASCO V-650型分光光度仪测定); 红外光谱 (Nicolet 5700型红外光谱仪测定); 核磁共振谱 (Mercury-400、Bruker AVIII HD 600核磁共振仪测定); 质谱 (Agilent 6520 Accurate Q-TOF LC/MS液质联用仪测定HR-ESI-MS; 1100 LC/MSD Trap-SL液质联用仪测定ESI-MS); 制备型HPLC [Lumtech高效液相色谱仪; Altech 500ELSD和UV K-2501型检测器; YMC-PACK ODS-A色谱柱 (20 mm × 250 mm,5 μm)]; Sephadex LH-20 (GE Pharmacia公司产品); RP-C18 (40~60 μm) (Merck公司产品); 柱色谱和薄层色谱硅胶GF254 (青岛海洋化工厂产品)。所用溶剂均为分析纯,北京化工厂生产。
川桑树枝于2014年3月采集于中国云南省金平县,由中国医学科学院药物研究所马林副研究员鉴定为Morus notabilis,标本 (编号: ID-S-2549) 收藏于中国医学科学院药物研究所标本室。
1 提取分离川桑树枝20 kg,粉碎,用95% 乙醇浸泡,回流提取3次,提取液合并,减压浓缩得浸膏。将浸膏溶解后以硅胶 (100~200目) 拌样并干燥,分别用石油醚 (PE,60~90 ℃)、二氯甲烷、乙酸乙酯和丙酮依次洗脱。二氯甲烷部分浓缩得浸膏200 g,浸膏以D101大孔吸附树脂拌样并干燥,用乙醇-水梯度洗脱 (30%、80% 和90% 乙醇),80%乙醇部分得浸膏29 g,然后依次用硅胶 (200~300目) 柱色谱 (丙酮-石油醚梯度洗脱)、反相C18柱色谱 (甲醇-水梯度洗脱)、葡聚糖凝胶Sephadex LH-20柱色谱 (乙醇洗脱)、制备型RP-HPLC (甲醇-水或乙腈-水洗脱) 等分离纯制,得到化合物1~5。
2 细胞毒活性测定用MTT法测定化合物1~5、notabilisin I和notabilisin J共7个化合物对5种人肿瘤细胞 (BGC823、A2780、HCT-116、HepG2和NCI-H1650) 的细胞毒活性。首先将肿瘤细胞接种于96孔培养皿中培养24 h。将待测化合物用DMSO溶解,分别配 成浓度为0.1、1.0和 10.0 μmol·L-1的溶液,加入到培养皿的3个孔中,然后在37 ℃恒温箱中孵育4天。MTT用DMSO配成浓度为64.0 mmol·L-1 的溶液,各孔中均加入10 μL,再孵育4 h。将所得的结晶甲 瓒溶解于DMSO (100 μL),用UV/VIS分光光度计于570 nm测定吸光度。根据吸光度与存活细胞之间的线性关系,参照文献[4]中的方法计算IC50值。
3 结构鉴定化合物1,黄色无定形粉末。HR-ESI-MS m/z 419.147 6 [M+H]+ (Calcd. 419.141 6)。红外光谱 (IR): 3 385.4、1 655.5、1 613.4、1 508.1和1 456.3 cm-1)。紫外光谱 (UV) (溶剂为甲醇): 206.2 nm (logε,4.08)、270.0 nm (logε,3. 89)、303.4 nm (logε,3.87) 和315.8 nm (logε,3.89)。NMR数据见表 1。
化合物2,黄色无定形粉末。HR-ESI-MS m/z 421.310 2 [M+H]+,分子式C25H24O6。1H NMR (acetone- d6,400 MHz) (溶剂峰作为参考): 1.44 (9H,s,C16-CH3× 2和C11-CH3)、1.57 (3H,s,C11-CH3)、3.13 (2H,d,J = 6.8 Hz,C9-H×2 )、5.12 (1H,br m,C10-H)、5.65 (1H,d,J = 10 Hz,C15-H)、6.15 (1H,s,C6-H)、6.53 (1H,dd,J = 2.4,8.0 Hz,C5'-H)、6.58 (1H,d,J = 2.4 Hz,C3'-H)、6.60 (1H,d,J = 10 Hz,C14-H)、7.25 (1H,d,J = 8.0 Hz,C6'-H)、8.83 (2H,br s,OH×2)、13.24 (1H,s,5-OH)。以上数据与文献 [5, 6, 7]报道的morusin一致,故鉴定化合物2为morusin。
化合物3,淡黄色无定形粉末。HR-ESI-MS m/z 393.206 9,分子式C25H28O4。1H NMR (CDCl3,400 MHz) (溶剂峰作为参考): 1.58、1.64 (各3H,s,C8"- CH3)、1.70 (3H,s,C3"-CH3)、2.00~2.06 (4H,br m,C5"-H×2和C6"-H×2)、3.48 (2H,br d,J = 6.4 Hz,C1"- H×2)& lt; /span>、3.83 (3H,s,OCH3)、5.08 (1H,m,C2"-H)、5.15 (1H,m,C7"-H)、6.47 (1H,d,J = 2.4 Hz,C4'-H)、6.76 (1H,br s,C3-H)、6.78 (1H,dd,J = 2.1,8.4 Hz,C5-H)、6.81 (1H,d,J = 2.4 Hz,C6'-H)、6.98 (1H,br d,J = 2.1 Hz,C7-H)、7.40 (1H,d,J = 8.4 Hz,C4-H)。以上数据与文献[8]报道的mulberrofuran A一致,故鉴定化合物3为mulberrofuran A。
化合物4,黄色无定形粉末。HR-ESI-MS m/z 437.158 4 [M+H]+,分子式C25H24O7。1H NMR (acetone- d6,600 MHz) (溶剂峰作为参考): 1.36 (3H,s,H-12)、1.39 (3H,s,H-13)、1.49 (6H,s,H-17和H-18)、2.63 (1H,dd,J = 3.6,18 Hz,H-9a) 和3.54 (1H,dd,J = 2.4,17 Hz,H-9b)、3.86 (1H,s,11-OH)、5.78 (1H,d,J = 8.4 Hz,H-15)、6.19 (1H,s,H-6)、6.70 (1H,d,J = 2.4 Hz,H-3')、6.81 (1H-5',dd,J = 1.8,8.4 Hz,H-5')、6.90 (1H- 14,d,J = 9.6 Hz,H-14)、8.04 (1H,d,J = 8.4 Hz,H-6')、9.23 (1H,s,4'-OH)、13.1 9 (1H,s,5-OH)。13C NMR (acetone-d6,150 MHz): 158.1 (C-2)、116.7 (C-3)、181.0 (C-4)、103.7 (C-4a)、161.7 (C-5)、99.1 (C-6)、159.3 (C-7)、100.9 (C-8)、151.7 (C-8a)、24.3 (C-9)、90.3 (C-10)、71.5 (C-11)、24.3 (C-12)、26.4 (C-13)、114.6 (C-1 4)、127 .5 (C-15)、78.0 (C-16)、27.4 (C-17)、27.4 (C-18)、113.9 (C-1')、160.4 (C-2')、107.9 (C-3')、161.8 (C-4')、111.2 (C-5')、130.1 (C-6')< span style='font-family:宋体;color:black'>。以上数据与文献[9]报道的neocyclomorusin一致,故鉴定化合物4为neocyclomorusin。
化合物5,黄色无定形粉末。HR-ESI-MS m/z 439.175 1 [M+H]+,分子式C25H26O7。1H NMR (acetone- d6,400 MHz) (溶剂峰作为参考): 1.45、1.58、1.69 (各 3H,br s,C11-CH3和C16-CH3×2)、2.90 (1H,dd,J = 8.4,14.4 Hz,H-9a)、3.05 (1H,dd,J = 8.4,14.4 Hz,H-9b)、3.14 (2H,d,J = 6.9 Hz,H-14)、4.37 (1H,dd,J = 3.6,8.4 Hz,H-10)、4.70 (1H,s,H-12a)、4.88 (1H,s,H- 12b)、5.15 (1H,m,H-15)、6.25 (1H,s,H-6)、6.51 (1H,dd,J = 2.7,8.4 Hz,H-5')、6.57 (1H,d,J = 2.7 Hz,H- 3')、7.25 (1H,d,J = 8.4 Hz,H-6')、13.12 (1H,s,5-OH)。13C NMR (acetone-d6,100 MHz): 162.1 (C-2)、121.0 (C-3)、183.5 (C-4)、105.2 (C-4a)、161.4 (C-5)、99.5 (C-6)、163.3 (C-7)、104.6 (C-8)、156.9 (C-8a)、30.4 (C-9)、76.2 (C-10)、148.4 (C-11)、110.3 (C-12)、18.3 (C-13)、24.6 (C-14)、122.8 (C-15)、132.1 (C-16)、25.8 (C-17)、17.6 (C-18)、113.0 (C-1')、157.3 (C-2')、104.1 (C-3')、161.5 (C-4')、108.1 (C-5')、132.5 (C-6')。以上数据与文献[10]报道的mornigrol F一致,故鉴定化合物5为mornigrol F。
| [1] | Hu X, Ji J, Wang M, et al. New isoprenylated flavonoids and adipogenesis-promoting constituents from Morus notabilis [J]. Bioorg Med Chem Lett, 2011, 21: 4441-4446. |
| [2] | Hu X, Wang M, Yan GR, et al. 2-Arylbenzofuran and tyrosinase inhibitory constituents of Morus notabilis [J]. J Asian Nat Prod Res, 2012, 14: 1103-1108. |
| [3] | Syah YM, Achmad SA, Ghisalberti EL, et al. Artoindonesianins G-I, three new isoprenylated flavones from Artocarpus lanceifolius [J]. Fitoterapia, 2001, 72: 765-773. |
| [4] | Rivero A, Quintana J, Eiroa JL, et al. Potent induction of apoptosis by germacranolide sesquiterpene lactones on human myeloid leukemia cells [J]. Eur J Pharmacol, 2003, 482: 77-84. |
| [5] | Nomura T, Fukai T. Prenylflavonoids from the root bark of the cultivated mulberry tree [J]. Heterocycles, 1981, 15: 1531-1567. |
| [6] | Zheng ZF. Studies on the Chemical Constituents and Bioactivities of Lonicera japonica and Morus australia (金银花和鸡桑的化学成分及生物活性研究) [D]. Chinese Academy of Medical Sciences & Peking Union Medical College, 2010: 156. |
| [7] | Geng CA, Yao SY, Xue DQ, et al. New isoprenylated flavonoid from Morus alba [J]. China J Chin Mater Med (中国中药杂志), 2010, 35: 1560-1565. |
| [8] | Nomura T, Fukai T. Mulberrofuran A, a new isoprenoid 2-arylbenzofuran from the root bark of the cultivated mulberry tree (Morus alba L.) [J]. Heterocycles, 1978, 9: 1593-1601. |
| [9] | Kim JY, Lee WS, Kim YS, et al. Isolation of cholinesterase- inhibiting flavonoids from Morus lhou [J]. J Agric Food Chem, 2011, 59: 4589-4596. |
| [10] | Wang L, Gong T, Chen RY. Two new prenylflavonoids from Morus nigra L. [J]. Chin Chem Lett, 2009, 20: 1469-1471. |
 2015, Vol. 50
2015, Vol. 50


