2. 中国药科大学新药研究中心, 江苏 南京 210009
2. Center of Drug Discovery, China Pharmaceutical University, Nanjing 210009, China
全新结构药物的发现是一项高风险、高投入的复杂智力创新活动, 而构建化学结构是关键环节, 其中, 基于已有药物的药效团拼合和骨架的跃迁是最经济和最可靠的策略[1, 2]。基于1-取代-6-氟-喹啉 (萘啶)-4-酮-3-羧酸结构是喹诺酮类抗菌药物的基本药效团骨架, 对其他部位的结构修饰可产生许多新的抗菌新药[3]。与此同时, 新的研究发现其C-3羧基用杂环[4]或稠杂环[5]替代可将氟喹诺酮的抗菌活性转化为抗肿瘤活性, 然而, 在众多的 (稠) 杂环中, 哪些是C-3羧基适宜的等排体及如何对其等排体进一步优化, 目前所知甚少。为此, 一方面考虑到五元唑杂环, 尤其是由噻唑、三唑及其稠杂环化合物因具有多种药理活性而在构建药物的化学结构上备受关注[6]; 另一方面, 基于α, β-不饱和酮结构不仅是许多天然有效成分如查尔酮类和黄酮类的药效团骨架[7], 也是重要的有机活性反应因子, 在化合物多样性的构建中起重要作用[8]。同时, 近年由稠杂环酮构建的α, β-不饱和酮衍生物, 如已上市的舒尼替尼和II期临床中的SU 6668及BIB F-1000均具有较好蛋白酪氨酸激酶抑制活性, 已引领新靶点抗肿瘤药物的研究 [9, 10]。基于此, 本课题组把氟喹诺酮、噻二唑并均三唑稠杂环及α, β-不饱和酮等3种不同结构特征的药效团相拼合, 构建了氟喹诺酮C-3噻唑并[2,3-b]-[1, 2, 4]三唑-α, β-不饱和酮目标衍生物 (6a~6r), 并通过体外抗肿瘤活性筛选评价了构建该类化学结构的合理性, 为氟喹诺酮化合物的进一步结构设计提供新思路。目标化合物的合成如合成路线1所示。环丙沙星 (1) 与甲酸和甲醛发生Eschweiler-Clarke反应生成N-甲基环丙沙星 (2), 然后与80% 的水合肼直接发生肼解反应可方便得到相应的酰肼 (3)[5]。中间体3与硫氰化钾在稀盐酸中发生缩合反应到氨基硫脲酰胺 (4), 接着在碱性介质中发生缩−环合反应得C-3杂环中间体均三唑硫醇 (5)。通过两步一锅反应, 5先与氯乙酸发生稠合反应到稠杂环酮—噻唑并均三唑酮, 紧接着再与取代苯甲醛发生羟醛缩合到C-3稠杂环α, β-不饱和酮目标化合物 (6a~6r)。
结果与讨论 1 化学部分
目标化合物的结构经1H NMR、MS及元素分析确证, 其收率、物理常数及波谱数据见表1、2。在1H NMR低场δ8.90和8.20处出现的单质子单峰化学位移峰可归属于喹啉环骨架2-H和稠杂环5-位苯甲叉 (CH=) C-H, 其他低场质子化学位移峰可分别归属为喹啉环骨架5-H、8-H和苯环-H, 相应的高场质子化学位移峰与环丙基、N-甲基和苯环取代基相对 应。另外, 元素分析值及MS测定值也与目标化合物结构组成相一致, 表明所得到的目标化合物与预期的结构相符合。
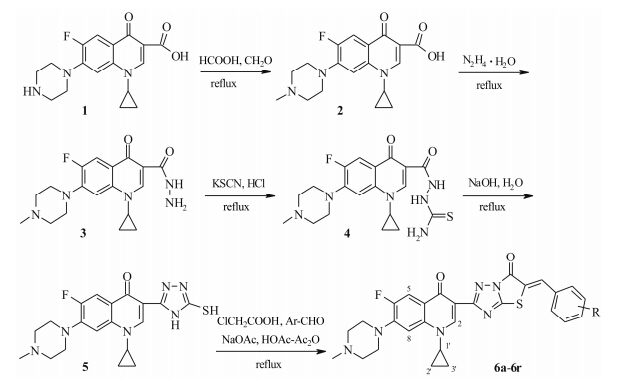 |
R: H- (a); 4-CH3O- (b); 2-CH3O- (c); 3,4-(OCH2O)- (d); 3,4,5-(OCH3)3-(e); 4-CH3- (f); 4-Cl- (g); 4-F- (h); 4-O2N- (i); 3-O2N- (j); 4-HOOC- (k); 4-CH3OOC- (l); 3-HOOC-(m); 3-CH3OOC- (n); 4-NC- (o); 3-NC- (p); 4-H2N-SO2- (q); 3-H2N-SO2- (r) Scheme 1 The synthetic route for preparation of the title compounds 6a−6r fromciprofloxacin (1) |
|
|
Table 1 Physical constants and spectral data of target compounds (6a−6r) |
|
|
Table2 1H NMR data of the target compounds (6a−6r) |
18个目标物对Hep-3B、Capan-1及HL60 3种 实验癌细胞的IC50值均在50.0 μmol∙L−1以下 (表3), 低于母体环丙沙星的IC50 (>100 μmol·L−1) 值。构−效关系表明, 苯环带有吸电子基如 -F、-NO2、-COOH、-CN、-SO2H2N取代的目标化合物其抗肿瘤活性显著高于供电子基取代的化合物的活性, 尤其是含 -COOH化合物 (6k、6m) 或磺酰胺基化合物 (6q、6r) 的活性最强, 其中对人胰腺癌Capan-1细胞的IC50值已达到或低于微摩尔浓度, 其活性优于或相当于对照抗肿瘤药物阿霉素的活性。另外, 当羧基被酯化形成 的 相应酯化物 (6l、6n) 或吸电子基由对位变化为间位时, 其活性减弱, 推测对位取代的化合物其空间结构更有利于与靶点的结合, 而羧基的存在可能与靶点的结合部位易形成氢键, 从而提高其抗肿瘤活性。基于此, 氟喹诺酮C-3羧基并非抗肿瘤活性所必需的药效团, 用稠杂环不饱和酮骨架替代有利于提高其抗肿瘤活性, 这为氟喹诺酮抗肿瘤先导化合物的进一步设计提供了新的思路。
|
|
Table3 The in vitro antitumor activity of the title compounds 6a-6r against the tested cancer cells (n = 3) |
熔点用WK-1B数字熔点仪测定 (上海精密科学仪器厂, 毛细管法, 温度未校正); AM-400型核磁共振仪 (德国Bruker公司), DMSO-d6为溶剂; Esquire LC型质谱仪 (德国Bruker公司); 2400-Ⅱ元素分析仪 (美国PE公司)。所用 环丙沙星1为商品, N-甲基环丙沙星酰肼 (3) 按文献[5]方法制备, 其他试剂均为分析纯。
1 化学合成 1.1 1-环丙基-6-氟-7-(4-甲基哌嗪-1-基)-3-(5-巯基- 4H-[1, 2, 4]三唑-3-基)喹啉-4(1H)-酮 (5) 的合成N-甲基环丙沙星酰肼3 (10.0 g, 28.0 mmol) 溶于5% 的稀盐酸 (100 mL), 然后加入硫氰化钾 (13.5 g, 140.0 mmol), 搅拌回流反应12 h。放置过夜, 滤集产生的固体。粗品4加入到5% 的氢氧化钾溶液 (200 mL) 中, 搅拌回流反应6 h。反应液用浓盐酸中和至pH 7.0, 滤集产生的固体, 用水洗涤, 真空干燥。粗品用DMF-乙醇重结晶, 得淡黄色固体5, 收率68.0%, mp 256~258 ℃。
1.2 1-环丙基-6-氟-7-(4-甲基哌嗪-1-基)-3-(5-芳甲叉基-5-氢-噻唑并[3,2-b][1, 2, 4]三唑-6-酮-2-基)-喹啉- 4(1H)-酮 (6a~6r) 合成通法 (以6a 为例)依次将中间体5 (0.50 g, 1.25 mmol)、熔融的无水乙酸钠 (0.12 g, 1.50 mmol)、氯乙酸 (0.14 g, 1.50 mmol) 和 苯甲醛 (0.16 g, 1.50 mmol) 溶于由醋酸 (5 mL) 和醋酐 (3 mL) 组成的混合溶剂中, 磁力搅拌油浴回流反应6 h。减压蒸除溶剂, 残留物柱色谱纯化 (氯仿−甲醇5∶1, v/v), 得棕色目标产物6a。用取代苯甲醛替代上述的苯甲醛, 按同法制得目标物6b~6r。
2 抗癌细胞体外增殖活性合成的18个C-3稠杂环不饱和酮目标化合物6a~6r及对照环丙沙星 (ciprofloxacin, CFX) 和结构类似抗癌药物阿霉素(doxorubicin, DOX) 用DMSO配成1.0×10−2 mol∙L−1浓度的储备液, 用RPMI-1640稀释到所需浓度。取对数生长期的人肝癌Hep-3B细胞、人胰腺癌Capan-1细胞及人白血病HL60细胞分别以每孔5 000个细胞接种于96孔板, 培养隔夜后, 加入不同浓度的上述供试化合物溶液, 继续培养48 h后弃去培养基。每孔加入1 g·L-1 MTT溶液100 μL, 继续培养4 h后弃上清液。每孔加入150 μL二甲基亚砜, 轻轻振荡30 min, 用酶标仪在570 nm波长处测其吸光度值。计算各组对癌细胞的抑制率: 抑制率% = [(1 − 实验组吸光度值) / 对照组吸光度值]×100%。然后以各药物浓度的对数值对各浓度下的抑制率作线性回归, 得浓度−效应方程, 以此计算出各供试化合物对实验癌细胞的半数抑制浓度 (IC50)。所有实验在相同条件下重复进行3次, 最终结果以mean ± SD表示。
| [1] | Guo ZR. Modification of natural products for drug discovery [J]. Acta Pharm Sin (药学学报), 2012, 47: 209-218. |
| [2] | Guo ZR. Strategy of molecular drug design: dual-target drug design [J]. Acta Pharm Sin (药学学报), 2009, 44: 144-157. |
| [3] | Takiff H, Guerrero E. Current prospects for the fluoroquinolones as first-line tuberculosis therapy [J]. Antimicrob Agents Chemother, 2011, 55: 5421-5429. |
| [4] | Hu GQ, Hou LL, Wang GQ, et al. Part IV: Design, synthesis and antitumor activity of fluoroquinolone C-3 heterocycles: bis- oxadiazole methylsulfide derivatives derived from ciprofloxacin [J]. Acta Pharm Sin (药学学报), 2012, 47: 1017-1022. |
| [5] | Xie SQ, Chen YS, Wang GQ, et al. Part IV. Synthesis and antitumor evaluation of s-triazolothiadiazines and pyrazolo s-triazoles derived from ciproxacin [J]. Acta Pharm Sin (药学学报), 2012, 47: 66-71. |
| [6] | Cao X, Sun Z, Cao Y, et al. Design, synthesis, and structure- activity relationship studies of novel fused heterocycles-linked triazoles with good activity and water solubility [J]. J Med Chem, 2014, 57: 3687-36706. |
| [7] | Karpaviciene I, Cikotiene I, Padrón JM. Synthesis and antiproliferative activity of α-branched α, β-unsaturated ketones [J]. Eur J Med Chem, 2014, 70: 568-578. |
| [8] | Bukhari SN, Jasamai M, Jantan I. Synthesis and biological evaluation of chalcone derivatives (mini review) [J]. Mini Rev Med Chem, 2012, 12: 1394-1403. |
| [9] | Sun L, Liang C, Shirazian Z, et al. Discovery of 5-[5-fluoro- 2-oxo-1, 2-dihydroindol-(3Z)-ylidenemethyl]-2, 4-dimethyl-1H- pyrrole-3-carboxylic acid (2-diethylaminoethyl)amide, a novel tyrosine kinase inhibitor targeting vascular endothelial and platelet-derived growth factor receptor tyrosine kinase [J]. J Med Chem, 2003, 46: 1116-1119. |
| [10] | Wang Y, Long YQ. Advances in small-molecule inhibitors of protein tyrosine kinases [J]. Chin J Org Chem (有机化学), 2011, 31: 1595-1606. |
 2015, Vol. 50
2015, Vol. 50


