阿尔茨海默病 (Alzheimer’s disease,AD) 是一种进行性神经退行性疾病,影响着全世界数百万人,至今很难诊断而且不可治愈。迄今为止美国食品药物管理局 (FDA) 只批准了5种药物多奈哌齐 (Aricept)、卡巴拉汀 (Exelon)、加兰他敏 (Reminyl)、他克林 (Cognex) 和美金刚 (Namenda) 用于AD的临床治疗。然而,这5种药物只能改善AD患者的症状,不能减慢AD的发展进程,更不能从根本上治疗AD[1, 2, 3]。
越来越多的研究表明,早在AD症状出现前10~20年,大脑中的病理改变已经发生[4, 5]。针对AD的病理机制目前主要有3种假说[6, 7]: 淀粉样蛋白沉积、神经元纤维缠结 (neurofibrillary tangles) 以及胆碱能神经元退行性病变。其中“淀粉样级联假说”被人们广泛认可。该假说认为: 在AD发生的早期,β-淀粉样蛋白 (Aβ,主要是Aβ40和Aβ42[8]) 逐渐聚合沉积形成淀粉样斑块,引发tau蛋白磷酸化和神经纤维缠结,最终导致神经元丢失、退化和痴呆[9]。因此研究和开发针对Aβ斑块的小分子探针,对于在分子水平研究AD的病理生理过程,以及为疾病的早期诊断和治疗提供依据显得尤为迫切。
1 Aβ斑块的分子成像现状 1.1 Aβ斑块的分子成像临床现状分子成像技术对患者创伤小,在分子水平上具有高敏感性,很有希望为AD早期诊断和治疗提供有效依据。磁共振成像 (MRI)、正电子发射断层成像 (PET)、单光子发射计算机断层显像 (SPECT) 和近红外荧光 (NIRF) 成像均能够提供AD脑部变化的信息,具有进行人和动物模型的AD诊断潜力[10, 11]。MRI只有在AD患者脑萎 缩发生后才能检测的到,而此时脑组织早已发生了病理学改变。近红外荧光 (NIRF) 成像探针处于临床前研究阶段。目前,应用于AD患者早期诊断的主要是PET和SPECT成像的Aβ探针。
PET和SPECT成像的Aβ探针主要包括: 11C- PIB[12]、11C-AZD2184[13]、18F-GE067[14]、18F-BF227[15]、11C-AZD4694[16]、11C-SB13[17]、18F-BAY94-9172[18]、18F-AV45[19]和18F-FDDNP[20]。18F-FDDNP是首个用于人类活体PET检测的AD诊断药物。 经静脉注射后18F-FDDNP通过血脑屏障,与AD患者脑内的Aβ斑块结合,在下丘脑、杏仁核以及内嗅皮层高效蓄积,尤其是病理改变较重的海马区滞留时间明显长于脑干区。18F-Florbetapir (Amyvid) 作为分子成像诊断AD的药物已经被FDA批准[21]。18F-Florbetapir耐受性良好,在人体内表现出良好的临床诊断能力和对AD患者特异性的表征能力。唯一应用于人体内SPECT成像的Aβ探针是123I-IMPY[22]。开发有效和多样的Aβ探针是分子成像领域的迫切任务。
1.2 Aβ斑块的分子成像研究现状虽然MRI成像和PET/SPECT成像已经在临床中用于AD的诊断,但MRI成像的灵敏度低、特异性差并且体积大的磁共振成像配体血脑屏障渗透性低。PET/SPECT成像成本高、有放射性危险、采集数据耗时长、核发射正电子半衰期短且同位素可用性狭窄。与以上方法相比,近红外荧光 (NIRF) 成像方法具有许多优点[23, 24]: ① 灵敏度高,可实现微弱信号的检测; ② 检测安全,不接触放射性元素; ③ 无需耗时,数据采集过程中实时成像; ④ 成本适中,无需昂贵的设备和技术高超的人员。虽然目前尚无法象PET/SPCET和MRI一样在临床推广,但它在临床前的动物研究中得到了广泛应用。近年来近红外荧光 (NIRF) 成像技术的发展相当迅速,大大加快了对AD研究的步伐,其重要性不言而喻。
2 NIRF探针的作用原理和特点 2.1 NIRF探针的作用原理探针是一种能和某特异靶分子相互作用、实现对靶分子进行检测的分子,并要求相互作用后对被探测对象不产生或仅产生可忽略的干扰。荧光探针就是以荧光物质作为指示剂,通过物理或化学作用与待测组分结合 (如: 氨基酸、蛋白质、抗体、酶等),使待测组分转化为能发荧光的衍生物,通过对荧光的检测,获得被测化合物定性或定量信息[25]。由于大多数生物分子本身无荧光或荧光较弱,检测灵敏度较差,人们用强荧光的标记试剂或荧光生成试剂对待测物进行标记或衍生,生成具有高荧光强度的共价或非共价结合的物质,使检出限大大降低,这就是荧光探针技术。近红外荧光成像 是以特定波谱范围的激发光源照射荧光分子 (近红外荧光探针),此时荧光分子被激发出不同光谱特性的光子信号,此信号通过滤光片后由超敏CCD (charge 2 coupled device) 照相机采集,然后通过高级数据处理技术将光子信号转换为图像[26]。
近红外荧光探针的最大吸收波长和发射波长 在近红外650~1 000 nm内。在此区间,生物体及其组织的吸收和发射都非常弱,因而被称为生物窗 (Biological Window)。该区域内的低背景荧光亦能增加荧光技术的灵敏度。另外,由于生物体对近红外荧光的光散射非常弱,使得近红外光在生物体内穿透的更深[26, 27]。NIRF探针具有较深的组织穿透距离且能大大减少活体组织及自发发光对成像的干扰,因此其临床应用前景极为可观,目前的发展也最为迅速。
2.2 NIRF探针的特点理想的NIRF荧光探针应具备以下特性[10, 28]: ① 高选择性和高亲和力的结合Aβ (一般要求抑制常数Ki < 20 nmol·L-1); ② 发射波长在近红外光谱范围内 (650~900 nm为最优); ③ 快速穿透完整的血脑屏障 (BBB) 且在正常脑组织中快速清除。探针的亲脂性和分子量是影响BBB渗透性的重要因素,因此探针logP在2~3.5,分子质量在400~600 Da为最优。探针的带电荷量也影响BBB,探针带电荷越多形成氢键能力越强,水溶性越强,BBB渗透性越差。Brain2 min/brain60 min是判断探针体内动力学优劣性的一个重要指标,brain2 min/brain60 min一般需要大于3.5; ④ 具有较大斯托克斯位移的高量子产率。探针的量子产率越高,大脑中Aβ斑块的特异性荧光信号越强; ⑤ 与牛血清白蛋白 (BSA) 结合亲和力低; ⑥ 在体内具有高代谢稳定性。测量周期中探针在体内应该是稳定的,体内代谢不能超过80%; ⑦ 与Aβ斑块结合后荧光特性 (如: 荧光强度、荧光寿命、发射波长和量子产率) 发生显著改变。Aβ(1-42) 的氨基酸序列为: DAEFRHDSGYEVHHQKLVFFAE
DVGSNKGAIIGLMVGGVVIA[29]。其中包括疏水性氨基酸(G,A,F,V,L,I,M)、带负电荷的氨基酸 (D,E)、带正电荷的氨基酸 (K) 和极性氨基酸 (Y,H,Q,N,S)[30]。研究显示Aβ(1-42) 的氨基酸序列中KLVFF为主要核心片段,分子探针主要与Aβ(1-42) 的疏水性片段LVFF通过疏水相互作用结合,而探针中的亲水性基团则与亲水性的HHQK片段相互作用[31]; ⑧ 可直接简单的合成。
3 新型NIRF探针分子的研究进展分子探针的设计和优化是分子影像学研究中的重要环节,是实现疾病高效、特异诊断的基础。设计高效特异的分子探针,进而结合活体成像技术对AD的神经病理过程进行活体定量评价在AD的基础和临床研究中均有着重要的作用。
用于PET/SPECT成像的Aβ探针大部分都是荧光染料的衍生物。如刚果红(Congo red) 的衍生物X-34和Me-X-34[32]、苯乙烯基类探针[33, 34]、苯并噻唑衍生物[35]、2-苯乙烯基哒嗪-3(2H)-酮衍生物[36]、氨基萘-2-氰基丙烯酸酯 (ANCA) 衍生物[37]、吡咯喹喔啉腙衍生物[38]、二价多功能姜黄素衍生物 [39]和荧光共轭聚噻吩衍生物[40, 41]。这些衍生物可以开发具有较高荧光强度的NIRF成像探针。
迄今为止,已经有许多关于检测Aβ斑块的近红外荧光探针的报道 (图 1,表 1)[42]。这些NIRF探针是由3个结构片段形成的高共轭分子,包括: ① 接受电子基团: 简称为受体,如二氰亚甲基; ② 供给电子基团: 简称供体,如对二甲氨基苯基; ③ 连接基团: 也称连接桥 ,一般为共轭π电子链[43]。本文将对NIRF探针的研究进展,按照结构进行分类介绍。
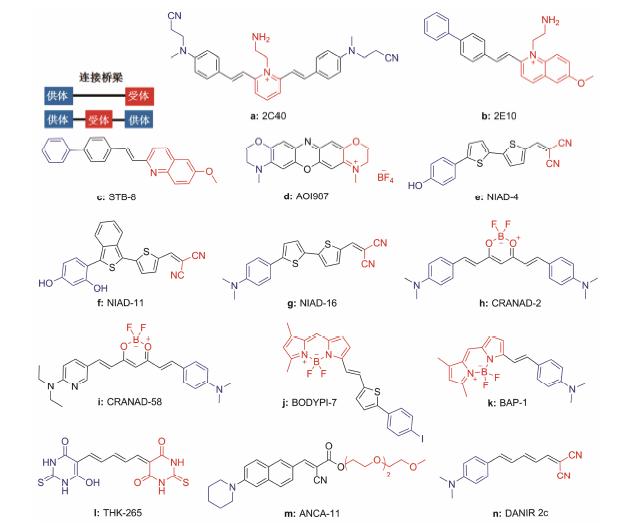 |
图 1 已报道的用于检测Aβ斑块的近红外荧光探针 (供体-受体和供体-受体-供体骨架) |
|
|
表 1 近红外荧光探针的结合性质和光学性质. a缓冲液或血清中的量子产率; b与Aβ结合后的量子产率; c HCl水溶液 (pH 1.4) 中测定; d血清中测定; e MeOH中测定; f缓冲液中测定 |
苯乙烯基类衍生物以苯乙烯基作为桥梁连接供体和受体,受体主要为吡啶季铵盐或者喹啉季铵盐 (季铵盐上有乙胺基团),苯环或氰基脂肪胺为供体。2004年,Chang课题组合成了化合物2C40[33](图 1a) (红色) 和2E10[33](图 1b) (绿色),这是近红外荧光探针的第一次尝试。这两个化合物与Aβ结合后成像对比度较高,有望成为用于体内诊断的荧光探针。2C40和2E10结构中有季铵盐 正电荷,亲水性强,很难穿透血脑屏障。
2007年,该课题组将2E10结构中的吡啶季铵盐除去,得到化合物STB-8[34](图 1c),STB-8以苯乙烯基连接不带电的吡啶受体和取代苯环供体,表现出特别优异的血脑屏障 (BBB) 渗透性,但最大发射波长仅有407 nm,并不满足近红外荧光检测的要求。
3.2 噁嗪类衍生物 (AOI987)噁嗪类衍生物是经典的供体-受体骨架,二苯并噁嗪为桥梁连接具有季铵盐结构的吗啉环受体和富电子的N取代吗啉环、吡啶环或噻嗪环供体。这类衍生物在噁嗪环中引入氮原子,有利于探针溶解度的改善和最大发射波长的红移。2005年,Gremlich课题组设计合成了AOI987[44] (图 1d),这是第一个成功用于Aβ体内检测的NIRF探针。它的最大吸收/发射波长 (λex = 560 nm,λem = 670 nm) 在近红外范围内且量子产率高 (Φ = 0.41),有利于体内成像; 在APP23转基因小鼠的体内检测中,可以穿透血脑屏障后特异性结合Aβ斑块。因此,AOI987可用于动物模型中监测阿尔茨海默症的进展过 程,评估AD药物的效用。然而,AOI987仍是一个带电分子,与Aβ聚合物结合后斯托克斯位移较小 (25 nm) 且亲和力不强 (Kd = 220 nmol·L-1)。
3.3 噻吩类衍生物(NIAD)高度可极化的噻吩类衍生物,采用经典的供体—受体骨架,以二噻吩乙烯基共轭π电子作为桥梁连接供体和受体,二氰基乙烯基团作为受体,羟基苯基团或对二甲氨基苯基团作为供体。该类探针的优势在于: ① 高度可极化的连 接桥有利于最大吸收/发射波长的红移; ② 刚性芳香环具有疏水性且易平面化,有利于特异性的结合Aβ; ③ 未结合Aβ时噻吩类衍生物沿单键自由旋转,结合后有利于荧光量子产率的增高; ④ 具有高供给电子能力的供体和高接受电子能力的受体,有利于最大吸收/发射波长的红移; ⑤ 不带电荷以及不易离子化的基团有利于提高BBB渗透性。
2005年,Swager课题组设计了分子质量较小 (334 Da) 的噻吩类衍生物NIAD-4[45](图 1e)。转基因小鼠体内成像结果显示NIAD-4能够特异性的结合Aβ (Ki = 10) 且易于穿透BBB。但是,其荧光量子产率极低 (Φ = 0.000 08) 且发射波长仅有603 nm,在NIR范围以外。2008年,该课题组主要对NIAD-4的供电子基团进行了优化,得到了最大发射波都在近红外范围内且红移明显的化合物NIAD-11[46](图 1f) 和NIAD-16[46](图 1g),其最大发射波长分别为690 nm和720 nm。转基因小鼠的光学成像检测和组织学染色表明NIAD-16是一个智能光学探针,只有与Aβ斑块结合后才能产生特征性的荧光信号。这种新型的 智能NIRF探针的出现,推动了NIRF探针在动物模型中的研究,具有成为一种新的AD早期诊断工具的潜力。
3.4 姜黄素类衍生物 (CRANAD)姜黄素类衍 生物是供体-受体-供体骨架结构,以二甲胺基苯 为供体,双键作为连接桥,而氟硼络合物则作为受体。这类探针的主要作用位点是Aβ40/42的疏水核 心片段 (KLVFF)。2009年,Ran课题组设计合成了CRANAD-2
为了减小CRANAD-2的脂溶性,2013年该课题组用N,N-二乙胺基吡啶基团替换CRANAD-2结构中的一个N,N-二甲胺基苯基合成了第一个既可作用于不可溶Aβ又可作用于可溶性Aβ的姜黄素类衍生物CRANAD-58[31](图 1i)。这个探针中CRANAD-2的保留部分被用来与Aβ的疏水性片段LVFF相互作用,而亲水吡啶基部分则用来与亲水的HHQK片段相互作用。CRANAD-58最大吸收/发射波长为630 nm/ 750 nm,小鼠体内体外实验表明它能够穿透BBB,与可溶 (Aβ40: Kd = 105.8 nmol·L-1,Aβ42: Kd = 45.8 nmol·L-1) 和不可溶Aβ均能很好的结合,且结合后荧光强度增强。目前,作者课题组参与了Ran课题组的研究工作,进行姜黄素类衍生物作为NIRF探针的进一步研究且已经取得了新的进展。
3.5 硼二吡咯亚甲基类衍生物 (BODIPY)BODIPY的衍生物以双键或噻吩基团连接取代苯基 (或碘苯,对二甲氨基苯) 供体和BODIPY受体,构成供体- 受体骨架。虽然Ono课题组合成的BODIPY-7 (2010年)[47](图 1j) 和BAP-1 (2012年)[48](图 1k) 与Aβ聚合物结合均具有较高亲和力 (分别为: Ki = 108 nmol·L-1,Kd = 44.1 nmol·L-1) 和量子产率 (分别为: Φ = 0.36,Φ = 0.468),但是它们在体内的BBB渗透性差,限制了在体内的应用。
3.6 4,6 (1H,5H)-嘧啶二酮类衍生物 (THK-265)2011年Kudo课题组报道了近红外荧光探针4,6 (1H,5H)-嘧啶二酮类衍生物THK-265[49](图 1l)。THK-265以共轭双键连接供体和受体,其中4,6 (1H,5H)-嘧啶二酮的醇式为供体,酮式为受体。THK-265的最大吸收/发射波长为639 nm/657 nm,与Aβ斑块结合的亲和力较高 (Kd = 97 nmol·L-1),特异性强且具有较好的亲脂性 (logP = 1.8)。小鼠体内NIRF成像实验证明该探针能有效穿透血脑屏障并牢固高效地结合大脑中的Aβ。然而THK-265与Aβ纤维结合后观察不到红移且斯托克斯位移小。
3.7 氨基萘-2-氰基丙烯酸酯类衍生物 (ANCA)ANCA以含氮原子基团为供体,包括: 哌啶、吗啉、甲基哌嗪、2-吗啉乙胺; 水溶性基团 (WSG) 为受体,包括: 三甘醇单甲醚、四甘醇单甲醚、1,2-丙二醇; 萘为桥梁连接供体和受体。WSG结构修饰不影响结合亲和力,而含氮供体基团的修饰则会显著改变结合亲和力,增加供体基团的亲水性能够增高与Aβ斑块结合的特异性。
2011年,Theodorakis课题组合成了ANCA-11[37] (图 1m),它与Aβ纤维结合后荧光强度增加 (7.7倍),与Aβ纤维低微摩尔亲和力结合 (Kd = 1.4 μmol·L-1)。但是ANCA-11最大发射波长 (λem = 590 nm) 不在近红外范围内。
3.8 共轭π电子链类 (DANIRs)DANIRs探针以共轭π电子链 (不同长度共轭双键) 为桥梁连接对二甲胺基苯基供体和二氰亚甲基受体。DANIRs探针的设计优势在于: ① 双键共轭可以进一步诱导吸收和发射光谱红移,DANIRs可以通过调节供体和受体基团之间共轭双键的长短,实现DANIRs近红外范围 发射波长的调整及Aβ斑块的结合亲和力的探究。② N,N '-二甲基基团作为供体是对位取代芳环中最佳红移基团。③ DANIRs结构中只有一个苯环,能够显著减小该探针的分子量。其中,2014年Ono课题组合成的具有3个共轭双键的DANIR 2c[43] (图 1n) 与牛血清白蛋白 (BSA) 基本不结合,在体内成像中与Aβ结合表现出高亲和力,可以快速穿透裸鼠血脑屏障并在正常大脑中快速清除。此外,静脉注射DANIR 2c后,22个月大APPSWE/PSEN1小鼠表现出比对照组更高的相对信号,且体外荧光观察能证实Aβ斑块的存在。但是DANIR 2c与Aβ结合后荧光强度 (12倍) 增加幅度较小。
4 小结目前AD早期诊断研究的热点之一是NIRF成像的新光学方法。NIRF成像技术安全、价廉、分辨率高并且可以大规模筛选淀粉样蛋白沉积。NIRF探针通常是小分子荧光染料,用于近红外 (组织散射和吸收都最低) 吸收光和发射光。虽然迄今为止所报道的NIRF探针仍存在一些局限,但随着分子成像技术和探针生物安全性的不断进展,相信这些不足将会逐步弥补完善。开发出适合AD早期诊断的NIRF荧光探针,对于AD相关的病理研究和药物开发将具有重大的意义。
| [1] | Kung HF. The β-amyloid hypothesis in Alzheimer's disease: seeing is believing [J]. ACS Med Chem Lett, 2012, 3: 265- 267. |
| [2] | Liu RT, Lü QJ. Progress in the research on multi-target- directed drugs against Alzheimer's disease [J]. Acta Pharm Sin (药学学报), 2009, 44: 258-263. |
| [3] | Yang WC, Sun Q, Yu NX, et al. Design of acetylcholinesterase inhibitor for Alzheimer's disease therapy: from multi-binding site inhibitors to multi-target directed ligands [J]. Acta Pharm Sin (药学学报), 2012, 47: 313-321. |
| [4] | Buchhave P, Minthon L, Zetterberg H, et al. Cerebrospinal fluid levels of β-amyloid 1-42, but not of tau, are fully changed already 5 to 10 years before the onset of Alzheimer dementia. [J]. Arch Gen Psychiatry, 2012, 69: 98-106. |
| [5] | Braak E, Griffing K, Arai K, et al. Neuropathology of Alzheimer's disease: what is new since A. Alzheimer? [J]. Eur Arch Psychiatry Clin Neurosci, 1999, 249: S14-S22. |
| [6] | Gong HC, Wang YL, Wang HW. Epigenetic mechanisms of Alzheimer's disease and related drug research [J]. Acta Pharm Sin (药学学报), 2013, 48: 1005-1013. |
| [7] | Rong XF, Wang XL. An overview of biomarkers in Alzheimer's disease [J]. Acta Pharm Sin (药学学报), 2012, 47: 551-557. |
| [8] | Selkoe DJ. Translating cell biology into therapeutic advances in Alzheimer's disease [J]. Nature, 1999, 399: A23-A31. |
| [9] | Hardy J, Selkoe DJ. The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics [J]. Science, 2002, 297: 353-356. |
| [10] | Ran C, Xu X, Raymond SB, et al. Design, synthesis, and testing of difluoroboron-derivatized curcumins as near-infrared probes for in vivo detection of amyloid-β deposits [J]. J Am Chem Soc, 2009, 131: 15257-15261. |
| [11] | Hintersteiner M, Enz A, Frey P, et al. In vivo detection of amyloid-β deposits by near-infrared imaging using an oxazine- derivative probe [J]. Nat Biotechnol, 2005, 23: 577-583. |
| [12] | Glenner GG, Wong CW. Alzheimer's disease: initial report of the purification and characterization of a novel cerebrovascular amyloid protein [J]. Biochem Biophys Res Commun, 1984, 120: 885-890. |
| [13] | Vallabhajosula S. Positron emission tomography radiopharmaceuticals for imaging brain beta-amyloid [J]. Semin Nucl Med, 2011, 41: 283-299. |
| [14] | Nesterov EE, Skoch J, Hyman BT, et al. In vivo optical imaging of amyloid aggregates in brain: design of fluorescent markers [J]. Angew Chem Int Ed Engl, 2005, 44: 5452- 5456. |
| [15] | Shimadzu H, Suemoto T, Suzuki M, et al. Novel probes for imaging amyloid-β: F-18 and C-11 labeling of 2-(4-aminostyryl) benzoxazole derivatives [J]. J Labelled Compd Rad, 2004, 47: 181-190. |
| [16] | Koole M, Lewis DM, Buckley C, et al. Whole-body biodistribution and radiation dosimetry of 18F-GE067: a radioligand for in vivo brain amyloid imaging [J]. J Nucl Med, 2009, 50: 818-822. |
| [17] | Kung MP, Hou C, Zhuang ZP, et al. Binding of two potential imaging agents targeting amyloid plaques in postmortem brain tissues of patients with Alzheimer's disease [J]. Brain Res, 2004, 1025: 98-105. |
| [18] | Newberg AB, Wintering NA, Plössl K, et al. Safety, biodistribution, and dosimetry of 123I-IMPY: a novel amyloid plaque-imaging agent for the diagnosis of Alzheimer's disease [J]. J Nucl Med, 2006, 47: 748-754. |
| [19] | Zhang W, Oya S, Kung MP, et al. F-18 polyethyleneglycol stilbenes as PET imaging agents targeting Aβ aggregates in the brain [J]. Nucl Med Biol, 2005, 32: 799-809. |
| [20] | Agdeppa ED, Kepe V, Liu J, et al. Binding characteristics of radiofluorinated 6-dialkylamino-2-naphthylethylidene derivatives as positron emission tomography imaging probes for beta- amyloid plaques in Alzheimer's disease [J]. J Neurosci, 2001, 21: RC189. |
| [21] | Kingwell K. Alzheimer disease: Florbetapir - a useful tool to image amyloid load and predict cognitive decline in Alzheimer disease [J]. Nat Rev Neurol, 2012, 8: 471. |
| [22] | Swahn BM, Sandell J, Pyring D, et al. Synthesis and evaluation of pyridylbenzofuran, pyridylbenzothiazole and pyridylbenzoxazole derivatives as 18F-PET imaging agents for β-amyloid plaques [J]. Bioorg Med Chem Lett, 2012, 22: 4332-4337. |
| [23] | Ntziachristos V, Ripoll J, Wang LV, et al. Looking and listening to light: the evolution of whole-body photonic imaging [J]. Nat Biotech, 2005, 23: 313-320. |
| [24] | Ntziachristos V. Fluorescence molecular imaging [J]. Annu Rev Biomed Eng, 2006, 8: 1-33. |
| [25] | Gomes A, Fernandes E, Lima JL. Fluorescence probes used for detection of reactive oxygen species [J]. J Biochem Biophys Methods, 2005, 65: 45-80. |
| [26] | Rao J, Dragulescu-Andrasi A, Yao H. Fluorescence imaging in vivo: recent advances [J]. Curr Opin Biotechnol, 2007, 18: 17-25. |
| [27] | Frangioni J. In vivo near-infrared fluorescence imaging [J]. Curr Opin Biotechnol, 2003, 7: 626-634. |
| [28] | Nesterov EE, Skoch J, Hyman BT, et al. In vivo optical imaging of amyloid aggregates in brain: design of fluorescent markers [J]. Angew Chem Int Ed Engl, 2005, 44: 5452- 5456. |
| [29] | Zhang S, Iwata K, Lachenmann MJ, et al. The Alzheimer's peptide Aβ adopts a collapsed coil structure in water [J]. J Struct Biol, 2000, 130: 130-141. |
| [30] | Tomaselli S, Esposito V, Vangone P, et al. The α-to-β conformational transition of Alzheimer's Aβ-(1-42) peptide in aqueous media is reversible: a step by step conformational analysis suggests the location of β conformation seeding [J]. Chembiochem, 2006, 7: 257-267. |
| [31] | Zhang X, Tian Y, Li Z, et al. Design and synthesis of curcumin analogues for in vivo fluorescence imaging and inhibiting copper-induced cross-linking of amyloid beta species in Alzheimer's disease [J]. J Am Chem Soc, 2013, 135: 16397- 16409. |
| [32] | Klunk WE, Bacskai BJ, Mathis CA, et al. Imaging Aβ plaques in living transgenic mice with multiphoton microscopy and methoxy-X04, a systemically administered congo red derivative [J]. J Neuropathol Exp Neurol, 2002, 61: 797- 805. |
| [33] | Li Q, Lee JS, Ha C, et al. Solid-phase synthesis of styryl dyes and their application as amyloid sensors [J]. Angew Chem Int Ed Engl, 2004, 43: 6331-6335. |
| [34] | Li Q, Min J, Ahn YH, et al. Styryl-based compounds as potential in vivo imaging agents for β-amyloid plaques [J]. Chembiochem, 2007, 8: 1679-1687. |
| [35] | Ono M, Hayashi S, Kimura H, et al. Push-pull benzothiazole derivatives as probes for detecting β-amyloid plaques in Alzheimer's brains [J]. Bioorg Med Chem, 2009, 17: 7002- 7007. |
| [36] | Park YD, Park JH, Hur MG, et al. Fluorescent 2-styrylpyridazin-3(2H)-one derivatives as probes targeting amyloid-beta plaques in Alzheimer's disease [J]. Bioorg Med Chem Lett, 2012, 22: 4106-4110. |
| [37] | Chang WM, Dakanali M, Capule CC, et al. ANCA: a family of fluorescent probes that bind and stain amyloid plaques in human tissue [J]. ACS Chem Neurosci, 2011, 2: 249-255. |
| [38] | Gemma S, Colombo L, Forloni G, et al. Pyrroloquinoxaline hydrazones as fluorescent probes for amyloid fibrils [J]. Org Biomol Chem, 2011, 9: 5137-5148. |
| [39] | Liu K, Guo TL, Chojnacki J, et al. Bivalent ligand containing curcumin and cholesterol as a fluorescence probe for Aβ plaques in Alzheimer's disease [J]. ACS Chem Neurosci, 2011, 3: 141-146. |
| [40] | Nilsson KP, Aslund A, Berg I, et al. Imaging distinct conformational states of amyloid-β fibrils in Alzheimer's disease using novel luminescent probes [J]. ACS Chem Biol, 2007, 2: 553-560. |
| [41] | Aslund A, Sigurdson CJ, Klingstedt T, et al. Novel pentameric thiophene derivatives for in vitro and in vivo optical imaging of a plethora of protein aggregates in cerebral amyloidoses [J]. ACS Chem Biol, 2009, 4: 673-684. |
| [42] | Cui M. Past and recent progress of molecular imaging probes for β-amyloid plaques in the brain [J]. Curr Med Chem, 2014, 21: 82-112. |
| [43] | Cui M, Ono M, Watanabe H, et al. Smart near-infrared fluorescence probes with donor-acceptor structure for in vivo detection of β-amyloid deposits [J]. J Am Chem Soc, 2014, 136: 3388-3394. |
| [44] | Hintersteiner M, Enz A, Frey P, et al. In vivo detection of amyloid-β deposits by near-infrared imaging using an oxazine- derivative probe [J]. Nat Biotechnol, 2005, 23: 577 |
| [45] | Nesterov EE, Skoch J, Hyman BT, et al. In vivo optical imaging of amyloid aggregates in brain: design of fluorescent markers [J]. Angew Chem Int Ed Engl, 2005, 44: 5452- 5456. |
| [46] | Raymond SB, Skoch J, Hills ID, et al. Smart optical probes for near-infrared fluorescence imaging of Alzheimer's disease pathology [J]. Eur J Nucl Med Mol Imaging, 2008, 35: S93-98. |
| [47] | Ono M, Ishikawa M, Kimura H, et al. Development of dual functional SPECT/fluorescent probes for imaging cerebral β- amyloid plaques [J]. Bioorg Med Chem Lett, 2010, 20: 3885-3888. |
| [48] | Ono M, Watanabe H, Kimura H, et al. BODIPY-based molecular probe for imaging of cerebral β-amyloid plaques [J]. ACS Chem Neurosci, 2012, 3: 319-324. |
| [49] | Okamura N, Mori M, Furumoto S, et al. In vivo detection of amyloid plaques in the mouse brain using the near-infrared fluorescence probe THK-265 [J]. J Alzheimers Dis, 2011, 23: 37-48. |
 2015, Vol. 50
2015, Vol. 50


