固体药物一般都存在多种晶体形态,比如多晶型、溶剂化物 (水合物)、盐和共晶等[1]。而同一种药物的不同固体形态往往都具有独特的物理性质、化学性质和机械性能。这些性质的差异又会进一步影响药物的溶解度[2, 3, 4]、溶出度[5, 6, 7]、生物利用度[8, 9, 10]、稳定性[11, 12, 13]和可压缩性[14, 15, 16]等。因此,固体状态的稳定性是一个化合物能否被开发成药的关键因素之一。对许多的溶剂化物、水合物和亚稳晶型来说,它们在储存和生产过程中很容易发生转晶现象。因此,一般会首先考虑将室温条件下最稳定的固体形态开发为临床使用的剂型。但是,有时稳定晶型可能会存在某些缺陷,如溶解度太差、生物利用度低等,不得不考虑将一些动力学上稳定存在的亚稳晶型作为药用晶型开发上市。比如,无味氯霉素[17, 18]的稳定晶型A就因为溶解度太差而无效,最终只能将其亚稳晶型B开发为药用晶型。而使用亚稳晶型会存在转晶的风险,所以对药物固体状态转晶现象的研究在药物发展过程中也是非常重要的。
1 药物制备过程中的转晶现象一个确定药用晶型的固体药物的生产流程一般包括结晶 (制备合适晶型)、干燥、粉碎、过筛、混合、造粒和压片等。在此过程中,原料药经常会遇到一些条件苛刻的环境,如高温、高湿和高压等,从而导致原料药的固体形态发生转变。在药物生产过程中影响晶型转变的因素主要有溶剂、温度、湿度、研磨和压力等。
1.1 溶剂介导的转晶过程在药物结晶生产中,溶液结晶是最主要的方式,经常发现在不同溶剂中或同一种溶剂不同温度下会获得不同的晶型。原料药在溶液中的转晶过程不但受热力学控制,同时还受到动力学的影响。溶剂介导的转晶实验中最常用的是混悬实验。在药物多晶型筛选实验中,混悬实验经常被用来筛选稳定的晶型和辨别特定温度下两种晶型的热力学稳定性关系。本课题组[19]最近用混悬的方法制得了石杉碱甲低温时最稳定的无水晶型III,并且使用混悬的方法验证了石杉碱甲几种无水晶型的热力学稳定性关系。
溶剂介导的转晶过程受到很多因素的影响,如溶剂、温度、水含量和pH等,其中首要的因素是结晶的溶剂。Maher等[20]系统研究了7种溶剂中吡拉西坦亚稳晶型II向稳定晶型III转变的过程。结果发现,晶型转变的速率与搅拌速度、温度、吡拉西坦在溶剂中的溶解度和吡拉西坦与溶剂的相互作用有关。一般在搅拌更快、温度更高和使用吡拉西坦溶解度更大的溶剂条件下,该晶型转变的速率也更快。但是,这一规律在异丙醇中却不成立。这是因为吡拉西坦与异丙醇之间较强的氢键作用阻碍了其亚稳晶型向稳定晶型的转变。对于有些可以形成水合物的药物来说,则要注意结晶时溶剂中的水含量,热力学稳定的晶型在水含量较高的溶剂中也有可能转晶为水合物。Liu等[21]研究了不同水活度下茶碱无水晶型和水合物之间的相互转变关系。研究发现室温时,当水活度小于0.72时,茶碱的水合物会转变为无水晶型IV; 当水活度大于0.73时,茶碱的无水晶型IV则转变为水合物 (图 1)。有时溶液的pH值同样会影响药物晶型在溶液中的转晶过程。Orola等[22]系统研究了pH值对噻奈普汀药物在乙醇和水中结晶行为的影响 (表 1)。在96% 乙醇中,当pH < 5.40时得到A晶型,当pH > 6.80时得到B晶型,其余则得到A、B晶型的混合物; 在水中,当pH > 6.00时得到A、B和C晶型混合物,当pH < 5.80时得到无定形。
 |
Figure 1 Phase diagram after 3 days for theophylline form IV in water and methanol at 298.15 K[21] |
|
|
Table 1 Effect of pH on the product in 96% ethanol and in water[22]. A,B and C in the table represent the polymorphs A,B and C of tianeptine |
原料药通过结晶实验获得合适的药用晶型后则需要通过加热干燥除去吸附在表面的溶剂以控制残留溶剂量。在加热干燥或其 他一些工艺过程中,药物晶型可能被加热到很高温度,而在高温下亚稳晶型和水合物也很可能转晶为更稳定的无水晶型。Kim等[23]通过多晶型筛选发现了阿德福韦酯的两种新晶型NF-I和NF-II,其中NF-I为溶剂化物,NF-II为无水晶型。采用差示扫描量热 (differential scanning calorimetry,DSC) 技术研究了溶剂化物NF-I的加热转晶过程。结果发现,在加热条件下NF-I先脱溶剂转变为已知晶型V; 晶型V受热熔融后重新结晶生成晶型NF-II; NF-II经过加热最后转晶为最稳定的已知晶型I。由此可见,一个药物晶体在加热过程中可能出现非常复杂的转晶行为,想要获得特定的晶型就需要控制加热的温度和时间等条件。对该转晶过程进行动力学研究,可以获得转晶过程的活化能和半衰期等,从而确定该亚稳晶型能否长期稳定存在。Zhang等[24]采用DSC、X-射线粉末衍射 (X-ray powder diffraction,XRPD) 以及扫描电镜 (scanning electron microscope,SEM) 等技术对安非他酮氢溴酸盐晶型II向晶型I转变过程进行 动力学研究。结果显示,该转晶过程的活化能为239.4 kJ·mol-1,这意味着安非他酮氢溴酸盐晶型II向晶型I转变需要克服很高的能垒,也就是说安非他酮氢溴酸盐晶型II虽然在热力学上是亚稳晶型,但它在动力学上却是可以长期稳定存在的。
1.3 研磨导致的转晶过程研磨或球磨工艺在整个制药工业中的应用是非常普遍的,它常被用来减小药物颗粒的尺寸。在研磨过程中会有热量和振动能 产生,再加上其本身带有的机械能,最终可能导致药物晶型的无定形化或发生固态-固态多晶型转变现象。由于这种转变会导致药物理化性质的改变,继而影响药物的稳定性和有效性,因此,已有很多研究报道。Chan等[25]将32种具有多晶型的药物通过研磨实验来测试研磨对晶型转变现象的影响,结果发现,其中11种药物会发生晶型转变。固体药物在研磨过程中的转晶受到很多因素的影响,如温度、晶种和添加物等。同一个药物的同种晶型在不同温度下研磨可能会发生不同的转晶过程。苯基丁氮酮的不同晶型[26]被分别置于4 ℃和35 ℃条件下球磨。在4 ℃下研磨,苯基丁氮酮α、β和δ晶型都转变为一种新晶型ζ晶型,接着研磨ζ晶型又转变为ε晶型。在35 ℃条件下球磨,α晶型先转变为ζ晶型,接着研磨最终转变为δ晶型; β晶型直接转变为δ晶型,而δ晶型则保持不变。有时在研磨过程中加入晶种可以加快转晶的速度。Otsuka等[27]研究了氯霉素棕榈酸酯多晶型球磨过程中晶种对转晶过程的影响。研究发现,氯霉素棕榈酸酯晶型B经过球磨会转变为晶型A,如果不加入晶种,该转晶过程要持续150 min,而加入1% 晶型A作为晶种则只需要40 min。同样,在不加晶种时,氯霉素棕榈酸酯晶型C通过球磨16 min后先转变为晶型B,接着再研磨160 min才会完全转变为晶型A,如果加入1% 晶型A作为晶种,只需要研磨30 min,晶型C就完全转变为晶型A。另外,在研磨过程中溶剂和其他添加剂的加入也会影响固体药物的转晶行为。Trask等[28]研究加入少量溶剂对邻氨基苯甲酸研磨转晶的影响 (图 2)。晶型I不加溶剂研磨会转变为晶型III,而加入少量正庚烷研磨则转变为晶型II。晶型II不加溶剂研磨不会发生转晶,加入少量氯仿研磨则转晶为晶型III。晶型III不加溶剂研磨不会发生转晶,加入少量水研磨转晶为晶型I,而加入少量正庚烷研磨则转变为晶型II。由此可见,在研磨过程中,由于额外能量的加入,其转晶过程更加复杂,稳定晶型也有可能发生晶型转变现象。
 |
Figure 2 Summary of observed polymorph transformations among three anthranilic acid crystal forms via solvent-drop grinding[28] |
压力是引起固体药物晶型转变的重要因素之一。在药物的固体制剂中,片剂是使用最普遍的制剂方式,而在压片过程中的高压往往也是造成药物固体形态改变的原因之一。由于福司地尔稳定晶型I的溶解度太差,因此它的亚稳晶型II被选中开发为药用晶型[29]。但是,不幸的是,亚稳晶型II在压片过程中不稳定,当压力达到50 MPa时,其即会转变为稳定晶型I。Lefebvre等[30]系统研究了卡马西平药物不同晶型的可压缩性和压力下的稳定性。结果发现,其二水合物具有最佳的可压缩性,但是该晶型在高压下稳定性较差; 无水晶型α的稳定性最好、可压缩性较差。最终,综合考虑压缩性和稳定性,晶型β最适合开发为药用晶型。Boldyreva[31]研 究了在低温和高压下甘氨酸、L-丝氨酸和DL-半胱氨酸各种晶型的转晶过程。研究发现甘氨酸的晶型β 加压到0.8 GPa时会可逆的转变为晶型β '; DL-半胱 氨酸的晶型I通过加压可以转变为晶型II,继续加压,晶型II最终转变为晶型III。同时,压片时的温度也有可能对压力下的转晶过程产生影响。Rietveld等[32]通过研究分析作出了盐酸苯氟雷司的温度-压力相图。研究相图发现,在低温时,晶型II是所有压力下唯一稳定的晶型,但是当温度高于400 K时,只有在高压下晶型II才是稳定晶型,低压下晶型I才是最稳定的晶型。
2 药物储存过程中的转晶现象药物在储存过程中同样可能存在晶型转变现象。影响固体药物在储存过程中的转晶行为的因素主要为温度和相对湿度。为了提高难溶药物的溶解、溶出性能,有些亚稳晶型,甚至无定形也会被开发为药用晶型。这些亚稳晶型在储存过程中很有可能发生转晶现象,转变为更稳定的晶型。甲氧氯普胺是一种中枢镇吐药,它具有晶型I和晶型II两种晶型。徐坚等[33]通过研究发现,晶型II在室温下不稳定,其在室温存放1个月就完全转变为稳定晶型I。陈大为等[34]通过理论计算确定尼群地平3种晶型的稳定性顺序为I > II > III。并将这3种晶型放置于不同温度下,观察它们的转晶现象。结果发现,在40 ℃下II型转化为I型,III型未发生晶型转变; 在60 ℃和90 ℃下II型、III型均转化为I型。Grooff等[35]系统研究了硝苯地平在不同储存条件下其无定形向亚稳晶型以及亚稳晶型向稳定晶型转变的过程。结果发现,硝苯地平无定形晶型在室温下储存会转变为其亚稳晶型C,其转晶速率与温度有关。在40 ℃以下,随着温度升高转晶速率加快; 在40~48 ℃之间,随着温度升高,结晶速率快速下降。同时,转晶过程还受到相对湿度的影响。在22 ℃/0% RH条件下,无定形不会全部转变为亚稳晶型,而亚稳晶型也只有少量转变为稳定晶型; 在22 ℃/75% RH条件下,无定形在20天左右全部转变为亚稳晶型,而亚稳晶型也在100天内大部分都转变为稳定晶型。
对于一些以水合物为药用晶型的药物和容易形成水合物的药物来说,药物储存环境的相对湿度显得更加重要,因为湿度变化会使药物样品因失去或得到结晶水而发生晶型转变。Berzins等[36]将盐酸甲苯噻嗪的水合物和无水晶型的混合物储存于不同湿度条件下去观察其脱水或水合的转晶过程。研究发现,当相对湿度小于10% 时,所有水合物都脱水转变为无水晶型; 当相对湿度大于20% 时,所有无水晶型都吸水转变为水合物。同时无水晶型和水合物之间的相互转变过程还受到药物颗粒尺寸的影响。Crisp等[37]研究发现,当颗粒直径大于1 μm时,乳糖的无水晶型可以在环境湿度下稳定存在; 当颗粒直径小于1 μm时,乳糖的无水晶型在环境湿度下很快吸水转变为水合物。Kang等[38]研究了颗粒大小对化合物I (图 3) 水合物在干燥条件下稳定性的影响。研究发现,微粉化
 |
Figure 3 The structure and numbering scheme of compound I[38] |
前的水合物在0% 相对湿度条件下仍可以保持稳定,但微粉化后在相同条件下该水合物快速失水转变为无水晶型 (图 4)。
 |
Figure 4 Comparison of the rate of water loss at 0% RH between nonmicronized and micronized samples of form B[38] |
对于具有多晶型现象的固体药物,研究各晶型间晶型转变机制对于药物开发及选择合适的储存条件有重要意义。多晶型的转化是一个物理过程,是一个相的变化和平衡问题。目前提出的多晶型转化机制主要有固体-固体转晶机制和固体-溶液-固体转晶 (solution mediated phase transformation,SMPT) 机制。固体-固体转晶机制指出,多晶型物质之间的转变不需要借助溶液或其他气体,固体中的分子或离子通过改变排列方式变为更为稳定的晶型。根据该机制,转晶速率主要受外部环境因素 (温度、压力、相对湿度等)、晶体内部缺陷及杂质等因素的影响[39]。大多数的晶型转化过程需要溶剂作为媒介,根据SMPT转晶机制,亚稳晶型要先借助溶液溶解,而后再以稳定晶型析出[40, 41]。该转晶过程包括亚稳晶型的溶解、稳定晶型的成核以及生长等 (图 5)。热力学决定了 亚稳晶型的溶解度高于稳定晶型的溶解度,因此转变过程的推动力即为不同晶型间溶解度的差异。在SMPT转晶机制下,转晶速率由亚稳晶型的溶解和稳定晶型的成核生长这两者的相对速率决定。Kitamura等[42]研究表明,影响溶液中晶型转变的主要因素有: 过饱和度、温度、搅拌速率、反应物溶液的混合速率、溶剂性质、溶液pH及晶种等。在这些因素中,最基本的控制因素是体系的温度和过饱和度。
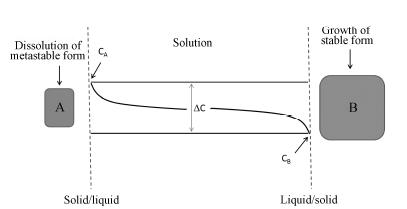 |
Figure 5 Process of solution mediated phase tranformation |
为了避免在药物生产和储存过程中出现晶型转变现象从而得到不需要的晶型,应对药物多晶型的物理化学稳定性加以重视,必要时甚至需要对亚稳晶型实施稳定化。当前对药物固体形态的稳定研究 最多的就是使用聚合物抑制药物无定形的结晶。如Kakumanu等[43]曾经使用加入聚合物的方法抑制塞来昔布的无定形结晶。但是对亚稳晶型的转晶行为的抑制研究目前还不是很多。有研究表明在亚稳晶型中加入其他添加物同样可以抑制其转晶行为。Lin等[44]系统研究了在研磨过程中加巴喷丁4种晶型的转晶行为,其中晶型I为水合物,而其他3种晶型则都是无水晶型。研究发现,在研磨过程中,如果不 加入添加物,加巴喷丁晶型II经过研磨先转变为晶型III,再继续研磨,最终转变为晶型IV。但是,如果向加巴喷丁晶型II中加入一些添加物如磷酸氢钙、环湖精和甘露醇等一起混合研磨,则晶型II的转晶过程受到 抑制,研磨后晶型II保持稳定,没有发生转晶现象。降血糖药物甲糖宁的晶型IV是一个亚稳晶型,它在水溶液中混悬会转变为稳定晶型I。Sonoda等[45]在水溶液中加入一个环寡糖衍生物2,6-二甲氧基-β-环湖精 (DM-β-CD),通过络合作用稳定亚稳晶型IV,从而抑制了它向稳定晶型I的转变 (图 6)。Ishiguro等[46]研究了羟丁基-β-环湖精 (DM-β-CyD) 对水溶液中氯磺丙脲亚稳晶型转晶过程的抑制作用。研究发现,在没有加入DM-β-CyD的水溶液中,氯磺丙脲的亚稳晶型II和III会很快转变为稳定晶型A。而DM-β-CyD对氯磺丙脲亚稳晶型转晶过程抑制的效果取决于DM-β-CyD的浓度。低浓度的DM-β-CyD只能抑制 氯磺丙脲亚稳晶型III向稳定晶型A的转变,而亚稳晶型II则仍然会转变为稳定性更好的晶型III,而高浓度的DM-β-CyD则可以稳定亚稳晶型II,抑制其在水溶液中的转晶过程。
 |
Figure 6 Possible mechanism for the inhibition of the solution- mediated polymorphic transition of form IV to form I of tolbutamide by the complexation with DM-β-CD[45] |
目前有很多难溶药物都采用亚稳晶型作为其药用晶型[12, 17, 18, 47],对亚稳晶型转晶现象的研究可以帮助这些药物选择合适的生产和储存条件,避免因转晶而获得不需要的晶型。同时,随着制药工业的发展,越来越多的难溶药物被开发应用到临床治疗中。可以预见,溶解、溶出性能更好的亚稳晶型也会获得更多的应用机会。对亚稳晶型转晶现象的研究有助于对难溶固体药物亚稳晶型的理解和控制,从而确保亚稳晶型在使用过程中的稳定性、安全性和有效性。
| [1] | Hilfiker R. Polymorphism in the Pharmaceutical Industry [M]. Weinheim: WILEY-VCH Verlag GmbH&Co. KGaA, 2006: 218. |
| [2] | Kumar SS, Nangia A. A solubility comparison of neutral and zwitterionic polymorphs [J]. Cryst Growth Des, 2014, 14: 1865-1881. |
| [3] | Aldawsari H, Altaf A, Banjar ZM, et al. Crystallization of a new polymorph of acetohexamide from 2-hydroxybutyl-β- cyclodextrin solution: form VI with a high aqueous solubility [J]. Int J Pharm, 2013, 453: 315-321. |
| [4] | Pudipeddi M, Serajuddin ATM. Trends in solubility of polymorphs [J]. J Pharm Sci, 2005, 94: 929-939. |
| [5] | Bonfilio R, Leal JS, Santos OMM, et al. Analysis of chlorthalidone polymorphs in raw materials and tablets and the effect of forms I and II on the dissolution properties of drug products [J]. J Pharm Biomed Anal, 2014, 88: 562-570. |
| [6] | Araya-Sibaja AM, Paulino AS, Rauber GS, et al. Dissolution properties, solid-state transformation and polymorphic crystallization: progesterone case study [J]. Pharm Dev Technol, 2014, 19: 779-788. |
| [7] | Silva APC, Meneghini LZ, Bajerski L, et al. Discriminatory dissolution test for tablets containing alpha- and beta- thalidomide polymorphs [J]. Dissolut Technol, 2013, 20: 19-25. |
| [8] | Yuan HJ, Chen DW, Ren Y, et al. Study on pharmacokinetics and bioavailability of nirendipine crystal polymorphs in rabbits [J]. Chin Hosp Pharm J (中国医院药学杂志), 2009, 29: 29-32. |
| [9] | Yuan HJ, Chen DW, Liu YL, et al. Study on pharmacokinetics of nimodipine polymorphs in rabbits [J]. Chin Pharm J (中国药学杂志), 2005, 40: 609-612. |
| [10] | Kobayashi Y, Ito S, Itai S, et al. Physicochemical properties and bioavailability of carbamazepine polymorphs and dihydrate [J]. Int J Pharm, 2000, 193: 137-146. |
| [11] | Yang C, Ren TK, Wang J, et al. Thermodynamic stability analysis of m-nisoldipine polymorphs [J]. J Chem Thermodyn, 2013, 58: 300-306. |
| [12] | Wang JR, Wang XJ, Lu LY, et al. Highly crystalline forms of valsartan with superior physicochemical stability [J]. Cryst Growth Des, 2013, 13: 3261-3269. |
| [13] | Upadhyay P, Dantuluri AK, Kumar L, et al. Estimating relative stability of polymorphs by generation of configurational free energy phase diagram [J]. J Pharm Sci, 2012, 101: 1843- 1851. |
| [14] | Khomane KS, Bansal AK. Differential compaction behaviour of roller compacted granules of clopidogrel bisulphate polymorphs [J]. Int J Pharm, 2014, 472: 288-295. |
| [15] | Khomane KS, More PK, Raghavendra G, et al. Molecular understanding of the compaction behavior of indomethacin polymorphs [J]. Mol Pharm, 2013, 10: 631-639. |
| [16] | Perumalla SR, Shi LM, Sun CC. Ionized form of acetaminophen with improved compaction properties [J]. Crystengcomm, 2012, 14: 2389-2390. |
| [17] | Chen GM. Polymorphism of chloramphenicol palmitate [J]. Chin Pharm Bull (药学通报), 1982, 17: 29-32. |
| [18] | Zhang MF, Gu YM, Dai ZY. Studies on the blood concentrations of different preparations of chloramphenicol palmitate [J]. Acta Acad Med Prim Shanghai (上海第一医学院学报), 1979, 6: 409-413. |
| [19] | Zhang Q, Lu LY, Dai WJ, et al. New polymorphs of huperzine A: preparation, structures, and physicochemical properties of anhydrous crystal forms [J]. Cryst Growth Des, 2013, 13: 2198-2207. |
| [20] | Maher A, Croker DM, Seaton CC, et al. Solution-mediated polymorphic transformation: form II to form III piracetam in organic solvents [J]. Cryst Growth Des, 2014, 14: 3967- 3974. |
| [21] | Liu C, Dang LP, Tong Y, et al. Influence of polymorphs on the transformation water activity of theophylline [J]. Ind Eng Chem Res, 2013, 52: 14979-14983. |
| [22] | Orola L, Veidis MV, Sarcevica I, et al. The effect of pH on polymorph formation of the pharmaceutically active compound tianeptine [J]. Int J Pharm, 2012, 432: 50-56. |
| [23] | An JH, Choi GJ, Kim WS. Polymorphic and kinetic investigation of adefovir dipivoxil during phase transformation [J]. Int J Pharm, 2012, 422: 185-193. |
| [24] | Zhang G, Gao LP, Zhang ZX, et al. Heating-induced phase transition of bupropion hydrobromide polymorphs [J]. J Pharm Sci, 2012, 101: 3091-3095. |
| [25] | Chan HK, Doelker E. Polymorphic transformation of some drugs under compression [J]. Drug Dev Ind Pharm, 1985, 11: 315-332. |
| [26] | Matsumoto T, Ichikawa JI, Kaneniwa N, et al. Effect of environmental temperature on the polymorphic transformation of phenylbutazone during grinding [J]. Chem Pharm Bull, 1988, 36: 1074-1085. |
| [27] | Otsuka M, Kaneniwa N. Effect of seed crystals on solid-state transformation of polymorphs of chloramphenicol palmitate during grinding [J]. J Pharm Sci, 1986, 75: 506-511. |
| [28] | Trask AV, Shan N, Motherwell WDS, et al. Selective polymorph transformation via solvent-drop grinding [J]. Chem Commun (Camb), 2005, (7): 880-882. |
| [29] | Takahashi Y, Nakashima K, Ishihara T, et al. Polymorphism of fostedil: chracterization and polymophic change by mechanical treatments [J]. Drug Dev Ind Pharm, 1985, 11: 1543-1563. |
| [30] | Lefebvre C, Guyot Hermann AM, Draguet Brughmans M, et al. Polymorphic transitions of carbamazepine during grinding and compression [J]. Drug Dev Ind Pharm, 1986, 12: 1913-1927. |
| [31] | Boldyreva EV. Combined X-ray diffraction and Raman spectroscopy studies of phase transitions in crystalline amino acids at low temperatures and high pressures: selected examples [J]. Phase Transitions, 2009, 82: 303-321. |
| [32] | Barrio M, Maccaroni E, Rietveld IB, et al. Pressure- temperature state diagram for the phase relationships between benfluorex hydrochloride forms I and II: a case of enantiotropic behavior [J]. J Pharm Sci, 2012, 101: 1073-1078. |
| [33] | Xu J, Ping QN, Liu GJ. Studies on the characteristics of polymorphs of metoclopramide [J]. J Chin Pharm Univ (中国药科大学学报), 1996, 27: 722-725. |
| [34] | Yuan HJ, Chen DW, Ren G, et al. Conversion conditions and influence factors of nitrendipine crystalpolymorphism [J]. Acta Chim Sin (化学学报), 2008, 66: 2429-2433. |
| [35] | Grooff D, Liebenberg W, De Villiers MM. Preparation and transformation of true nifedipine polymorphs: investigated with differential scanning calorimetry and X-ray diffraction pattern fitting methods [J]. J Pharm Sci, 2011, 100: 1944- 1957. |
| [36] | Berzins A, Actins A, Kreismanis JP. Hydration and dehydration kinetics of xylazine hydrochloride [J]. Pharm Dev Technol, 2009, 14: 388-399. |
| [37] | Crisp JL, Dann SE, Edgar M, et al. The effect of particle size on the dehydration/rehydration behaviour of lactose [J]. Int J Pharm, 2010, 391: 38-47. |
| [38] | Kang F, Vogt FG, Brum J, et al. Effect of particle size and morphology on the dehydration mechanism of a non- stoichiometric hydrate [J]. Cryst Growth Des, 2012, 12: 60-74. |
| [39] | Davey RJ, Guy PD, Ruddick AJ. The IV-III polymorphic phase transition in aqueous slurries of ammonium nitrate [J]. J Colloid Interface Sci, 1985, 108: 189-192. |
| [40] | Greco K, Bogner R. Solution-mediated phase transformation: significance during dissolution and implications for bioavailability [J]. J Pharm Sci, 2012, 101: 2996-3018. |
| [41] | Kralj D, Brecevic L, Kontrec J. Vaterite growth and dissolution in aqueous solution III: kinetics of transformation [J]. J Cryst Growth, 1997, 177: 248-257. |
| [42] | Kitamura M. Controlling factor of polymorphism in crystallization process [J]. J Cryst Growth, 2002, 237: 2205-2214. |
| [43] | Kakumanu V, Bansal A. Enthalpy relaxation studies of celecoxib amorphous mixtures [J]. Pharm Res, 2002, 19: 1873-1878. |
| [44] | Lin SY, Hsu CH, Ke WT. Solid-state transformation of different gabapentin polymorphs upon milling and co-milling [J]. Int J Pharm, 2010, 396: 83-90. |
| [45] | Sonoda Y, Hirayama F, Arima H, et al. Selective crystallization of the metastable form IV polymorph of tolbutamide in the presence of 2, 6-Di-O-methyl-β-cyclodextrin in aqueous solution [J]. Cryst Growth Des, 2006, 6: 1181-1185. |
| [46] | Ishiguro T, Hirayama F, Iohara D, et al. Crystallization and polymorphic transitions of chlorpropamide in aqueous 2- hydroxybutyl-β-cyclodextrin solution [J]. Eur J Pharm Sci, 2010, 39: 248-255. |
| [47] | Kogawa AC, Salgado HRN. Development and validation of infrared spectroscopy method for the determination of darunavir in tablets [J]. Phys Chem, 2013, 3: 1-6. |
 2015, Vol. 50
2015, Vol. 50


