自从1987年第一个HIV核甘类逆转录酶抑制剂齐多夫定 (zidovudine,AZT) 被批准以来,先后进入临床使用的抗HIV化学治疗单药有28个 (表 1) 和复方药物8个 (表 2)[1, 2]。在尚无有效HIV/AIDS疫苗的情况下,这些药物的联合使用,明显地改变HIV性质,大大减低了HIV的发病率和死亡率,显著延长了患者的生命。如今,原本致命的HIV感染变成了像乙肝和丙肝一样的慢性病毒感染性疾病,有些病例甚至达到功能性治愈的程度。然而,目前使用的抗HIV感染药物还存在种种弊病,诸如使用不方便、毒性高,特别是对耐药毒株效果差和对潜伏的病毒无效,最终导致HIV感染不能治愈。综合以上原因,开发新药势在必行,希望新药具有以下特点: 使用方便,耐受性好,毒副作用小,对耐药毒株显示良好活性,穿透和进入病毒潜伏区包括生殖器和中枢神经系统的能力强,针对病毒或细胞的新靶点,调节免疫和减少炎症反应,每日一次的剂型、每月或每季度一次的非肠道使用的缓释剂。本文拟针对上述特点的传统作用机制的准新药和最终可能清除潜伏病毒的一些正在研究中的化合物进行综合介绍。
|
|
表 1 已上市的抗HIV化学单体药物 |
|
|
表 2 已上市的抗HIV的复方药物 |
已批准临床使用的28个化疗药物的作用靶点分别是HIV的逆转录酶、蛋白酶、整合酶和病毒进入点。这些药物的联合使用,虽然未能治愈HIV感染,却也有效地控制并在一定程度上预防HIV感染。在长期的医疗实践中,这些药物的诸多缺陷也逐渐暴露出来,集中在毒性、耐受性、耐药性和使用方便性等方面。目前,解决上述缺陷的新药特别是整合酶抑制剂、病毒进入阻断剂和长效剂型的研究更受瞩目,有的药物已进入3期临床试验,可望在不久的将来被批准临床使用。
1.1 Tenofoviralafenamidefumarate (TAF,GS-7340)图 1是1个NRTI,是替诺福韦 (tenofovir,TDF),又 一个新的前药,为Gilead公司研制,目前处于3期临床试验阶段[3, 4]。TAF与TDF有相同的作用机制、抗病毒谱和耐药突变点,而且与所有的NRTI显示协 同作用。但相比之下,TAF显示更强的抗病毒活性,在CD4+细 胞和巨噬细胞培养中的EC50分别为11.0和9.7 nmol·L-1,而且在淋巴组织中分布更多。GS-9137/ cobicistat/FTC/TDF (stribild,Quad Pill,2012年被FDA批准固定的4种药物复合剂型) 对比GS-9137/ cobicistat/FTC/TAF的48周临床试验结果表明,这两种治法的药效结果无差异,病毒载量降至50拷贝/mL以下的百分率分别为87% 和88.4%,但是含TAF组的肾毒性低,到第24周,含TAF组与含TDF组患者血浆肌苷增高分别为0.07和0.12 mg·mL-1 (P <0.02)。
 |
图 1 Tenofoviralafenamidefumarate (TAF,GS-7340) |
图 2A是下一代的NNRTI,由Merk公司研制,目前正进行2期临床试验[5, 6]。该化合物对HIV野型株、两种最流行的NNRTI突变株K103N和Y181C均显示很强的抑制活性,IC50分别为12、9.7和9.7 nmol·L-1。在2期双盲对照试验中,25、50、100和200 mg的MK-1439 (每天一次) 和600 mg依非韦伦 (efavirenz,EFV,每天一次) 进行比较,它们分别与TDF/FTC联合用于新感染的患者,24周后,所有患者的病毒学反应一致,CD4+细胞数目均显示升高。基于这些结果,100 mg MK-1439将用于96周的试验中。
1.3 Cabotegravir (GSK744)图 2B是一个整合酶抑制剂,与多鲁特格韦 (dolutegravir,DTG) 相似,由GlaxoSmithKline (GSK) 公司研制,目前正进行2期临床试验[7, 8]。GSK744具有广谱的抗病毒活性,包括HIV-1 A-G各类亚型和HIV-2。在外周血单核细胞培养中IC50低至0.22 nmol·L-1。在MT2细胞/HIV IIIB培养系统,GSK744 使用长达112天并未产生高耐药的突变。GSK744最大的特点是单一剂量注射后,半衰期长达21~50天,原因是它与血浆蛋白结合能力强。单一口服5和30 mg GSK744 10天后,病毒载量降低2.0数量级。研究结果表明,每月注射一次GSK744,能保护猴子免于阴道反复SHIV感染。进一步的临床试验数据显示,合用GSK744和2个NRTI药物24周后,用GSK744/RPV维持治疗,在48周可完全抑制82% 病毒。目前的临床研究集中在长效制剂的疗效。
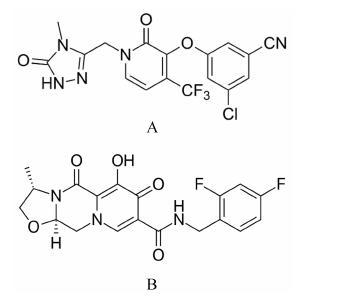 |
图 2 Doravirine (MK-1439,A) 和cabotegravir (GSK744,B) |
图 3A是一个新颖的进入抑制剂,是BMS-626529的前药。该化合物与HIV gp120外膜糖蛋白结合后改变其构像,阻止与CD4+受体结合。BMS-663068由Myers Squibb公司研制,目前正进行2期临床试验[9, 10]。此药对HIV-1实验室株和临床分离株有很强的抑制活性 (EC50 < 10 nmol·L-1)。试验结果还表明,它与不同作用机制的抗HIV-1药物有相加或协同作用。单一使用该药治疗患者,8天后病毒载量减低1.6数量级。将患者随机分成5组,分别给予BMS-663068 (400、800 mg,bid和600、1 200 mg,qd),对照组 (ATV/RTV),同时每个患者都接受TDF/MK-0518。24周后,各组患者对药物耐受性好,病毒载量小于50拷贝/mL的百分率分别为80%、69%、77% 和72%,而对照组为75%,而且CD4+细胞的增加数相近。
1.5 Cenicriviroc (TAK-652,TBR-652)图 3B是一个新的小分子CCR5和CCR2受体抑制剂,通过抑制CCR5,阻止病毒进入细胞,由于抑制CCR2受体,也具有抗炎活性,该药由Tobira公司研制,目前正在2期临床试验阶段[11, 12]。在细胞培养中,TAK-652对R5 HIV-1各型临床分离株的EC50和EC90分别为0.061和0.25 nmol·L-1,而对X4 HI V-1病毒无活性。口服100 mg是安全和耐受的,24 h后血浆药物浓度仍高于9.1 nmol·L-1,临床试验设计分3组,分别为TAK-652 100 mg/TDF/FTC、TAK-652 200 mg/TDF/FTC和EFV 600 mg/TDF/FTC,48周后,病毒抑制率依次为76%、73% 和71%。同时,含TAK-652治疗组的免疫和炎症指标均有改善。
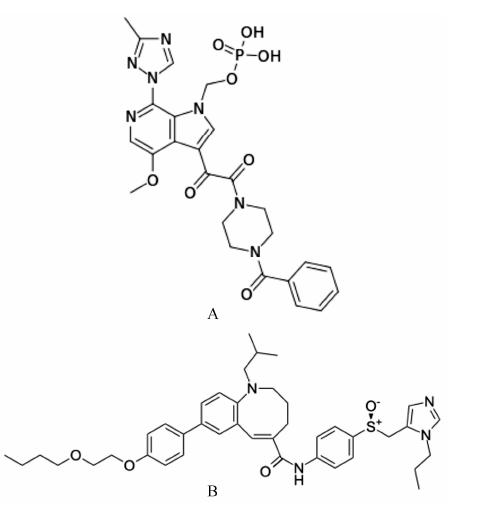 |
图 3 Fostemsavir (BMS-663068,A) 和cenicriviroc (TAK-652,TBR-652,B) |
祛除HIV藏匿之所,根治HIV潜伏感染的新药研究依赖于对病毒的“踢开和杀灭” (kick and kill),就是应用药理学干预踢开或唤醒潜伏的病毒,进而杀死这些病毒感染的细胞[13]。模拟HIV潜伏感染细胞的体外系统已被建立,一系列新药的研制也已陆续开展。目前,组蛋白去乙酰化酶抑制剂在此类药物中处于领先地位。其他的药物包括蛋白激酶C抑制剂、DNA甲基转移酶抑制剂、阳性转录延长因子激活剂和组蛋白甲基转移酶抑制剂等仅在少量癌症患者中试用,而针对去除HIV潜伏感染的研究尚处于早期体外高通量筛选阶段。
2.1 组蛋白去乙酰化酶抑制剂 (histone deacetylase inhibitors)组蛋白去乙酰化酶能够移去组蛋白核心赖氨酸残基上的乙酰基,致使组蛋白包裹DNA更紧密。而该酶的抑制剂阻止去乙酰化活性,进而影响基因表达。在HIV潜伏感染中,这些抑制剂能够激活未表达的基因,使隐匿的HIV-1被唤醒和活化,随后被宿主的免疫系统或化疗药物杀死[14]。目前,已有几个药物用于各种癌症的治疗,同时在小范围临床试验用于HIV-1潜伏处理。最近的研究证明,一种用于治疗T-细胞淋巴瘤的组蛋白去乙酰化酶抑制剂romidepsin (RMD) (图 4A) 体外明显激活潜伏的HIV-1基因表 达[15]。在HIV-1 CD4+细胞潜伏感染模型中,加入40 nmol·L-1 RMD 4 h后,病毒RNA水平增加6倍。丹麦科学家选用15名AIDS患者持续使用联合药物化疗,血浆HIV RNA水平已2年检测不出,低于50拷贝/mL以下,CD4+细胞数目大于500/mm3。当他们接受另一个组蛋白脱乙酰化酶抑制剂panobinostat (图 4B) 后,血浆HIV RNA水平显著增高,14名患者血浆HIV RNA显示阳性反应[16]。结果首次证明“病毒踢开”导致持久性的病毒颗粒在血浆释放。
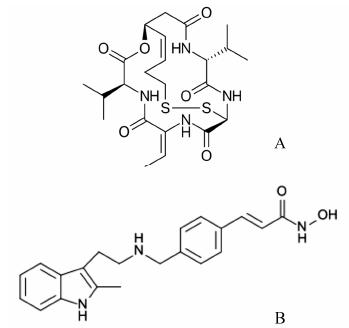 |
图 4 Romidepsin (RMD,A) 和panobinostat (B) |
蛋白激酶C是一组蛋白激酶,可使某些蛋白的丝氨酸和苏氨酸羟基磷酸化而控制其功能。试验证明,蛋白激酶C能磷酸化HIV的多种蛋白,促进病毒的活化。其激活剂上调蛋白激酶活性,诱导潜伏在细胞中HIV表达[17]。Prostratin (图 5A) 是一个蛋白激酶C激活剂,它原本出自萨摩亚一种树皮,现已被合成。在HIV潜伏感染的细胞内,prostratin激活病毒的复制,可能的机制是通过蛋白酶C介导的IκB激酶磷酸化,致使转录因子释放并穿透进入胞核与HIV LTR结合,最终导致病毒基因表达和病毒复制[17]。体外试验表明,当HIV潜伏感染的U1细胞培养基内加入prostratin 48 h后,HIV p24 gag蛋白产量明显增高[18]。Bryostatin (图 5B) 是大环内酯中的一员,在低浓度下具有很强的调节蛋白激酶活性的能力,并且通过NF-κB激活HIV转录。当HIV潜伏感染的THP-P89细胞被25 ng·mL-1 bryostatin处理24、48 h后,HIV p24蛋白释放量增高,强度优于prostratin[19]。
 |
图 5 Prostratin (A) 和bryostatin (B) |
DNA甲基转移酶的功能是催化甲基转移到DNA。尽管HIV LTR体内甲基化的程度尚存争议,但是DNA甲基转移酶抑制剂激活HIV-1复制的活性仍引人关注[20]。Decitabine (图 6A) 是一个小分子的DNA甲基转移酶抑制剂,已被批准用于治疗骨髓发育不良综合症。试验研究发现,这个化合物虽然激活潜伏HIV-1的活性较弱,但是在J-lat细胞系培养中它表现出与TNF-< i>α和prostratin的协同作用,明显促进病毒基因表达[21]。因此,促使DNA甲基转移酶抑制剂与其他类型的HIV潜伏逆转化合物的协同活性的研究。
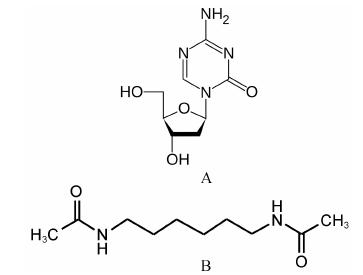 |
图 6 Decitabine (A) 和hexamethyllenebisacetadine (B) |
阳性转录延长因子 b在调节RNA多聚酶催化的病毒转录过程中扮演 关键角色[22],在HIV潜伏感染的细胞中,观察到病毒转录延长缺乏。化合物hexamethyllenebisacetamide (acetamide) (图 6B) 是阳性转录延长因子b的一个激活剂,通过激活P13K/Akt通道导致hexamethyllenebis- acetamide -诱生蛋白 (Hexim) 磷酸化,释放活化的阳性转录延长因子。随后,这些因子被征募到HIV-1中,刺激病毒转录延长,激活病毒复制[23]。
2.5 组蛋白甲基转移酶抑制剂 (histone methyltransferase inhibitors)组蛋白甲基转移酶是修饰组蛋白的一组酶,催化1、2或3个甲基转移到组蛋白的赖氨酸和精氨酸残基上。几个组蛋白甲基转移酶如EZH2、SUV39H1和G9a通过诱导组蛋白H3K9甲基化而影响潜伏的HIV基因转录[24]。BIXO1294 (图 7A) 是G9a选择性抑制剂,也是第一个被报道能激活潜伏HIV-1基因表达的组蛋白甲基 转移酶抑制剂[25]。化合物chaetocin (图 7B) 抑制SUV39H1,当加入含有HIV-1原病毒的Jurkat T细胞培养液中,可增高p24蛋白的表达[26]。研究还证明,这些组蛋白甲基转移酶抑制剂与组蛋白去乙酰化酶抑制剂在激活潜伏HIV-1基因表达上实现协同作用。
 |
图 7 BIXO1294 (A) 和chaetocin (B) |
随着高通量筛选技术的发展,越来越多的化合物逆转潜伏HIV的活性被评价,但作用机制尚不清楚,故未能分类。报道的化合物有juglone (5-HN) (图 8A)、disulfiram (图 8B)、AV6 (图 8C) 和quinolin-ol类似物 (图 8D) 等[27]。
 |
图 8 Juglone (5-HN,A)、disulfiram (B)、AV6 (C) 和Quinolin-ol类似物 |
目前抗HIV化疗药物的单一和复合制剂有36种,早期联合用药可使HIV/AIDS患者达到功能性治愈,1例“密西西比儿童”甚至被称已治愈[28]。然而,2014年6月,停药2年半的这个孩子血液内再次查出阳性病毒,印证了体内潜伏的HIV未能根除,也说明目前所有的化疗药物对藏匿的病毒无能为力[29]。根据现在的临床化疗的状况,抗HIV-1/AIDS的化疗药物的研发趋势: 第一是继续深入发现新的已有的4大类药 物,即核苷和非核苷类逆转录酶抑制剂、蛋白酶抑制剂、整合酶抑制剂和进入抑制剂,而这些新的抑制剂应该具有毒性小、对耐药毒株有效、患者耐受性好、使用方便、长效,特别是具有新的作用机制和穿透病毒藏匿之所能力强等诸多特点。目前,已有多种这类药物进入2、3期临床试验,如核苷和非核苷类逆转录酶抑制剂TAF和doravirine,长效的整合酶抑制剂cabotegravir,新的进入抑制剂fostemsavir和兼具抗炎活性的CCR5/CCR2受体阻断剂等。第二是开发清除HIV潜伏感染的药物。由于HIV潜伏感染的T细胞和单核细胞系模型已成功建立,导致高通量筛选激活潜伏HIV基因表达的化合物成为可能,并且阐明了其作 用机制。到目前为止,组蛋白去乙酰化酶抑制剂正处在研究前列,代表药物有romidepsin和panobinostat。其他仅处于体外筛选阶段,包括蛋白激酶C激活剂、阳性转录延长因子b激活剂、DNA甲基转移酶抑制剂、组蛋白甲基转移酶抑制剂及尚未分类的几个化合物。
| [1] | Zhang XQ. AIDS and anti-HIV-1 drugs [M]//Chen HS, Zhang XQ. Antivirus Drug: Methods and Applications (抗病毒药 物及其研究方法). 2nd. Beijing: Chemical Industry Press, 2013: 510-544. |
| [2] | Pavios R, Phillips EJ. Individualization of antiretroviral therapy [J]. Pharmacogenomics Personal Med, 2012, 5: 1-17. |
| [3] | Lee WA, He GX, Eisenberg E, et al. Selective intracellular activation of a novel prodrug of the human immunodeficiency virus reverse transcriptase inhibitor tenofovir leads to preferential distribution and accumulation in lymphatic tissue [J]. Antimicrob Agents Chemother, 2005, 49: 1898-1906. |
| [4] | Sax PE, Zolopa A, Brar I, et al. Tenofovira lafenamide vs tenofovir disoproxil fumarate in single table regimens for initial HIV-1 therapy: a randomized phase 2 study [J]. J Acq Immune Defic Syndr, 2014, 67: 1-7. |
| [5] | Lai MT, Feng M, Falgueyret JP, et al. In vitro characterization of MK-1439, a novel HIV-1 nonnucleoside reverse transcriptase inhibitor [J]. Antimicrob Agents Chemother, 2014, 58: 1652- 1663. |
| [6] | Morales-Ramirez JO, Gatell JM, Hagins DP, et al. Safety and antiviral effect of MK-1439, a novel NNRTI (+FTC/TDF) in ART-naïve HIV-infected patients [C]//21st Conference on Retroviruses and Opportunistic Infections (CROI). Boston, 2014, abstract #92. |
| [7] | Prade N, Markowitz M. Novel integrase inhibitors for HIV [J]. Expert OpinInvestig Drugs, 2010, 19: 1087-1098. |
| [8] | Margolis DA, Brinson CC, Eron JJ, et al. 744 and rilpivirine as two-drug oral maintenance therapy: LAI116482 (LATTE) week 48 results [C]//21st Conference on Retroviruses and Opportunistic Infections (CROI). Boston, 2014, abstract #39. |
| [9] | Nowicka-Sans B, Gong YF, McAuliffe B, et al. In vitro antiviral characteristics of HIV-1 attachment inhibitor BMS- 626529, the active component of the prodrug BMS-663068 [J]. Antimicrob Agents Chemother, 2012, 56: 3498-3507. |
| [10] | Lalezari J, Latiff GH, Brinson C, et al. Attachment inhibitor prodrug BMS-663068 in ARV-experienced subjects: week 24 analysis [C]//21st Conference on Retroviruses and Opportunistic Infections (CROI). Boston, 2014, oral abstract #86. |
| [11] | Baba M, Takashima K, Miyake H, et al. TAK-652 inhibits CCR5-mediated human immunodeficiency virus type 1 infection in vitro and has favorable pharmacokinetics in humans [J]. Antimicrob Agents Chemother, 2005, 49: 4584-4591. |
| [12] | Gathe J, Cade J, DeJesus E, et al. Week 24 primary analysis of cenicriviroc vs efavirenz, in combination with emtricitabine/ tenofovir, in treatment-naïve HIV-1 + adults with CCR5-tropic virus [C]//20st Conference on Retroviruses and Opportunistic Infections. Atlanta, 2013, abstract #106. |
| [13] | Kent SJ, Reece JC, Petravic J, et al. The search for an HIV cure: tackling latent infection [J]. Lancet Infect Dis, 2013, 13: 614-621. |
| [14] | Wei DG, Chang V, Fune E, et al. Histone deacetylase inhibitor romidepsin induces HIV expression in CD4 T cells from patients on suppressive antiretroviral therapy at concentrations achieved by clinical dosing [J]. PLoS Pathog, 2014, 10: e1004071. |
| [15] | Sgaard OS, Graversen ME, Leth S, et al. The HDAC inhibitor romidepsin is safe and effective reverses HIV-1 latency in vivo as measured by standard clinical assays [C]//20th International AIDS Conference. Melbourne, 2014, abstract #TUAA0106. |
| [16] | Keck K, Fernandez S, Phah A, et al. Viral specificity of small molecule latency disruptors [C]//20th International AIDS Conference. Melbourne, 2014, abstract #THPE015. |
| [17] | Davis RV, McKeman LN, Rhodes J, et al. In vivo effects of antiviral protein kinase C modulators on zebrafish development and survival [J]. ISRN Toxicol, 2011: 248280. |
| [18] | Williams SA, Chen LF, Kwon H, et al. Prostratin antagonizes HIV latency by activating NF-kappaB [J]. J Biol Chem, 2004, 279: 42008-42017. |
| [19] | Mehta R, Bivalkar-Mahta S, Zhang R, et al. Bryostatin modulates latent HIV-1 infection via PKC and AMPK Signaling but inhibits acute infection in a receptor independent manner [J]. PLoS One, 2010, 5: e11160. |
| [20] | Fernandez G, Zeichner SL. Cell line-dependent variability in HIV activation employing DNMT inhibitors [J]. Virol J, 2010, 7: 266-275. |
| [21] | Kauder SE, Bosque A, Lindqvist A, et al. Epigenetic regulation of HIV-1 latency by cytosine methylation [J]. PLoS Pathog, 2009, 5: e10000495. |
| [22] | Ott M, Geyer M, Zhou Q. The control of HIV transcription; keeping RNA polymerase II on track [J]. Cell Host Microbe, 10: 426-435. |
| [23] | McNamara LA, Ganesh JA, Collins KL. Latent-1 infection occurs in multiple subsets of hematopoietic progenitor cells and is reversed by NF-κB activation [J]. J Virol, 2012, 86: 9337-9350. |
| [24] | Bouchat S, Gatot JS, Kabeya k, et al. Histone methyltransferase inhibitors induce HIV-1 recovery in resting CD4+ T cells from HIV-1-infected HAART-treated patients [J]. AIDS, 2012, 26: 1473-1482. |
| [25] | Lehnetz B, Narthrop JP, Antignano F, et al. Activating and inhibitory functions for the histone lysine methyltransferase G9a in T helper cell differentiation and function [J]. J Exp Med, 2010, 207: 905-922. |
| [26] | Bernhard W, Barreto K, Saunders A, et al. The Suv39H1 methyltransferase inhibitor chaetocin causes induction of integrated HIV-1 without producing a T cell response [J]. FEBS Lett, 2011, 585: 3549-3554. |
| [27] | Xing S, Siliciano RF. Targeting HIV latency: pharmacologic strategies toward eradication [J]. Drug Discov Today, 2013, 18: 541-551. |
| [28] | Persaud D, Gay H, Ziemniak C, et al. Absence of detectable HIV-1 viremia after treatment cessation in an infant [J]. New Engl J Med, 2013, 369: 1828-1835. |
| [29] | "Mississippi Baby" Now Has Detectable HIV, Researchers Find [EB/OL]. 2014, www.niaid.nih.gov/news/newsreleases/2014/Pages/MississippiBabyHIV.aspx. |
 2015, Vol. 50
2015, Vol. 50


