2. 中国科学院上海药物研究所, 上海 201203
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
文拉法辛 (venlafaxine,VEN) 是第二代抗抑郁手性药物,在人体内主要依赖CYP2D6酶代谢为其主要活性代谢物去甲文拉法辛 (desvenlafaxine,DVS)[1,2]。研究表明,去甲文拉法辛能够抑制5-羟色胺和去甲肾上腺素的再摄取,并对多巴胺的再摄取有部分抑制作用[3,4]。去甲文拉法辛主要以原形或其葡萄糖醛酸结合物的形式经尿排泄[5]。去甲文拉法辛对肾上腺素能、Ml胆碱能及组胺Hl受体无明显亲和力[3],因 此其不良反应较少,安全性高。去甲文拉法辛在临床上以外消旋混合体形式给药,口服一天一次,有较好的病人顺应性,与其他抗抑郁药物相比具有某些优势,已成为治疗成人严重抑郁症的一线药物。
已报道的对映体药动学研究文献[6,7,8]主要是口服给药文拉法辛,一般未涉及口服给药去甲文拉法辛。仅一篇文献报道给予琥珀酸去甲文拉法辛后测定人血浆中去甲文拉法辛对映异构体[5],受试者为男性,其中黑人7名,白人4名,另外3名为其他人种,不能反映口服去甲文拉法辛后在中国健康人体内的药动学。
本实验旨在建立快速、灵敏、简便的手性LC-MS/ MS法测定单次空腹口服琥珀酸去甲文拉法辛后人血浆中DVS对映体,并将验证后的方法应用于中国男性健康受试者口服去甲文拉法辛对映体选择性药动学研究。
材料与方法 药品和试剂盐酸去甲文拉法辛 (含量99.9%) 由江苏豪森药业股份有限公司提供,S-去甲文拉法辛和R-去甲文拉法辛购自加拿大TRC公司,d6-去甲文拉法辛 (同位素纯度99.9%,化学纯度99%) 购自加拿大C/D/N Isotopes公司,琥珀酸去甲文拉法辛缓释片 (规格: 100 mg/片) 由美国辉瑞 (惠氏) 制药公司生产。甲醇 (德国Merck公司)、氨水及甲酸 (德国Fluka公司)、甲酸铵 (美国ROE公司) 均为色谱纯,去离子水由Millipore纯水仪制备。
仪器TSQ Quantum Vantage型三重四极杆串 联质谱仪,配备加热电喷雾电离源 (HESI源),美国Thermo Fisher公司; 岛津液相色谱系统,包括DGU- 20A3型脱气机,LC-20ADXR型二元液相泵,SIL- 20ACXR型自动进样器和CTO-20AC型柱温箱,日本岛津公司。
色谱条件分析柱: Astec ChirobioticTM V色谱柱 (150 mm × 4.6 mm,5 μm,美国Sigma-Aldrich公司); 预柱: C18保护柱 (4.0 mm × 3.0 mm,5 μm,美国Phenomenex公司); 流动相: 100%甲醇含2.5 mmol·L-1甲酸铵、 0.05‰ 甲酸 (含1% 氨水); 流速: 0.6 mL·min-1; 进样量: 5.0 μL。
质谱条件离子源: HESI源; 加热毛细管温度: 320 ℃; 气化室温度: 420 ℃; 鞘气 (N2) 压力: 35 Arb; 辅助器 (N2) 压力: 15 Arb; 碰撞气 (Ar) 压力1.2 mTorr (1 Torr ≈ 133 Pa); 碰撞能量 (CE) 均为35 V; 正离子方式检测; 扫描方式为选择反应监测 (SRM)。待测物的离子反应分别为: m/z 264→58+107 (去甲文拉法辛),m/z 270→64 (d6-去甲文拉法辛)。
标准系列样品和质控样品的制备精密称取盐酸去甲文拉法辛对照品适量,用甲醇溶解并定容至10 mL,获得对映异构体浓度均为0.500 mg·mL-1的储备液,再以甲醇-水 (50∶50,v/v) 稀释该储备液,获得一定浓度的标准系列溶液。盐酸去甲文拉法辛对映异构体的线性范围均为0.500、1.50、5.00、10.0、25.0、75.0和150 ng·mL-1。以甲醇-水 (50∶50,v/v) 稀释d6-去甲文拉法辛储备液 (0.657 mg·mL-1),获得浓度为50.0 ng·mL-1的内标工作溶液。另精密称取盐酸去甲文拉法辛对照品适量,获得对映异构体浓度也均为0.500 mg·mL-1的储备液,采用人空白血浆配制QC样品 [0.500 ng·mL-1 (LLOQ)、1.25 ng·mL-1 (LQC)、12.5 ng·mL-1 (MQC) 和120 ng·mL-1 (HQC)],储存于 -20 ℃条件下备用。
血浆样品预处理血浆样品预处理采用液液萃取法。向100 μL血浆中分别加入甲醇-水 (50∶50,v/v) 100 μL、内标溶液 (50.0 ng·mL-1的d6-去甲文拉法辛) 25.0 μL和25% 氨水30 μL,涡流1 min,用 2 mL乙酸乙酯进行萃取,涡流5 min,离心5 min (2 000×g),取上层有机相于另一干净试管中,在40 ℃氮气流下吹干,残留物中加入流动相100 μL复溶,涡流1 min,取5.0 μL进行LC-MS/MS分析。
方法验证对建立的方法进行方法验证,参照中国药典2010年版指导原则 (生物样品定量分析方法相关内容)[9]和欧盟EMA生物分析方法验证相关指导原则[10],从方法的选择性、标准曲线和定量下限、精密度和准确度、稳定性、回收率、基质效应等各方面进行方法验证。
人体药动学研究及分析 受试者的选择本试验严格遵守《赫尔辛基宣言》的有关伦理准则,临床试验经兰州大学第一医院伦理委员会批准,选取12名健康成年男性受试者,自愿参加试验并签署知情同意书。受试者平均年龄 (22.2 ± 1.6) 岁,平均身高 (171.6 ± 0.05) cm,平均体质量 (62.6 ± 2.0) kg。受试者用药前体温、心率、血压、呼吸等生命体征均正常,试验前所有受试者肝功能、肾功能、血尿常规和心功能检查均符合试验要求。
血样采集受试者于试验前一天统一清淡饮食后禁食过夜,试验日清晨空腹口服琥珀酸去甲文拉法辛缓释片100 mg。分别在服药前及服药后0.5、1、2、4、5、6、7、8、9、10、12、24、36、48和72 h采集静脉血4 mL于肝素管中,立即于4 ℃中离心10 min (3 500×g),获得的血浆样品于 -20 ℃冷冻保存,待测。
数据分析所得的血药浓度-时间数据以Phoenix WinNonlin®6.3 (美国Pharsight公司) 软件进行处理,用非房室模型,计算对映异构体的药动学参数,tmax和Cmax采用实测值,梯形法计算AUC0-t值和AUC0-∞值。
结果 1 质谱分析由于去甲文拉法辛的结构中含有碱性氮原子,优先选择正离子检测方式。而待测物及内标在HESI源条件下的响应显著高于APCI源以及ESI源,因此本实验选择HESI (+) 模式对待测物进行定量分析。在正离子检测模式下,去甲文拉法辛与d6-去甲文拉法辛分别主要生成m/z 264和m/z 270的 [M+H]+ 峰。选择性对 [M+H]+ 峰进行产物离子扫描分析,去甲文拉法辛生成的主要碎片离子为m/z 58和m/z 107,d6-去甲文拉法辛生成的主要碎片离子为m/z 64,选择监测产生的主要碎片离子作为定量分析检测的产物离子,待测物及内标的 [M+H]+ 产物离子全扫描质谱图见图 1。
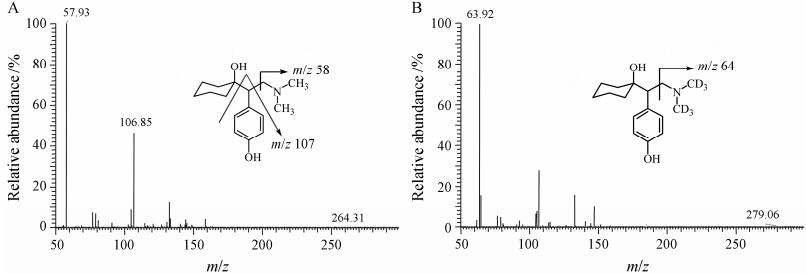
|
Figure 1 Product ion mass spectra of protonated molecules obtained from desvenlafaxine (A) and its IS d6-desvenlafaxine (B) |
结果表明,空白人血浆中的内源性物质不干扰去甲文拉法辛对映异构体和内标d6-去甲文拉法辛的测定,且同位素内标不干扰待测物的测定。典型色谱图见图 2。
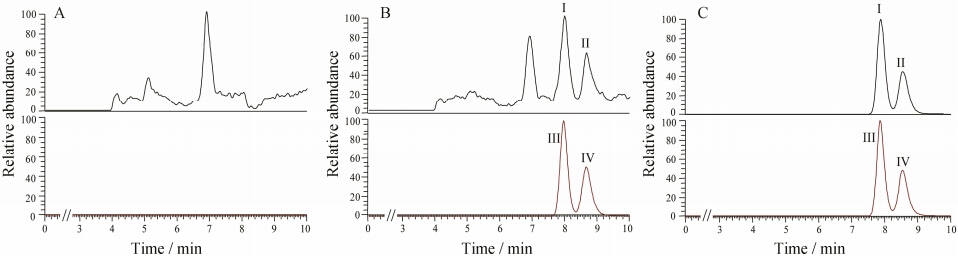
|
Figure 2 Typical LC-MS/MS chromatograms of desvenlafaxine,d6-desvenlafaxine (IS). A: Human blank plasma; B: LLOQ (1.25 ng·mL-1) sample spiked with IS (50.0 ng·mL-1); C: 4 h human plasma sample spiked with IS (50.0 ng·mL-1) after an oral administration at dose of 100 mg desvenlafaxine; Peak I,II,III and IV refer to S-(+)-desvenlafaxine,R-(-)-desvenlafaxine,S-(+)-d6-desvenlafaxine and R-(-)-d6-desvenlafaxine respectively |
用加权 (W = 1/x2) 最小二乘法进行回归运算,求得的标准曲线的相关系数 (r2) 均大于0.99。根据标准曲线,R-去甲文拉法辛、S-去甲文拉 法辛的线性范围均为0.500~150 ng·mL-1。典型标 准曲线如下所示: R-去甲文拉法辛,y = 8.02×10-2x + 9.41×10-3 (r2 = 0.999 3); S-去甲文拉法辛,y = 8.02× 10-2x + 3.73×10-3 (r2 = 0.999 0)。
2.3 定量下限取LLOQ血浆样品 (R-去甲文拉法辛、S-去甲文拉法辛加入浓度均为0.500 ng·mL-1),进行6样本分析,连续测定3天,并根据当日标准曲线计算每一样本测得浓度。求得该浓度R-去甲文拉法辛的日内精密度为4.9%,日间精密度为6.8%,准确度为 -5.3%; S-去甲文拉法辛的日内精密度为5.5%,日间精密度为5.8%,准确度为 -3.7%,该结果表明LC-MS/MS法测定人血浆中R-去甲文拉法辛、S-去 甲文拉法辛定量下限均可达0.500 ng·mL-1。
2.4 精密度与准确度R-去甲文拉法辛每一浓度水平的QC样品日内精密度小于4.0%,日间精密度小 于5.0%,准确度在 -1.9% ~ -0.4% 之间; S-去甲文拉法辛每一浓度水平的QC样品日内精密度小于5.2%,日间精密度小于4.1%,准确度在 -2.5% ~3.6% 之间,待测物QC样品测试结果均符合生物样品测定有关要求。R/S比例分别为2/1和1/2的QC样品日内及日 间精密度分别小于10.3% 和8.5%,准确度在 -4.7%~ -3.6% 之间,表明本方法可以准确测定不同的对映体比例。
2.5 回收率采用内标校正后可获得较高的回收率。R-去甲文拉法辛在低、中、高三浓度的回收率分别为93.8%、92.9% 和95.8%; S-去甲文拉法辛在低、中、高三浓度的回收率分别为99.4%、94.3% 和94.4%。
2.6 基质效应R-去甲文拉法辛在低、高两浓度经内标校正后的基质效应分别为102% 和98.6%,相对标准差分别为3.8% 和1.7%; S-去甲文拉法辛在低、高两浓度经内标校正后的基质效应分别为105% 和101%,相对标准差分别为3.5% 和2.2%。结果表明,待测物在本实验选择的色谱和质谱条件下,可忽略基质效应的影响。
2.7 稳定性去甲文拉法辛两对映异构体低、高两浓度血浆样品经预处理后室温放置24 h (两对映体标准差小于3.9%,准确度在 -1.8%~10.5%之间),血浆样品室温放置6 h (两对映体标准差小于1.7%,准确度在 -4.1%~ -0.3% 之间),经历3次冷冻-解冻循环(两对映体标准差小于0.6%,准确度在 -5.3%~ -2.7% 之间) 和 -20 ℃放置81天 (两对映体标准差小于6.1%,准确度在 -3.5%~8.3% 之间) 条件下均稳定。
2.8 稀释实验R-去甲文拉法辛和S-去甲文拉法辛经稀释后测得的精密度分别为2.6% 和3.6%,准确度分别为2.7% 和7.9%。结果表明,人血浆样品经空白人血浆稀释5倍后测定不影响结果的准确度。
3 对映体选择性药动学研究将所建立并经过验证的方法应用于琥珀酸去甲文拉法辛缓释片的人体药动学研究。12名健康受试者单次空腹口服琥珀酸去甲文拉法辛缓释片 (100 mg/人/次) 后,R、S-去甲文拉法辛的Cmax分别为 (114.9 ± 24.4) ng·mL-1、(125.1 ± 26.1) ng·mL-1,AUC0-t分别为 (2 911.9 ± 923.1) h·ng·mL-1、(3 147.8 ± 923.2) h·ng·mL-1,tmax分别为 (5.0 ± 1.7) h、(4.8 ± 0.9) h,对映异构体各自药时曲线见图 3,相关药动学参数见表 1。结果表明两对映体具有相似的药动学行为。
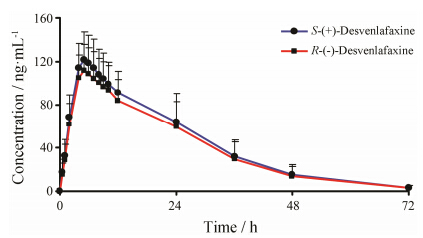
|
Figure 3 Mean plasma concentration-time (mean ± SD) profiles of R-(-)-desvenlafaxine and S-(+)-desvenlafaxine after oral administration of 100 mg racemic desvenlafaxine to 12 healthy Chinese volunteers |
|
|
Table 1 Pharmacokinetics parameters (mean ± SD) of R-(-)- ODV and S-(+)-ODV after oral administration of 100 mg racemic desvenlafaxine in 12 Chinese healthy volunteers |
去甲文拉法辛的分子量较小 (263 g·mol-1),极性大 (logP值2.26),采用HESI源时的响应高于APCI源以及ESI源,而本实验定量下限较低,HESI源可以对气化室进行加热,提高离子化效率和重现性,增加灵敏度,因此本实验最终采用HESI源,正离子方式检测。
本实验最终选择的流动相体系为极性有机相模式,与LC-MS/MS具有最佳兼容性[11]; 缓冲盐选用的是低浓度甲酸铵,在本实验中与醋酸铵相比有较好的分离效果。经过优化选择后,最终确定的柱温为15 ℃。由于去甲文拉法辛为碱性化合物,预处理过程中加入30 μL浓氨水有利于该化合物的提取。
与之前文献报道的采用LC-MS/MS法测定人血浆中去甲文拉法辛对映异构体的方法进行对比,本文方法预处理简单,为液液萃取; 分析时间短,为10 min; 血浆用量少,仅需100 μL; 定量下限满足测定要求、线性范围较合理。本分析方法的分离度>1.5,已达到对映体定量分离要求。相关数据见表 2。文献[6]采用柱后分流的方法缩短化合物色谱运行时间,血浆用量较大; 文献[7]同时测定人血浆中文拉法辛及其3种代谢物O-去甲基文拉法辛、N-去甲基文拉法辛以及N,O-双去甲基文拉法辛,采用固相萃取的方法,成本较高,操作步骤较繁琐,色谱运行时间长; 文献[8]采用Chiral-AGP柱(100 mm × 4.0 mm,5 μm),水相比例高,样品预处理方法为固相萃取,且血浆用量大,为500 μL; 文献[5]测定人血浆中去甲文拉法辛,未提供相应的色谱条件,且分开测定去甲文拉法辛血浆浓度与R/S对映异构体比例,较为繁琐。
|
|
Table 2 Comparison of different articles about determination of R-(-)-ODV and S-(+)-ODV in human plasma by LC-MS/MS |
本分析方法两对映体定量下限均为0.500 ng·mL-1,可以测得所有时间点的血药浓度值,满足本次对映异构体药代动力学分析需求。由表 1可知,单次空腹口服100 mg琥珀酸去甲文拉法辛缓释片后,R-去甲文拉法辛的Cmax为S-去甲文拉法辛的0.918,R/S对映体AUC0-t比值为0.923,R/S对映体AUC0-∞比值为0.925,而在不同的时间点R/S对映体血浆浓度比值基本保持不变,由于这种差异较小,可基本认为无临床意义。而对于其他药动学参数,如tmax、t1/2、MRT、Vd以及CL/F,两对映异构体间无显著性差异,由此可认为两对映体药动学基本一致。
文献[5]报道的空腹口服100 mg去甲文拉法辛后的R、S-去甲文拉法辛的Cmax分别为 (76.7 ± 20.0) ng·mL-1、(83.1 ± 22.3) ng·mL-1,AUC0-∞分别为 (1 915 ± 615) h·ng·mL-1、(2 057 ± 643) h·ng·mL-1。R/S对映体Cmax比值为0.923,R/S对映体AUC0-∞比值为0.931,与本次实验所得结果基本一致,表明口服去甲文拉法辛后,在东西方人体中两对映体具有相似的药动学特征。
与文献[5]报道的结果相比,本次实验所得结果R、S-去甲文拉法辛的Cmax分别为其1.50、1.51倍,AUC0-∞分别为其1.50、1.51倍。导致这种差异可能主要是由于两次实验受试者的身高、体重不同。在文献[5]中,受试者的平均年龄 (29.6 ± 6.8) 岁,平均身高 (182.3 ± 5.9) cm,平均体质量 (81.7 ± 9.7) kg,是本试验中国男性受试者平均体质量的1.31倍。此外,还可能与该药物在中国人体内代谢速度慢有关,但目前尚无相关文献报道。
已报道的文献[12]表明口服文拉法辛后,文拉法辛对映体R/S的Cmax比值为0.823,R/S对映体AUC0-t比值为0.917,R/S对映体AUC0-∞比值为0.932; 去甲文拉法辛对映体R/S的Cmax比值为1.23,R/S对映体AUC0-t比值为1.12,R/S对映体AUC0-∞比值为1.19。这与单独口服去甲文拉法辛的药动学结果不同,表明口服文拉法辛与口服去甲文拉法辛具有不同的人体药动学过程。
结论本文建立了手性LC-MS/MS法测定人血浆中去甲文拉法辛对映异构体,并进行了完整的方法验证。通过优化预处理条件、色谱条件和分析时间等显著提高了分析方法的效率。本方法具有简单、灵敏、易操作、选择性好的特点,并成功应用于琥珀酸去甲文拉法辛缓释片的人体药动学研究。通过对相关药动学参数进行计算及分析,发现单次空腹口服100 mg琥珀酸去甲文拉法辛缓释片后,在中国健康人体内,两对映异构体药动学参数基本一致,可认为无立体选择性。此外,各个对映体的Cmax和AUC参数是文献报道黑人和白人受试者相应参数的1.5倍左右。
致谢: 江苏豪森药业股份有限公司对该研究给予全力支持和帮助。兰州大学第一医院王婷主任药师及相关工作人员在临床实验上给予帮助。
| [1] | Shams ME, Arneth B, Hiemke C, et al. CYP2D6 polymorphism and clinical effect of the antidepressant venlafaxine [J]. J Clin Pharm Ther, 2006, 31: 493-502. |
| [2] | Preskorn S, Patroneva A, Silman H, et al. Comparison of the pharmacokinetics of venlafaxine extended release and desvenlafaxine in extensive and poor cytochrome P450 2D6 metabolizers [J]. J Clin Psychopharmacol, 2009, 29: 39-43. |
| [3] | Deecher DC, Beyer CE, Johnston G, et al. Desvenlafaxine succinate: a new serotonin and norepinephrine reuptake inhibitor [J]. J Pharmacol Exp Ther, 2006, 318: 657-665. |
| [4] | Bymaster FP, Dreshfield-Ahmad LJ, Threlkeld PG, et al. Comparative affinity of duloxitine and venlafaxine for serotonin and norepinephrine transporters in vitro and in vivo, human serotonin receptor subtypes, and other neuronal receptors [J]. Neuropsychopharmacology, 2001, 25: 871-880. |
| [5] | Nichols AI, Behrle JA, Richards LS, et al. The absolute bioavailability of desvenlafaxine in healthy subjects [J]. Bioequiv Availab, 2012, 4: 18-23. |
| [6] | Liu W, Wang F, Li HD. Simultaneous stereoselective analysis of venlafaxine and O-desmethylvenlafaxine enantiomers in human plasma by HPLC-ESI/MS using a vancomycin chiral column [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2007, 850: 183-189. |
| [7] | Kingbäck M, Josefsson M, Karlsson L, et al. Stereoselective determination of venlafaxine and its three demethylated metabolites in human plasma and whole blood by liquid chromatography with electrospray tandem mass spectrometric detection and solid phase extraction [J]. J Pharm Biomed Anal, 2010, 53: 583-590. |
| [8] | Dutta L, Ahmad SI, Mukherjee SK, et al. Liquid chromatography tandem mass spectrometry method for the simultaneous stereoselective determination of venlafaxine and its major metabolite, O-desmethylvenlafaxine, in human plasma [J]. Biomed Chromatogr, 2013, 27: 622-635. |
| [9] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the the People's Republic of China (中华人民共和国药典) [M]. Vol II. Beijing: China Medical Science Press, 2010: Appendix XIX B. |
| [10] | European Medicines Agency. Guideline on Bioanalytical Method Validation [S]. 2011. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2011/08/WC500109686.pdf. |
| [11] | Liu K, Zhong D, Chen X. Enantioselective quantification of chiral drugs in human plasma with LC-MS/MS [J]. Bioanalysis, 2009, 1: 561-576. |
| [12] | Kandhwal K, Dey S, Nazarudheen S, et al. Establishing bioequivalence of racemic venlafaxine formulations using stereoselective assay method: is it necessary? [J]. Chirality, 2011, 23: 948-954. |
 2015, Vol. 50
2015, Vol. 50


