心血管疾病在发达国家和大多数发展中国家是危害人类健康的主要杀手,而动脉粥样硬化 (atherosclerosis,AS) 是多种严重心血管疾病的病理基础。因此寻找预防和治疗动脉粥样硬化的药物具有十分重要的现实意义[1]。
研究表明,高密度脂蛋白胆固醇 (high-density lipoprotein cholesterol,HDL-C) 水平与冠状动脉心脏病 (coronary heart disease,CHD) 的发生成负相关,并且它是预测心血管疾病风险的一个重要组成成分[2]。HDL-C可以延缓动脉粥样硬化的发生与发展,其机制主要是通过促进胆固醇的逆向转运 (reverse cholesterol transport,RCT)[3]。RCT过程中,高密度脂蛋白 (high-density lipoprotein,HDL) 将胆固醇从周围组织 (包括动脉粥样斑块) 转运到肝脏进行再循环或以胆酸的形式排泄,从而减轻动脉粥样硬化病灶。ATP结合盒转运体A1 (ATP-binding cassette transporter A1,ABCA1) 和清道夫受体B型I (scavenger receptor class B type I,SR-BI) 是介导RCT的两个关键蛋白[4]。ABCA1在RCT过程中与载脂蛋白A-I (apolipoprotein A-I,apoA-I) 结合,参与HDL的形成,是RCT过程中的第一步也是关键的一步[5]; SR-BI是介导胆固醇逆转运的HDL受体,它可以促进胆固醇从外周细胞流出,又可以促进肝脏中胆固醇的选择性摄取[6]。人的高密度脂蛋白受体被称作CLA-1 (CD36 and LIMPII analogous-1)。ABCA1和SR-BI/CLA-1被认为是预防或治疗动脉粥样硬化的潜在靶标[7,8]。
为了寻找能够上调ABCA1或SR-BI/CLA-1的 小分子化合物,本实验室在前期工作中建立了人ABCA1[9]和CLA-1[10]表达上调剂筛选模型。本研究利用这两个模型,通过对国家新药 (微生物) 筛选实验室化合物库进行20 000样次筛选,获得了活性化合物E0869 (图 1),并对化合物进行了体外抗动脉粥样硬化活性及机制研究,对新型抗动脉粥样硬化药物的开发具有重要意义。

|
Figure 1 Chemical structure of E0869 |
RPMI 1640培养基、MEM培养基、DMEM培养基均购自Hyclone; 胎牛血清购自Gibco公司; G418购自Amresco公司; 荧光素酶检测试剂盒购自美国Promega公司; 筛选所用的化合物来自国家新药 (微生物) 筛选实验室,纯度 > 95%,可商业购买。
细胞培养含有人ABCA1基因上游调控序列 (-819~+67 bp) 的ABCA1p-LUC HepG2稳定转染细胞株[9]培养于含500 μg·mL-1 G418和10% 胎牛血清的RPMI 1640培养基中; 含有人CLA-1基因上游调控序列 (-1055~-62 bp) 的CLA-1p-LUC HepG2稳定转染细胞株[10]培养于含600 μg·mL-1 G418和10% 胎牛血清的MEM培养基中; 人肝癌细胞株HepG2细胞培养于含10% 胎牛血清的MEM培养基中; 小鼠单核-巨噬细胞RAW264.7培养于含10% 胎牛血清的DMEM培养基中。所有细胞都在5% CO2培养箱中37 ℃贴壁培养。所有细胞株均为本实验室保存。
化合物样品高通量筛选取对数生长期的ABCA1p-LUC HepG2或CLA-1p-LUC HepG2细 胞,以细胞数约5×105/mL接种于96孔透明底白板,每孔加入单细胞悬液100 μL。6 h后待细胞充分贴 壁,移去培养基,每个实验孔加入不含血清的培养基200 μL,再分别加入待测化合物样品2 μL,空白对 照孔加入相应浓度的DMSO。继续于37 ℃、5% CO2条件下培养,18~24 h后按照荧光素酶检测试剂盒中所述方法测定各孔细胞的荧光素酶活性。
计算待测样品对荧光素酶活性的改变率,改变率 (%) = 加入化合物后的荧光素酶活性 / 加入空白对照样品 (DMSO) 后的荧光素酶活性×100。
待测样品的改变率≥150% 的即视为初筛阳性,对初筛的阳性化合物进行进一步复筛,并观察其对细胞状态的影响。
活性化合物在ABCA1和CLA-1表达上调剂筛选模型上的EC50测定将筛选得到的活性化合物溶于DMSO中,配成100 mg·mL-1的母液。在透明底白色96孔板分别接种ABCA1p-LUC HepG2和CLA- 1p-LUC HepG2细胞,方法同“化合物样品高通量筛选”。先用DMSO将化合物从100 mg·mL-1浓度起,稀释成一系列浓度,再分别向1 mL无血清RPMI 1640或MEM培养基中加入1 μL用DMSO稀释好的化合物,以保证每个浓度的DMSO含量相同,均为0.1%,同时设含终浓度0.1% DMSO的培养基孔做空白对照。细胞贴壁后,换为用无血清RPMI 1640或MEM稀释的不同浓度化合物的培养基,每孔200 μL。18~24 h后,测定各孔细胞的荧光素酶活性,并分析样品浓 度与荧光素酶活性的改变率之间的量效关系,通过Graphpad Prism 5.0软件,拟合量效关系曲线。
逆转录聚合酶链反应检测活性化合物对基因mRNA表达水平的影响取HepG2细胞和RAW264.7细胞,以细胞数5×105/孔分别接种于6孔细胞培养板,37 ℃、5% CO2条件下培养,细胞贴壁并长至90% 汇合后,加入含一定浓度化合物的无血清DMEM培养基,同时对照孔加入含相应DMSO浓度的无血清DMEM培养基。设立加药组 (0.27,2.67,26.70,53.40,80.10 μmol·L-1 5个浓度) 和阴性对照组 (不加入待测样品),37 ℃、5% CO2条件下培养24 h。离心 (900×g,4 min) 收集细胞,TransZol Up试剂 (全式金公司) 提取细胞总RNA,利用反转录试剂盒 (全式金公司) 反转成cDNA。人ABCA1 (GenBank序列号: NM_005502) 引物为 (Left Primer: GCCTGCTAGTGGTCATCCTG,Right Primer: CCACGCTGGGATCACTGTA); 人CLA-1 (GenBank序列号: NM_001082959) 引物为 (Left Primer: TTCTGCCCGTGCCTGGAGTC,Right Primer: GCTGTCTGCTGGGAGAGTC); 人ABCG1 (GenBank序列号: NM_207174) 引物为 (Left Primer: GGGGT CGCTCCATCATTTG,Right Primer: TTCCCCGGTAC ACACATTGTC); 人FAS (GenBank序列号: NM_ 004104) 引物为 (Left Primer: AAGGACCTGTCTA GGTTTGATGC,Right Primer: TGGCTTCATAGGT GACTTCCA); 人SREBP-1c (GenBank序列号: NM_ 001005291) 引物为 (Left Primer: CGGAGCCATGGA TTGCACTTTC,Right Primer: GATGCTCAGTGGCA CTGACTCTTC); 内参照人β-actin (GenBank序列号: NM_001101) 引物为 (Left Primer: CCAACCGCGAG AAGATGA,Right Primer: CCAGAGGCGTACAGGG ATAG); 鼠ABCA1 (GenBank序列号: NM_013454) 引物为 (Left Primer: GCCTGCTAGTGGTCATCCTG,Right Primer: CCACGCTGGGATCACTGTA); 鼠SR-BI (GenBank序列号: NM_016741) 引物为 (Left Primer: GCCCATCATCTGCCAACT,Right Primer: TCCTGGGAGCCCTTTTTACT); 鼠ABCG1 (GenBank序列号: NM_009593) 引物为 (Left Primer: GTGGAT GAGGTTGAGACAGACC; Right Primer: CCTCGGG TACAGAGTAGGAAAG); 鼠CD36 (GenBank序列 号: NM_001159556) 引物为 (Left Primer: TTGTAC CTATACTGTGGCTAAATGAGA,Right Primer: CTT GTGTTTTGAACATTTCTGCTT); 内参照鼠β-actin (GenBank序列号: NM_007393) 引物为 (Left Primer: CTAAGGCCAACCGTGAAAG ,Right Primer: ACCA GAGGCATACAGGGACA)。PCR条件为95 ℃预变 性10 min,95 ℃变性15 s,60 ℃退火延伸1 min,40 个循环。
免疫印迹法检测活性化合物对基因蛋白表达的影响HepG2细胞和RAW264.7细胞处理方法同“逆转录聚合酶链反应检测活性化合物对基因mRNA表达水平的影响”。离心 (900×g,4 min) 收集细胞,细胞裂解液RIPA (普利莱基因技术有限公司) 裂解提取细胞总蛋白,BCA试剂盒 (Pierce) 进行蛋白定量,然后进行10% SDS-PAGE电泳,每孔20 μg蛋白。各蛋白抗体使用浓度: ABCA1 (1∶500 dilution; Novus); SR-BI (1∶1 000 dilution; Novus); ABCG1 (1∶1 000 dilution; Abcam); CD36 (1∶500 dilution; Novus); FAS (1∶2 000 dilution; Sigma); SREBP-1c (1∶1 000 dilution; Abcam); β-actin (1∶ 5 000 dilution; Sigma); Horseradish peroxidase-conjugated goat anti-rabbit IgG antibody (1∶2 000 dilution; ZSGB- BIO); Horseradish peroxidase-conjugated rabbit anti- mouse IgG antibody (1∶2 000 dilution; ZSGB-BIO)。用化学发光法 (ECL,Millipore) 试剂盒检测,照相后进行图像分析。以对照组作为内参对照,用各处理组的面积灰度值与对照组相比,所得的相对值作统计分析。
活性化合物对巨噬细胞泡沫化的影响RAW264.7细胞以细胞数5×104/孔铺于96孔板,于37 ℃、5% CO2条件下过夜培养后,换为无血清DMEM培养基 (100 μL/孔)。将细胞分为空白对照组 (不加Ox-LDL和待测样品)、泡沫细胞组 (加入80 μg·mL-1 Ox-LDL),加药组 [加入80 μg·mL-1 Ox-LDL和E0869 (0.27、2.67、26.70、53.40 μmol·L-1 4个浓度)],细胞贴壁后,加入终浓度为80 μg·mL-1 ox-LDL到泡沫细胞组和加药组,作用24 h后,加药组加入一定浓度的待测样品。37 ℃、5% CO2条件下再培养24 h,进行油红O染色。
取出96孔板,10%甲醛固定液固定 (20 μL/孔) 15 min,弃去溶液,双蒸水洗2次,加入60% 异丙醇 (150 μL/孔),放置5 min,弃去溶液。将油红O工作液 (现用现配,过滤) 加入各孔中,150 μL/孔,染色 1 h。弃去溶液,用60% 异丙醇 (150 μL/孔) 洗孔,然后用双蒸水 (150 μL/孔) 洗2次,最后每孔加入双蒸水150 μL,置于显微镜下观察、拍照。
活性化合物对巨噬细胞中胆固醇流出的影响RAW264.7细胞以细胞数5×104/孔铺于96孔板,每孔加入单细胞悬液100 μL,于37 ℃、5% CO2条件下过夜培养。待细胞完全贴壁后,弃去细胞液,换为含0.2% (w/v) BSA的DMEM培养基,加入荧光标记的胆固 醇22-NBD-cholesterol (Invitrogen),并使其终浓度为5 μmol·L-1,37 ℃、5% CO2条件下孵育24 h。24 h后,吸出培养基,用PBS洗细胞两次,加入含一定浓度 化合物的测定培养基 (DMEM加入0.2% BSA,0.1% DMSO),设立空白组 (不加入胆固醇)、对照组 (加入胆固醇,但不加入待测化合物) 和加药组 [加入胆固醇和E0869 (0.27、2.67、26.70、53.40和80.10 μmol·L-1)],37 ℃孵育18 h。加入终质量浓度为50 μg·mL-1的HDL,37 ℃孵育6 h。将上清转移到黑色96孔板中,用酶标仪在其激发光为485 nm,发射光为535 nm时测定其荧光值。将细胞用PBS洗两次,尽量不要损失细胞,每孔加入PBS 100 μL,用酶标仪在其激发光为485 nm、发射光为535 nm时测定其荧光值。胆固醇流出率% = 上清荧光值 / (上清荧光值+细胞内荧光值) ×100%。
结果 1 高通量筛选活性化合物用ABCA1-LUC HepG2和CLA-1p-LUC HepG2细胞对本室化合物库的20 000个化合物进行筛选,复筛后发现化合物E0869 (图 1) 具有上调ABCA1和CLA-1的活性。E0869的分子式为C20H22O5S,相对分子质量是374.46,淡黄色粉末,其化学名称是4-甲磺酰甲基苯甲酸-1-(3,4-二甲基苯基)-1-丙酮-2酯 [1-(3,4- dimethylphenyl)-1-oxopropan-2-yl 4-((methylsulfonyl) methyl)benzoate]。
2 E0869在ABCA1和CLA-1表达上调剂筛选模型中的量效关系曲线通过测定不同浓度的E0869在ABCA1和CLA-1表达上调剂模型上的荧光信号值,得到该活性化合物的量效关系曲线 (图 2)。结果表明,E0869能够分别以浓度依赖的方式增加ABCA1-LUC HepG2和CLA- 1p-LUC HepG2细胞荧光素酶活性。在ABCA1表达上调剂筛选模型上的EC50值为 (3.79 ± 0.28) μmol·L-1,最高上调活性为160%; 在CLA-1表达上调剂筛选模型上的EC50值为 (1.42 ± 0.10) μmol·L-1,最高上调活性为175%。

|
Figure 2 Dose-response curves for E0869 in Log scale. A: ABCA1p-LUC HepG2 cells; B: CLA-1p-LUC HepG2 cells. HepG2 cells were seeded in 96-well plates at 5×105 cells/mL in 100 µL medium for 6 h,followed by substitution with medium containing 0.01 to 100 µg·mL-1 concentration of the positive compound. Twenty hours later,the cells were harvested for measurements of luciferase activity. n = 3,x± s |
E0869能在模型中上调ABCA1和CLA-1的表达。而ATP结合盒转运体G1 (ATP-binding cassette transporter G1,ABCG1) 是ABCA1的同家族基因,它也是介导胆固醇流出的关键基因[11,12]; 脂肪酸合成酶 (fatty acid synthase,FAS) 和固醇调节元件结合蛋白-1c(sterol regulatory element-binding protein-1c,SREBP-1c) 是脂肪酸合成途径中的关键基因,二者在调控脂肪代谢中起着重要作用。因此,将E0869 (0.27、2.67、26.70、53.40和80.10 μmol·L-1) 处理HepG2细胞24 h,同时检测化合物E0869对ABCA1、CLA-1、ABCG1、FAS和SREBP-1c基因表达的影响。
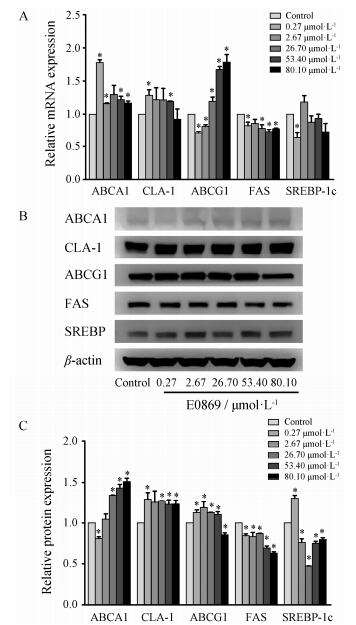
实时荧光定量PCR结果显示,ABCA1、CLA-1以及ABCG1的mRNA含量与对照相比均有所升高; FAS的mRNA含量与对照相比则有所降低; 当E0869浓度为2.67 μmol·L-1时,SREBP-1c的mRNA含量 略有升高,当浓度高于2.67 μmol·L-1时,SREBP-1c的mRNA含量与对照相比有所降低 (图 3A)。Western blot结果显示,与对照相比,E0869能够在蛋白水平增加HepG2细胞ABCA1、CLA-1以及ABCG1的表达; 对FAS的表达没有上调作用,反而有所降低; 当E0869浓度为0.27 μmol·L-1时,SREBP-1c的表达略有升高,当浓度高于0.27 μmol·L-1时,SREBP-1c表达量与对照相比有所降低 (图 3B和3C)。
|
Figure 3 E0869 influenced the mRNA level (A) and protein levels (B,C) of ABCA1,CLA-1,ABCG1,FAS and SREBP-1c in HepG2 cells. HepG2 cells were treated for 24 h with E0869 (0.27,2.67,26.70,53.40 and 80.10 μmol·L-1). A: Real-time quantitative PCR; B: Western blot; C: Grayscale scanning. P < 0.05 vs control group |
ABCA1、SR-BI以及ABCG1在巨噬细胞中的 表达及功能对胆固醇流出很重要,清道夫受体CD36 (cluster of differentiation 36) 是SR-BI的同家族受体,CD36能够使分化的单核巨噬细胞及受损增殖的血管内皮细胞无限制地摄取变性低密度脂蛋白 (modified low density lipoprotein,mLDL),造成巨噬细胞及血管内皮细胞泡沫化,从而加速动脉粥样硬化的发生与发展。因此,在RAW264.7细胞中检测化合物E0869 (0.27、2.67、26.70、53.40和80.10 μmol·L-1) 对ABCA1、SR-BI、ABCG1以及CD36基因表达的影响。
实时荧光定量PCR结果显示,ABCA1的mRNA含量与对照相比有显著升高; SR-BI和ABCG1的mRNA含量在一定范围内与对照相比有所升高,但在高浓度时则会降低; CD36的mRNA含量与对照相比则有所降低 (图 4A)。Western blot结果显示,与对照相比,E0869能够在蛋白水平显著增加RAW264.7细胞ABCA1、SR-BI以及ABCG1的表达,而对CD36的表达没有明显的升高作用 (图 4B和4C)。

|
Figure 4 E0869 influenced the mRNA (A) and protein levels (B,C) of ABCA1,SR-BI,ABCG1 and CD36 in RAW264.7 cells. RAW264.7 cells were treated for 24 h with E0869 (0.27,2.67,26.70,53.40 and 80.10 μmol·L-1). A: Real-time quantitative PCR; B: Western blot; C: Grayscale scanning. P < 0.05 vs control group |
巨噬细胞泡沫化实验结果显示,空白对照组细胞未孵育Ox-LDL,细胞内无红色油状颗粒 (图 5a); 对照组细胞与80 μg·mL-1 Ox-LDL孵育,细胞内呈现大量红色油状颗粒 (图 5b),呈现明显泡沫化,表明胞内脂质堆积; 而经过E0869 (0.27、2.67、26.70和53.40 μmol·L-1) 处理的细胞,与对照组相比,胞内红色颗粒明显减少,说明E0869能减少脂质等在巨噬细胞内聚积,对巨噬细胞的泡沫化具有一定的抑制作用 (图 5c~5f)。

|
Figure 5 Effects of E0869 on lipid accumulation in RAW264.7 cells. Cells were incubated with 80 μg·mL-1 Ox-LDL for 24 h,followed by another incubation with different concentrations of E0869 for 24 h. Lipids were stained with oil red O and examined by microscopy; representative images are shown as a-f. a: Blank (cells only); b: Control (80 μg·mL-1 Ox-LDL); c: Ox-LDL (80 μg·mL-1) + E0869 (0.27 μmol·L-1); d: Ox-LDL (80 μg·mL-1) + E0869 (2.67 μmol·L-1); e: Ox-LDL (80 μg·mL-1) + E0869 (26.70 μmol·L-1); f: Ox-LDL (80 μg·mL-1) + E0869 (53.40 μmol·L-1). Magnification,200× |
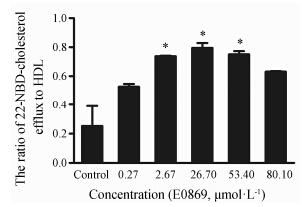
结果 (图 6) 显示,E0869在0.27~26.70 μmol·L-1浓度内呈剂量依赖性增加胆固醇流出,在高浓度时胆固醇流出量有所降低,但与对照相比仍呈现上升趋势。
|
Figure 6 E0869 stimulated cholesterol efflux from RAW264.7 to HDL. RAW264.7 macrophages were preincubated with 22-NBD-cholesterol for 24 h. Then the cells were washed with phosphate-buffered saline and incubated with E0869 (0.27,2.67,26.70,53.40 and 80.10 μmol·L-1). After 18 h,high-density lipoprotein (HDL) (50 µg·mL-1 at the final concentration) was added and coincubated for 6 h at 37 ℃. The amounts of cholesterol in medium and cell were measured separately. n = 3,x± s. P < 0.05 vs control group |
ABCA1和SR-BI/CLA-1是参与RCT的关键蛋 白,ABCA1和SR-BI/CLA-1表达量增高能够促进胆固醇的流出,降低动脉粥样硬化风险[4,13]。本研究希望找到具有上调ABCA1和SR-BI/CLA-1的活性,并且具有较好的体外抗动脉粥样硬化效果的新型化合物。
作者利用实验室前期已经构建的人ABCA1和CLA-1表达上调剂筛选模型,加药18~24 h后测定其荧光强度的变化,间接反映药物对受体基因表达的上调活性。利用这两个筛选模型,发现化合物E0869具有上调ABCA1和CLA-1活性的功能。实时荧光定量PCR和Western blot实验结果表明,在HepG2和RAW264.7细胞中,活性化合物E0869均能在一定程度上调ABCA1和SR-BI/CLA-1的mRNA以及蛋白水平,同时E0869也能上调另一介导胆固醇流出基因ABCG1的mRNA以及蛋白水平。RAW264.7细胞实验发现E0869对CD36没有明显的上调作用,这表明该化合物并没有增加巨噬细胞对mLDL的摄取,因而不会增加脂质在巨噬细胞中的积累。此外,在HepG2细胞中,还对脂肪酸合成途径中的两个关键基因FAS和SREBP-1c的mRNA以及蛋白水平进行了检测,结果表明,E0869对FAS的mRNA含量及蛋白表达水平没有上调作用,而表现了一定的抑制作用,但是当化合物E0869浓度为2.67 μmol·L-1时,SREBP-1c的mRNA含量有轻微的上调,当化合物E0869浓度为0.27 μmol·L-1时,SREBP-1c在蛋白水平上有轻微的上调。实时荧光定量PCR和Western blot实验结果说明,获得的活性化合物能使调节胆固醇的基因表达水平适度升高,而对控制脂肪生成基因表达基本没有明显上调的改变,这样就可以在一定程度上减少化合物所带来的脂肪生成。
本研究利用油红染色实验以定性判断脂质在泡沫化细胞的聚积,结果表明,E0869可浓度依赖性地改变细胞泡沫化程度。同时,利用胆固醇流出检测实验以定量判断化合物对巨噬细胞内胆固醇流出的影响,结果表明,E0869能够促进巨噬细胞内的胆固醇流出。这两个实验均表明,化合物E0869在体外具有很好的减少脂质聚积、促进胆固醇流出的活性,对动脉粥样硬化的治疗有益。
总之,通过对人ABCA1和CLA-1表达上调剂筛选模型的筛选,获得了能上调ABCA1和SR-BI/CLA-1基因表达的活性化合物E0869,证明其具有较好的体外抗动脉粥样硬化的活性,并对其抗动脉粥样硬化活性进行了初步的研究,为抗动脉粥样硬化药物进一步的机制研究以及研发奠定了基础。
| [1] | Murray CJ, Lopez AD. Global mortality, disability, and the contribution of risk factors: global burden of disease study [J]. Lancet, 1997, 349: 1436-1442. |
| [2] | Rader DJ, Hovingh GK. HDL and cardiovascular disease [J]. Lancet, 2014, 384: 618-625. |
| [3] | White CR, Garber DW, Anantharamaiah GM. Anti-inflammatory and cholesterol reducing properties of apolipoprotein mimetics: a review [J]. J Lipid Res, 2014, 55: 2007-2021. |
| [4] | Xu YN, Liu Q, Xu Y, et al. Rutaecarpine suppresses atherosclerosis in ApoE-/- mice through upregulating ABCA1 and SR-BI within RCT [J]. J Lipid Res, 2014, 55: 1634-1647. |
| [5] | Voloshyna I, Reiss AB. The ABC transporters in lipid flux and atherosclerosis [J]. Prog Lipid Res, 2011, 50: 213-224. |
| [6] | Krieger M, Kozarsky K. Influence of the HDL receptor SR-BI on atherosclerosis [J]. Curr Opin Lipidol, 1999, 10: 491-497. |
| [7] | Oram JF. Molecular basis of cholesterol homeostasis: lessons from Tangier disease and ABCA1 [J]. Trends Mol Med, 2002, 8: 168-173. |
| [8] | Kartz GA, Holme RL, Nicholson K, et al. SR-BI/CD36 chimeric receptors define extracellular sub-domains of SR-BI critical for cholesterol transport [J]. Biochemistry, 2014, 53: 6173-6182. |
| [9] | Gao J, Xu YN, Yang Y, et al. Identification of upregulators of human ATP-binding cassette transporter A1 via high-throughput screening of a synthetic and natural compound library [J]. J Biomol Screen, 2008, 13: 648-656. |
| [10] | Yang Y, Zhang ZB, Jiang W, et al. Identification of novel human high-density lipoprotein receptor up-regulators using a cell-based high-throughput screening assay [J]. J Biomol Screen, 2007, 12: 211-219. |
| [11] | Wang F, Gu HM, Zhang DW. Caveolin-1 and ATP binding cassette transporter A1 and G1-mediated cholesterol efflux [J]. Cardiovasc Hematol Disord Drug Targets, 2014, 14: 142-148. |
| [12] | Cavelier C, Lorenzi I, Rohrer L, et al. Lipid efflux by the ATP-binding cassette transporters ABCA1 and ABCG1 [J]. Biochim Biophys Acta, 2006, 1761: 655-666. |
| [13] | Xu YN, Gao J, Xu Y, et al. Screening and identification of the upregulators of ATP-binding cassette transporter A1 [J]. Acta Pharm Sin (药学学报), 2012, 47: 446-451. |
 2015, Vol. 50
2015, Vol. 50


