2. 沈阳药科大学药学院, 辽宁 沈阳 110016
2. Department of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China
聚(β-氨基酯) [poly(β-amino esters),PBAE] 是一类人工合成的聚合物载体材料,不仅其合成方法简单,合成原料价廉易得,而且PBAE的结构多样。该聚合物的结构中具有长度不同的支链或直链结构,由于合成方式及原料不同,其封端基团也不尽相同,为通过修饰末端基团扩大PBAE的应用范围提供了便利。同时,PBAE在体内可以降解成无毒的小分子产物,避免了其在体内的蓄积。最重要的是,PBAE还对pH具有敏感性,在pH 7.4的体液环境中不溶,当PBAE处于酸性环境中时,通过结构中胺基基团的质子化从而变得可溶[1]。利用PBAE酸性条件下电荷转变的特性,将肿瘤的酸性环境[2]作为信号,触发PBAE将包裹的药物释放出来,达到肿瘤细胞靶向的效果。近年来,借助PBAE的特性作为载体材料,成为国内外肿瘤靶向给药系统研究热点。
1 PBAE的结构与特点PBAE是1970年Ferruti等[3]首次合成得到的聚合物。目前,获得PBAE的主要合成方法为迈克尔加成 (Michael addition) 反应。由于合成原料用量及种类的不同造成了PBAE结构的差异。这种结构的差异使得PBAE在理化性质和功能上也有差异: ① PBAE的末端基团不同,有以酯基、胺基、含羟基或额外胺 (除β位上叔胺以外的胺基) 的亲水性胺基封端的聚合物,也有以烷基、芳香性基团或疏水性胺基封端的聚合物。Zugates等[4]已证实,不同端基封端的PBAE具有不同的基因转染效率,且以含羟基或额外胺的亲水性胺基封端的PBAE的转染效率最佳; ② 聚合物中的胺基在酸性条件下发生质子化,可以与含负离子的药物或DNA结合,使之得到有效包裹[5,6]; ③ 由于直链PBAE中只有叔胺的存在,而支链PBAE中还可能有伯氨、仲氨,在形成DNA纳米粒时,支链PBAE的包裹能力比直链PBAE强,并且支链胺基酯形成的纳米粒粒径更小[7]; ④ 支链中仲胺和叔胺的存在使之具有很高的pH缓冲能力[8]。总之,为了人们能够更合理地利用其生物学功能,发挥该聚合物材料的最大价值,对PBAE的结构和性质有待更深入研究。
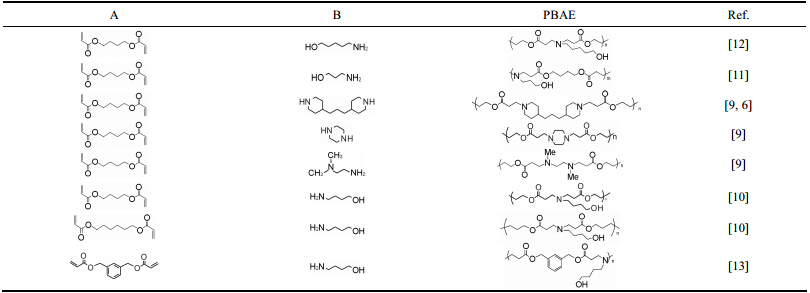
2 PBAE的合成自Ferruti等[3]首次合成骨架中含叔胺的线性聚氨基酯以来,很多材料被成功尝试用来制备PBAE。Lynn等[9]以N,N-二甲基乙二氨、哌嗪和4,4-丙基哌啶基哌啶,分别与1,4-丁二醇二丙烯酸酯反应生成相应的PBAE,应用于基因传递; Akinc等[10]使用1,4-丁二醇二丙烯酸酯和1,6-己二醇二丙烯酸酯分别与1-氨基丁醇反应,同时改变氨/丙烯酸酯的化学计量比,合成了12种以胺基或丙烯酸酯为端基的PBAE,研究不同分子量的PBAE对基因转染行为的影响,进而对PBAE进行优化; 2012年Kim等[11]以1,4-丁二醇二丙烯酸酯和3-氨基-1-丙醇反应制备生物素结合的PBAE聚合物胶束,用于药物载体的研究; 同年,Gu等[12]用1,4-丁二醇二丙烯酸酯和5-氨基-1-戊醇反应生成PBAE,研究基因转染行为; 2014年Deng等[13]用合成的 (1,3-亚苯基) 双 (亚甲基) 二丙烯酸与1-氨基丁醇反应合成PBAE,旨在提高PBAE的降解速率和降低载体的毒性。上述PBAE常用合成原料及产物形式见表 1。
|
|
Table 1 The form of the synthetic material (A and B) and the products (PBAE). PBAE: Poly(β-amino esters) |
PBAE结构中存在大量的酯键,材料可在体内水解为小分子物质后排出体外。其作为靶向递药系统材料使用,具有一定的生物安全性。Wu等[14]使用四乙烯五胺和乙二醇二丙烯酸酯反应合成PBAE后,对PBAE的降解进行了研究。通过PBAE水溶液pH值、1H NMR中基团特征峰的变化和黏度3个指标评价PBAE降解情况。结果显示,降解过程持续48 h,不断降解的PBAE溶液黏度和pH均随时间的延长而 逐渐降低,1H NMR显示酯键从有到无。结果表明,PBAE在体内降解速度由快到慢且主要发生酯键的水解。另外,Potineni等[15]在载紫杉醇的PBAE纳米粒的降解研究中发现,6天后载体材料降解了近85%。大量实验表明,PBAE作为靶向递药载体使用时,细胞毒性较小。例如,Shen等[16]将制备的空白聚合物载体PBAE-PEG、喜树碱 (CPT) 药物溶液和载有CPT的PBAE-PEG纳米粒,分别对SKOV-3卵巢癌细胞进行毒性测试,对比发现,空白聚合物载体对细胞无任何毒性。PBAE不仅细胞毒性小,而且作为肿瘤靶向递药材料递送进入细胞内时,溶酶体中酸性环境及存在的大量水解酶也可加速PBAE的降解[17]。
4 PBAE作为肿瘤靶向递药系统的应用形式 4.1 PBAE嵌段聚合物的靶向递药系统PBAE是疏水性聚合物,为了更好地利用这一性质,常在PBAE的一端或两端连接其他聚合物。最常用的是将亲水性的PEG与pH敏感的疏水性PBAE相连,在纳米粒表面形成亲水性的保护层,使得纳米粒与血液中调理蛋白的空间位阻有所增加,进而减小纳米粒被调理素识别的几率,也使得PBAE因质子化所携带的正电荷部分被屏蔽,进而减少外界带负电生物分子的干扰作用。PBAE与PEG连接后,增强了PBAE在血液中的稳定性,进而延长其在血液中的循环时间。
4.1.1 二嵌段聚合物的靶向递药系统二嵌段聚合物研究较多的是将聚乙二醇单甲醚 (MPEG) 与PBAE进行连接,制备两亲性的聚合物来构建递药系统。一般而言,将PBAE与PEG进行连接有两种方式: ① 在PEG的一端连上羧基,再与结构中含羟基的PBAE发生酯化反应进行二者连接; ② 将PEG两端丙烯酰化,再与PBAE结构中的伯胺或仲胺相连使两种聚合物得以连接。Gao等[18]用上述②方式先将MPEG丙烯酰化,然后与PBAE的合成原料1,6-己二醇二丙烯酸酯和4,4-丙基哌啶基哌啶反应来合成MPEG-PBAE二嵌段聚合物,制备封装人血清白蛋白 (HSA) 的聚合物胶束。当pH从7.8下降到6.2时,封装HSA的聚合物胶束从中性变成了正电性,此时胶束结构被破坏,HSA释放出来。研究发现,转变为正电性的聚合物胶束能够提高HSA的输送效率并且促进载药胶束对组织的靶向性,即对癌变组织和缺血组织具有靶向性。Min等[19]也用同样的合成方法得到MPEG-PBAE二嵌段聚合物,研究抗癌药物CPT聚合物胶束的释药行为和抗癌特性,结果显示该二嵌段聚合物具有靶向输送CPT的能力。
4.1.2 五嵌段聚合物的靶向递药系统近年来,在响应单一刺激而发生相转变的基础上,开发对两种或两种以上外界刺激产生多重响应的凝胶系统活跃起来。Huynh等[5]利用PBAE结合对温度敏感的三嵌段聚合物聚己内酯-聚乙二醇-聚己内酯 (PCL-PEG- PCL) 来制备pH/温度敏感型的可降解的注射用五嵌段聚合物PBAE-PCL-PEG-PCL-PBAE亲水凝胶。首先,PEG与己内酯反应生成HO-PCL-PEG-PCL-OH,然后与丙烯酰氯共轭加成,最后将共轭加成产物与PBAE的合成原料1,4-丁二醇二丙烯酸酯和4,4-丙基哌啶基哌啶反应,合成此五嵌段聚合物。将该聚合物包封阴离子药物胰岛素后形成的纳米粒注射到体内,PBAE可解离出氨基,使凝胶网络中增加了离子,进而离子强度变化,导致凝胶体积变化,释放药物。因此,胰岛素的释放在扩散机制的基础上增加了化学控释作用。药物动力学研究表明,五嵌段聚合物与三嵌段聚合物PCL-PEG-PCL相比,胰岛素的药物动力学参数有显著性差异。随后,Huynh等[20]用同样的方法合成了一系列PBAE-PCL-PEG-PCL-PBAE五嵌段聚合物凝胶,结果表明: PCL/PEG的比例、PBAE的分子量、聚合物的浓度及PEG链的长度等都是影响凝胶性质的因素。该实验结果为其他研究聚合物的合成与选择提供了借鉴,pH值响应性凝胶可以对病灶周围的温度和化学环境等异常变化自动感知,调节和控制药物的释放。
4.2 接枝聚合物的靶向递药系统Kang等[21]在不使用有机溶剂的情况下合成了PBAE-g-PCL-PEG二嵌段接枝聚合物。首先合成PEG-PCL二嵌段聚合物,接着此聚合物与丁二酸酐反应,在PCL的另一端连上羧基,进而与PBAE结构上的羟基反应,最终将PBAE接枝到PEG-PCL上合成PBAE-g-PCL-PEG二嵌段接枝聚合物。基于此,可降解的、对pH敏感的二嵌段接枝聚合物制备了聚合物囊泡,这种高效的、pH敏感的靶向药物递送系统,细胞毒性低,在微酸性环境下能够快速释放阿霉素。
4.3 无规则聚合物的靶向递药系统Zhang等[1]合成了一系列具有不同PLA/PBAE比例的MPEG-b-(PLA-co-PBAE) 二嵌段无规则聚合物。这些两亲性的聚合物胶束在低浓度的水溶液中显示出自组装性,由于叔胺的pKb为6.5,所以对pH敏 感的PBAE结构在pH < 6.5时通过胺基基团的质子 化变得可溶。实验证实,对pH敏感的MPEG-b-(PLA- co-PBAE) 胶束作为疏水性药物载体在癌症靶向治疗方面具有广阔的应用前景。以上一系列二嵌段无规则聚合物都是利用PBAE的阳离子特性、疏水特性和对pH敏感的特性来形成载药的复合物,有效地将药物输送到肿瘤组织及肿瘤细胞从而增强药物的抗癌作用。
4.4 PBAE经修饰后的靶向递药系统为了进一步强化PBAE的肿瘤递药靶向性,常 常对其进行修饰以改善递药系统的表面形态、电荷和尺寸等。有时,为了便于追踪药物在体内的行踪或检测药物释放所引起的生理变化等加入一些辅助物质,也会在聚合物胶束的表面连接一些基团或配体,如叶酸[22]、糖类[23]、生物素[24]或多肽类[25]等,以到达特殊的肿瘤靶组织。生物素作为肿瘤靶向的配体应用最为广泛。Kim等[11]制备了用胆固醇氯甲酸酯修饰的、生物素 (Biotin) 结合的MPEG-接枝-PBAE (Biotin- PBAE-g-PEG-ch) 聚合物胶束,研究结果表明,生物素随着pH的变化暴露到胶束的表面,作为一种配体促进受体介导的细胞内吞作用,在肿瘤细胞中能够更加有效地释放阿霉素,增加抗癌药物在肿瘤部位或肿瘤细胞内的积累以减少药物在正常组织中的分布,证实了该聚合物胶束递药的靶向性作用。
Wang等[26]研究了PBAE-接枝-磷酸胆碱 (PBAE- g-ADPC) 聚合物胶束,包封阿霉素的pH触发的抗癌药物递送系统。ADPC是细胞膜的重要组成成分,具有良好的亲水性,对聚合物修饰后能够防止胶束发生聚集,促进胶束溶解,还能保护胶束免受网状内皮系统的清除。在pH < 6.5的肿瘤组织及pH更低的肿瘤细胞内,聚合物胶束能够快速释放药物。ADPC对PBAE的修饰作用使得该聚合物胶束在血液中的循环时间有所增加,并且提高了细胞渗透率和药物在肿瘤部位的积累 (EPR效应,即增强渗透滞留效应)。
5 PBAE递送不同抗肿瘤药物的靶向递药系统 5.1 基因药物的肿瘤靶向递药系统王江峰等[27]对PBAE载基因纳米粒进行了研究,考察其在HEK293细胞中的转染效率。首先用1,4-丁二醇二丙烯酸酯和5-氨基-1-戊醇反应制备线性的PBAE,将其直接和质粒DNA (pDNA) 溶液混合后进行基因转染。当PBAE/pDNA质量比为200∶1时,其转染效率高于对照组PEI聚乙烯亚氨 (PEI)/pDNA,细胞毒性小,容易降解。另外,Jere等[28]对PBAE作为si/shRNA的递送载体进行了相关研究。PBAE运载含有增强型绿色荧光蛋白基因 (EGFP) 的质粒 (PBAE-siGFP),通过EGFP表达来报告基因的表达情况; 运载含蛋白激酶B (Akt1) 的质粒 (PBAE-shAkt),使Akt1基因沉默,从而使肿瘤细胞凋亡,同时用通常使用的聚合物载体PEI25K (聚乙烯亚氨,相对分子质量为25 000) 制备相应的载药系统PEI25K- siGFP和PEI25K-Akt1。在递送效率和毒性方面,与PEI25K-siGFP相比,PBAE-siGFP的表达效率高且安全性更好; 与PEI25K-shAkt1相比,PBAE-shAkt系统在癌细胞的增殖、恶化和转移方面有很大程度的改善。上述实验证实,在RNA干扰研究领域里,PBAE将会是PEI25K的一种理想的替代载体,同时克服PEI在基因药物治疗中传输效率低、细胞毒性大的缺点[29]。
5.2 小分子抗癌药物的肿瘤靶向递药系统Potineni等[15]用聚氧乙烯 (PEO) 修饰PBAE制备具有控释作用的纳米粒,用于递送紫杉醇到达肿瘤部位。在乙醇水溶液中通过溶剂置换法制备该聚 合物载药纳米粒。PEO修饰的聚合物载体对紫杉醇具有良好的包封能力,且包封率高达97%,药物在 5天后释放完全,控释作用明显。这种纳米粒通过递送紫杉醇药物到达实体肿瘤以提高治疗效果。随后,Lundberg等[30]将脂溶性的紫杉醇前体药物——紫杉醇油酸包封到PBAE中制成纳米粒,用磷脂酰胆碱、PEG-二棕榈酰磷脂酰乙醇胺和Synperonic® F 108 (一种非离子表面活性剂) 混合物来稳定纳米粒,研究其在抗癌方面的应用。所制备的纳米粒粒径约为70 nm,并且在4 ℃环境中性质稳定。当pH低于6.5时,PBAE在癌细胞酸性的微环境中能快速溶解并释放药物。PBAE紫杉醇油酸纳米粒与不具有pH敏感的PCL紫杉醇油酸纳米粒相比,体外细胞摄取和释药结果有显著性差异,而两种纳米粒的细胞毒性几乎没有差别。因此用PBAE载入紫杉醇的前体药物用于抗癌研究是可行的,不仅能克服紫杉醇药物水溶性差和毒副作用强的缺点,还能提高药物在肿瘤细胞中的分布。阿霉素是抗癌药物中最为常用的抗癌药物之一,但是其副作用强,全身作用明显。近年来,许多科研工作者对PBAE包封阿霉素进行了相关研究[11,21,31],将阿霉素更多的递送到肿瘤部位以减少对正常组织的损害,降低阿霉素的毒副作用。
5.3 蛋白及多肽类药物的肿瘤靶向递药系统蛋白质、多肽类药物因其具有生物活性强、作用靶点明确、安全性好、毒性低和成本低等优点在临床上得到广泛的应用。目前应用形式主要以注射剂和冻干粉针剂为主,同时,各种新剂型的研究也在开展,旨在改善蛋白质多肽类药物的稳定性差、半衰期短和应用不便等问题。Huynh等[32]利用聚 (β-氨基酯聚氨酯) (PBAEU) 与不同分子量的PEG制备了一系列对pH和温度双重敏感的PAEU-PEG-PAEU三嵌段聚 合物水凝胶,将人类生长激素 (hGH) 载入其中,载hGH的该聚合物水凝胶在体内和体外释放研究中均显示了良好的控释作用,并且没有突释现象。证实了PBAE对蛋白质的递送能力。Gao等[18]制备的MPEG- PBAE二嵌段聚合物载HSA胶束,一方面保护了HSA不被体液破坏,另一方面达到了肿瘤靶向递药的作用,更好地发挥了药效。另外,Huynh等[5,6]对PBAE-PCL-PEG-PCL-PBAE包载胰岛素亲水凝胶的肿瘤靶向作用研究也同样说明了PBAE作为蛋白多肽类药物载体的重大应用价值。
6 展望PBAE具有生物可降解性、疏水性、低细胞毒性、化学修饰多样性、结构多样性和衍生物多样性等特点,应用范围广。利用聚合物的正电性,与带负电荷的质粒DNA通过静电作用紧密结合,形成聚合物与DNA的复合物作为非病毒载体应用于基因转染,转染效率高、无免疫原性; 利用PBAE的网络结构作为组织支架满足生物医学应用的需要; 作为递送药物的载体,协助药物到达肿瘤部位,提高抗癌药物的药效等。但是,目前合成PBAE及其衍生物的过程中常常使用有机溶剂如二甲基亚砜、二氯甲烷和4-二甲氨基吡啶等,对环境和人体均具有危害性。由于PBAE的结构多样性,从众多的聚合物中筛选出高效低毒的聚合物比较困难,寻找通过修饰增强其递药靶向性的PBAE衍生物工作量大。此外,利用PBAE在一定pH范围内发生质子化的基础上,考虑对聚合物进行修饰或对肿瘤细胞位点的结合作用合成PBAE衍生物,形成双重靶向作用,开发出更为精准的靶向递药载体显得非常重要。
| [1] | Zhang CY, Yang YQ, Huang TX, et al. Self-assembled pH-responsive MPEG-b-(PLA-co-PBAE) block copolymer micelles for anticancer drug delivery [J]. Biomaterials, 2012, 33: 6273-6283. |
| [2] | Itahana Y, Han R, Barbier S, et al. The uric acid transporter SLC2A9 is a direct target gene of the tumor suppressor p53 contributing to antioxidant defense [J]. Oncogene, 2014, doi: 10.1038/onc.2014.119. |
| [3] | Danusso F, Ferruti P. Synthesis of tertiary amine polymers [J]. Polymer, 1970, 11: 88-113. |
| [4] | Zugates GT, Tedford NC, Zumbuehl A, et al. Gene delivery properties of end-modified poly(β-amino ester)s [J]. Bioconjug Chem, 2007, 18: 1887-1896. |
| [5] | Huynh DP, Nguyen MK, Pi BS, et al. Functionalized injectable hydrogels for controlled insulin delivery [J]. Biomaterials, 2008, 29: 2527-2534. |
| [6] | Fields RJ, Cheng CJ, Quijano E, et al. Surface modified poly(β-amino ester)-containing nanoparticles for plasmid DNA delivery [J]. J Control Release, 2012, 164: 41-48. |
| [7] | Wang JF, Lu Y, Zhong YQ. Research on poly (amino ester) as the gene vector [J]. J Pharm Pract (药学实践杂志), 2011, 29: 165-168. |
| [8] | Guk K, Lim H, Kim B, et al. Acid-cleavable ketal containing poly(β-amino ester) for enhanced siRNA delivery [J]. Int J Pharm, 2013, 453: 541-550. |
| [9] | Lynn DM, Langer R. Degradable poly(β-amino esters): synthesis, characterization, and self-assembly with plasmid DNA [J]. J Am Chem Soc, 2000, 122: 10761-10768. |
| [10] | Akinc A, Anderson DG, Lynn DM. Synthesis of poly(β-amino ester) s optimized for highly effective gene delivery [J]. Bioconjug Chem, 2003, 14: 979-988. |
| [11] | Kim JH, Li Y, Kim MS, et al. Synthesis and evaluation of biotin-conjugated pH-responsive polymeric micelles as drug carriers [J]. Int J Pharm, 2012, 427: 435-442. |
| [12] | Gu J, Wang X, Jiang X, et al. Self-assembled carboxymethyl poly(L-histidine) coated poly(β-amino ester)/DNA complexes for gene transfection [J]. Biomaterials, 2012, 33: 644-658. |
| [13] | Deng X, Zheng N, Song Z, et al. Trigger-responsive, fast-degradable poly (β-amino ester) s for enhanced DNA unpackaging and reduced toxicity [J]. Biomaterials, 2014, 35: 5006-5015. |
| [14] | Wu C, Hao J, Deng X. A novel degradable poly(β-amino ester) and its nano-complex with poly (acrylic acid) [J]. Polymer, 2007, 48: 6272-6285. |
| [15] | Potineni A, Lynn DM, Langer R, et al. Poly (ethylene oxide)-modified poly(β-amino ester) nanoparticles as a pH-sensitive biodegradable system for paclitaxel delivery [J]. J Control Release, 2003, 86: 223-234. |
| [16] | Shen Y, Tang H, Zhan Y, et al. Degradable poly(β-amino ester) nanoparticles for cancer cytoplasmic drug delivery [J]. Nanomedicine, 2009, 5: 192-201. |
| [17] | Fang C, Kievit FM, Veiseh O, et al. Fabrication of magnetic nanoparticles with controllable drug loading and release through a simple assembly approach [J]. J Control Release, 2012, 162: 233-241. |
| [18] | Gao GH, Park MJ, Li Y, et al. The use of pH-sensitive positively charged polymeric micelles for protein delivery [J]. Biomaterials, 2012, 33: 9157-9164. |
| [19] | Min KH, Kim JH, Bae SM, et al. Tumoral acidic pHresponsive MPEG-poly (β-amino ester) polymeric micelles for cancer targeting therapy [J]. J Control Release, 2010, 144: 259-266. |
| [20] | Huynh DP, Nguyen MK, Kim BS, et al. Molecular design of novel pH/temperature-sensitive hydrogels [J]. Polymer, 2009, 50: 2565-2571. |
| [21] | Kang SW, Li Y, Park JH, et al. pH-triggered unimer/vesicle-transformable and biodegradable polymersomes based on PEG-b-PCL-grafted poly (β-amino ester) for anti-cancer drug delivery [J]. Polymer, 2013, 54: 102-110. |
| [22] | Zhao MX, Li Y, Whang CJ. Synthesis and bioactivity of the folate receptor targeted γ-cyclodextrin-folate inclusion-coated CdSe/ZnS quantum dots [J]. Acta Pharm Sin (药学学报), 2013, 48: 566-572. |
| [23] | Freichels H, Auzély-Velty R, Lecomte P, et al. Easy functionalization of amphiphilic poly (ethylene oxide)-b-poly (ε-caprolactone) copolymer micelles with unprotected sugar: synthesis and recognition by lectins [J]. Polym Chem, 2012, 3: 1436-1445. |
| [24] | Heo DN, Yang DH, Moon HJ, et al. Gold nanoparticles surface-functionalized with paclitaxel drug and biotin receptor as theranostic agents for cancer therapy [J]. Biomaterials, 2012, 33: 856-866. |
| [25] | Wu XL, Kim JH, Koo H, et al. Tumor-targeting peptide conjugated pH-responsive micelles as a potential drug carrier for cancer therapy [J]. Bioconjug Chem, 2010, 21: 208-213. |
| [26] | Wang H, Xu F, Wang Y, et al. pH-responsive and biodegradeable polymeric micelles based on poly(β-amino ester)-graftphosphorylcholine for doxorubicin delivery [J]. Polym Chem, 2013, 4: 301-3019. |
| [27] | Wang JF, Lu Y, Huang JB, et al. Polymers poly(β-amino esters) nanoparticles for gene delivery [J]. Acad J Sec Mil Med Univ (第二军医大学学报), 2011, 32: 473-476. |
| [28] | Jere D, Xu CX, Arote R, et al. Poly(β-amino ester) as a carrier for si/shRNA delivery in lung cancer cells [J]. Biomaterials, 2008, 29: 2535-2547. |
| [29] | Huang W, Lü M, Gao ZH, et al. Small interfering RNA delivery mediated by MPEG-PCL-g-PEI polymer nanoparticles [J]. Acta Pharm Sin (药学学报), 2011, 46: 344-349. |
| [30] | Lundberg BB. Preparation and characterization of polymeric pH-sensitive STEALTH® nanoparticles for tumor delivery of a lipophilic prodrug of paclitaxel [J]. Int J Pharm, 2011, 408: 208-212. |
| [31] | Huynh CT, Nguyen MK, Kim JH, et al. Sustained delivery of doxorubicin using biodegradable pH/temperature-sensitive poly(ethylene glycol)-poly(β-amino ester urethane) multiblock copolymer hydrogels [J]. Soft Matter, 2011, 7: 4974-4982. |
| [32] | Huynh CT, Kang SW, Li Y, et al. Controlled release of human growth hormone from a biodegradable pH/temperaturesensitive hydrogel system [J]. Soft Matter, 2011, 7: 8984-8990. |
 2015, Vol. 50
2015, Vol. 50