转化生长因子-β (transforming growth factor-β,TGF-β) 是1978年DeLarco与Todaro从培养小鼠肉瘤病毒细胞株的培养基中鉴定出来的,因其具有细胞转化的特性而命名为转化生长因子。研究发现,TGF-β作为一种肿瘤促进因子,刺激组织纤维化和细胞外基质沉积,扰乱免疫功能,刺激血管生成和促进上皮-间质转化。在胃癌、结肠癌、肝癌等癌症患者中,TGF-β表达水平与肿瘤细胞转移能力以及病人的死亡率呈正相关。本文对近年报道的TGF-β抑制剂进行综述,希望对今后的TGF-β抑制剂的研究提供参考。
1 转化生长因子-βTGF-β属于一类促进细胞生长和转化的细胞因子超家族[1]。目前TGF-β共发现5种亚型,其中在哺乳动物体内发现3种: TGF-β1、TGF-β2和TGF-β3。另外两种亚型TGF-β4和TGF-β5分别在鸟类和两栖类动物体内发现,其生物学功能不明。TGF-β在体内以多种状态存在,包括功能静止态和生物活性态。自然状态下组织细胞产生的TGF-β均处于功能静止状态,在酸性环境下如创伤后等,TGF-β可以在蛋白酶的作用下转为生物活性态发挥生理功能。
TGF-β广泛存在于各种正常细胞及转化细胞中,如血小板、单核细胞、巨噬细胞、淋巴细胞及成纤维细胞等。几乎所有的细胞都含有TGF-β的受体。TGF-β有3个主要的细胞受体[2]: I型、II型、III型受体。I型和II型受体是跨膜丝氨酸/苏氨酸激酶,二者同时传导信息,III型受体不传递信息[3],功能是主要将TGF-β传递给R II受体,通过为受体II提供配体而间接地影响信号传导。
TGF-β的信号传导通路有两种: TGF-β-Smad信号通路和Non-Smad信号通路。Smad蛋白家族是近年来发现的细胞内信号转导蛋白,已知人体内有8种Smad蛋白分子,Smad信号通路是TGF-β产生基因效应的主要途径,也与其他信号通路存在相互作用。大分子无活性的蛋白前体形式的TGF-β经过激活后,TGF-β在细胞表面与II型受体 (TβR II) 和I型受体 (TβR I,又称ALK5) 形成一个双二聚体受体复合物,细胞膜表面III型受体 (TβR II) 也参与了这个过程,起到一定的辅助作用。II型受体磷酸化并激活I型 受体,接着I型受体磷酸化其连接的Smad蛋白分子 (Smad2/3) 并释放到胞浆中,与Smad4蛋白形成复合体转移到细胞核内,结合不同的转录因子和转录共激活剂或转录共抑制剂,来调节TGF-β靶基因的转录,产生生物效应 (图 1)[4]。TGF-β其他的信号通路包括丝裂原活化蛋白激酶 (mitogen-actived protein kinase,MAPK) 通路、细胞外信号调节激酶(ERK) 通路、JNK、P38、PI3K激酶、PP2A磷酸酶和Rho家族成员等[5]。
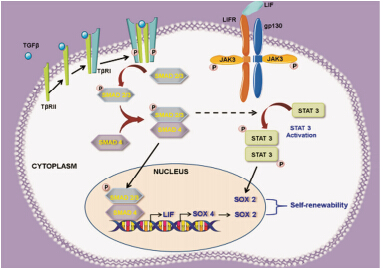
|
Figure 1 TGF-β-Smad signaling pathway |
自了解TGF-β表达的信号通路以来,科研人员已经研究和发现了许多TGF-β抑制剂,并且探讨了这些抑制剂的作用机制,主要概括有以下几个方面: ① 抑制TGF-β及其受体的表达; ② 阻断TGF-β与受体的结合; ③ 干扰受体激酶信号传递。TGF-β抑制剂通过阻断TGF-β的表达,能够减少肿瘤的转移,抑制肿瘤的生长和侵袭。虽然存在疼痛、疲劳、恶心、头痛、咳嗽及虚弱等不良反应,但TGF-β抑制剂在肿瘤的治疗等多个领域具有广泛应用前景[6]。本文将近几年报道的小分子TGF-β抑制剂按结构分类进行介绍: 含氮五元芳杂环类、咪唑并噻二唑类、喹啉类似物、香豆素酰胺衍生物及吡非尼酮类似物。
2.1 含氮五元芳杂环类含氮五元芳杂环类化合物包括: 咪唑、噻唑、吡唑为母核的化合物,在近10年对TGF-β抑制剂的研究中,此类化合物的研究最热门。Laping等[7]报道了一系列以咪唑环为核心环系的化合物 (图 2),活性较好的化合物是1 (SB-43154212),其选择性抑制Smad3的磷酸化和ALK5,IC50值为 90 nmol·L-1。Amada等[8, 9]通过对1环上的三部分取代基进行改造,合成了新型的含有4-噻唑取代结构的咪唑类化合物,活性都较1高,其中2的ALK5 IC50值为8.2 nmol·L-1,且水溶性较1提高100倍以上。之后对2进行改造得到3,除了维持ALK5的抑制活性和选择性外 (IC50值为5.5 nmol·L-1),对大鼠表皮Smad2磷酸化也有抑制作用,可能可以用于改善脱发。Bonafoux等[10]合成了一些列2-氨基咪唑类似物,也有较好的TGF-β抑制活性。其中4的Ki值为2.95 nmol·L-1,在动物体内半衰期t1/2达到7.1 h,具有较长时间的药效。
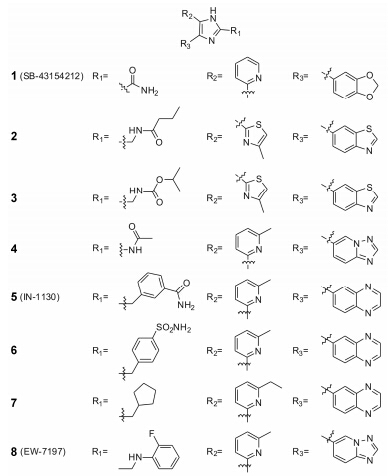
|
Figure 2 Structures of imidazol analogues |
5 (IN-1130) 是由Kim课题组[11]设计合成的能 够选择性地抑制ALK5的高效抑制剂,对缓解肝、肾纤维化具有一定的功效。该课题组运用电子等排原 理将IN-1130的甲酰胺结构用磺酰胺基取代,改变吡啶环上甲基取代和咪唑2位的碳链长度合成了一系列化合物。其中化合物6、7具有较好的抑制活性,对P3TP-luciferase (荧光素酶,一种结构和ALK5相似的蛋白酶) 抑制率分别为93%、94%。
Jin等[12]在咪唑环2位取代基的苯环上用不同的取代基取代得到一系列化合物。这些化合物对ALK5的抑制活性都在纳摩尔级别,其中活性较高的8 (EW-7197) 的IC50值为8 nmol·L-1。在10 mg·kg-1的作用剂量下,其盐酸盐在动物体内的半衰期为2.5 h。蛋白水平的抑制活性表明,其在0.1 μmol·L-1剂量下,对ALK5和ALK4具有较高的选择性。8的I期临床研究正在美国进行 (IND119528)。
Jin等[13, 14]将所设计的一系列化合物作用于P3TP-luciferase,发现两种选择性极高的化合物9、10 (图 3),对ALK5的IC50值分别为18 nmol·L-1和13 nmol·L-1。选择性参数 (IC50 of P3TP-luciferase/IC50 of ALK5) 分别为284和 > 77,是同类结构化合物的几倍甚至几十倍 (IN-1130为28),且对ALK5的抑制活性相当。
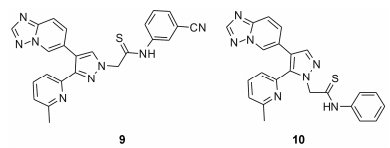
|
Figure 3 Structures of pyrazole analogs |
Gellibert等[15]设计合成了一系列吡唑环上进行双吡啶环取代的化合物,通过活性筛选得到11 (GW- 788388,图 4),ALK5的IC50值为446 nmol·L-1,细胞水平上的抑制活性为 (93 ± 45) nmol·L-1。动物实验中,每两天1 mg·kg-1剂量作用下,使胶原AI的表达下降80%。在嘌呤霉素引起的肾病模型中,每日10 mg·kg-1的剂量作用下,能够显著减少胶原AI的mRNA表达,从而减缓肾纤维化。Ciayadi等[16]针对芳环上取代基团的改造来寻找具有更好药代动力学性质的吡啶类ALK5抑制剂,筛选得到12、13,其对ALK5的IC50值分别为11 nmol·L-1和19 nmol·L-1,且同时对Activin A (促进TGF-β I型和Ⅱ型受体结合的信号蛋白) 有抑制作用,IC50值分别为18 nmol·L-1和46 nmol·L-1,均比11抑制活性好。
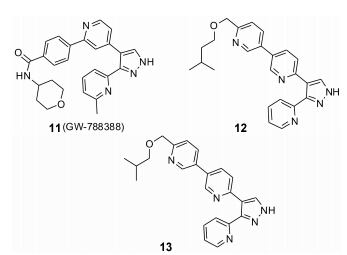
|
Figure 4 Structures of GW-788388 and its derivatives |
Dewang等[17]合成的含有硫代酰胺结构的化合物中,14、15 (图 5) 具有较好活性,对ALK5的抑制率分别为96% 和95%。16 (R-268712)[18]是一种口服有效的TGF-β I型受体抑制剂,在肾炎模型中,能有效地阻止肾小球硬化,ALK5的IC50值为2.5 nmol·L-1,比1活性提高40倍。

|
Figure 5 Structures of pyrazole analogs containing thioamide structure |
Wan等[19, 20]报道了四氢吡咯并吡唑类化合物,17 (LY-2109761) (图 6) 通过抑制ALK5能够抑制骨髓瘤细胞的迁移、侵入。18 (LY-2157299) 是一种有效的ALK5抑制剂,现已进入II期临床研究。Li等[21]合成了一系列此类化合物,其中19对ALK5的IC50值为0.047 μmol·L-1,对Smad2的磷酸化也起到抑制作用 (65% 抑制率,口服50 mg·kg-1)。

|
Figure 6 Structures of tetrahydropyrrolo pyrazole analogs |
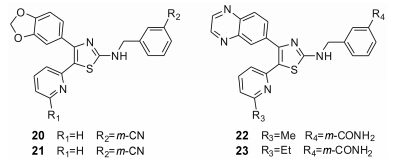
Kim等[22]合成了一系列以噻唑环为中心环系的化合物作为ALK5抑制剂。在对P3TP-luciferase抑制活性实验中,大部分噻唑结构化合物的酶抑制率都在90% 以上,如20~23 (图 7),酶活性抑制率分别为92%、95%、98%、98%。SAR表明: 2位苯环上的取代基,间位取代活性高于对位取代化合物,吡啶环上甲基取代活性优于其他取代基。
|
Figure 7 Structures of thiazole derivatives |
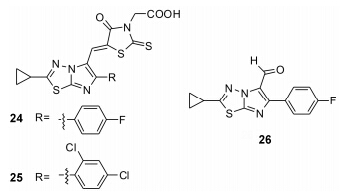
Patel等[23]设计合成了一系列有ALK5抑制活性的咪唑并噻二唑衍生物 (图 8)。初步的构效关系研究表明: 2位环丙基取代时,活性较好; 5位用饶丹宁乙酸取代比用甲酰基衍生物取代活性好。24、25的ALK5 IC50值分别为1.2 nmol·L-1和19 nmol·L-1; 6位苯环上有一个吸电子取代时活性较好,有两个或多个吸电子取代时活性下降,如26,其ALK5 IC50值为30 nmol·L-1。为了进一步评价这一系列化合物的ALK5抑制活性,Patel等进行了细胞内TGF-β诱导的Smad2/3磷酸化的活性抑制实验,24在10 μmol·L-1时,对P38a激酶的活性抑制率为91%。
|
Figure 8 Structures of imidazole-thiadiazole derivatives |
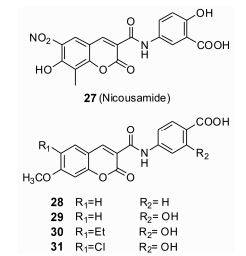
硝克柳胺 (nicousamide,27,图 9) 是一个具有明确肾功能不全治疗作用、毒性低、活性高、作用机制新的香豆素类衍生物。体内和体外实验结果表明[24]: nicousamide通过抑制TGF-β II受体及其下游蛋白的磷酸化,从而抑制或减缓肾脏纤维化的进程。Nicousamide含有5-氨基水杨酸结构,Koelink等[25]报道了5-氨基水杨酸在大肠癌细胞中的转移活性。Xu等[26]合成了一系列香豆素酰胺衍生物。其中活性较好的有28~31,在对水貂肺上皮细胞的生长抑制活性实验中表现较好的活性,TGF-β I型受体的IC50值分别为13.8、7.8、8.5、5.3 μg·mL-1。
|
Figure 9 Structures of coumarin derivative |
2011年Warnac公司研发的Esbriet (吡非尼酮,pirfenidone,32,图 10) 在欧洲批准上市,用于治疗成人轻-重度特异性肺纤维化。吡非尼酮是第一个用于治疗特发性肺纤维化药物,通过阻断TGF-β下游P38-MAPK信号通路来改变胶原合成和积累,抑制细胞外基质增殖和表达,具有抗炎、抗氧化和抗纤维化的作用[27]。Ma等[28]以吡非尼酮为先导化合物,在苯环对位进行改造合成一系列吡啶酮类化合物。其中对P38抑制活性较好的有33、34,P38的IC50值分别为4.07 μmol·L-1和5.21 μmol·L-1。

|
Figure 10 Structures of pirfenidone derivatives |
Gellibert等[29]设计合成了一系列喹唑啉衍生物以期发现高选择性的ALK5抑制剂。对该类化合物的改造中发现,将喹唑啉2位以吡啶或6-甲基吡啶取代时,ALK5的抑制活性明显提高,可能是因为6-甲基吡啶基可以与含有Ser280的ALK5的“特异性口袋”Ser280发生氢键结合,如35 (图 11)。而P38α相对应的残基为Thr106,与36中的苯环发

|
Figure 11 Structures of quinazoline derivatives |
生疏水结合,因此对P38α的抑制活性较好。35、36对ALK5的IC50值分别为0.025 μmol·L-1和0.194 μmol·L-1,对P38α的抑制活性IC50值分别为6.72 μmol·L-1和1.27 μmol·L-1。该课题组在35结构的基础上在喹唑啉环4位氨基上用不同的取代基取代得到一系列化合物,通过比较生物活性筛选出37,对ALK5的抑制活性较好,与35相当[30]。
3 小结与展望TGF-β在体内参与许多生理过程,如胚胎发育、伤口愈合、趋化作用和细胞周期调控等,阻断TGF-β受体或下游信号通路能够对很多疾病起到治疗效果,如癌症、肾纤维化、肝纤维化等。因此设计高效低毒的小分子TGF-β抑制剂近几年来已经成为热点,也取得了一定的进展。吡非尼酮是唯一一个已经上市的TGF-β抑制剂,是第一个用于治疗特发性肺纤维化药物。在研药物中,EW-7197、LY-2157299都已经进入了临床研究,还有不少结构类型的化合物对酶的抑制活性达到纳摩尔级别,具有进一步开发价值。天然产物中,结构的改造研究较少,因此也有很大的发展前景。随着对TGF-β研究的深入,相信在不久的将来会有更多高效低毒的TGF-β抑制剂进入临床研究和上市,并且造福于人类。
| [1] | Xu WH, Sheng YH. Study of TGF-β inhibitor and its application in ophthalmology [J]. Int J Ophthalmol (国际眼科杂志), 2009, 9: 53-538. |
| [2] | Pardali K, Moustakas A. Actions of TGF-β as tumor suppressor and pro-metastatic factor in human cancer [J]. Biochim Biophys Acta, 2007, 1775: 21-62. |
| [3] | Gatza CE, Holtzhausen A, Kirkbride KC, et al. Type III TGF-β receptor enhances colon cancer cell migration and anchorage-independent growth [J]. Neoplasia, 2011, 13: 758-770. |
| [4] | Joseph JV, Balasubramaniyan V, Walenkamp A, et al. TGF-β as a therapeutic target in high grade gliomas-promises and challenges [J]. Biochem Pharmacol, 2013, 85: 478-485. |
| [5] | Derynck R, Zhang YE. Smad-dependent and Smad-independent pathways in TGF-β family signaling [J]. Nature, 2003, 425: 577-584. |
| [6] | Wu HM, Li XJ. Advances on the effect of transforming growth factor-β on tumor growth and metastasis and its inhibitors [J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2013, 27: 1020-1023. |
| [7] | Laping NJ, Grygielko E, Mathur A, et al. Inhibition of transforming growth factor (TGF)-β1-induced extracellular matrix with a novel inhibitor of the TGF-β type I receptor kinase activity: SB-431542 [J]. Mol Pharmacol, 2002, 62: 58-64. |
| [8] | Amada H, Sekiguchi Y, Ono N, et al. Design, synthesis, and evaluation of novel 4-thiazolylimidazoles as inhibitors of transforming growth factor-β type I receptor kinase [J]. Bioorg Med Chem Lett, 2012, 22: 2024-2029. |
| [9] | Amada H, Sekiguchi Y, Ono N, et al. 5-(1, 3-Benzothiazol-6-yl)-4-(4-methyl-1, 3-thiazol-2-yl)-1H-imidazole derivatives as potent and selective transforming growth factor-β type I receptor inhibitors [J]. Bioorg Med Chem, 2012, 20: 7128-7138. |
| [10] | Bonafoux D, Chuaqui C, Boriack-Sjodin P, et al. 2-Aminoimidazoles inhibitors of TGF-β receptor 1 [J]. Bioorg Med Chem Lett, 2009, 19: 912-916. |
| [11] | Kim DK, Jung SH, Lee HS, et al. Synthesis and biological evaluation of benzenesulfonamide-substituted 4-(6-alkylpyridin-2-yl)-5-(quinoxalin-6-yl) imidazoles as transforming growth factor-β type 1 receptor kinase inhibitors [J]. Eur J Med Chem, 2009, 44: 568-576. |
| [12] | Jin CH, Krishnaiah M, Sreenu D, et al. Discovery of N-((4-([1, 2, 4]triazolo[1, 5-a]pyridin-6-yl)-5-(6-methylpyridin-2-yl)-1H-imidazol-2-yl)methyl)-2-fluoroaniline (EW-7197): a highly potent, selective, and orally bioavailable inhibitor of TGF-β type 1 receptor kinase as cancer immunotherapeutic/antifibrotic agent [J]. J Med Chem, 2014, 57: 4213-4238. |
| [13] | Jin CH, Krishnaiah M, Sreenu D, et al. 4-([1, 2, 4]Triazolo [1, 5-a]pyridin-6-yl)-5 (3)-(6-methylpyridin-2-yl) imidazole andpyrazole derivatives as potent and selective inhibitors of transforming growth factor-β type I receptor kinase [J]. Bioorg Med Chem, 2014, 22: 2724-2732. |
| [14] | Jin CH, Sreenu D, Krishnaiah M, et al. Synthesis and biological evaluation of 1-substituted-3 (5)-(6-methylpyridin-2-yl)-4-(quinoxalin-6-yl) pyrazoles as transforming growth factor-β type 1 receptor kinase inhibitors [J]. Eur J Med Chem, 2011, 46: 3917-3925. |
| [15] | Gellibert F, de Gouville AC, Woolven J, et al. Discovery of 4-{4-[3-(pyridin-2-yl)-1H-pyrazol-4-yl] pyridin-2-yl}-N-(tetrahydro-2H-pyran-4-yl) benzamide (GW788388): a potent, selective, and orally active transforming growth factor-β type I receptor inhibitor [J]. J Med Chem, 2006, 49: 2210-2221. |
| [16] | Ciayadi R, Potdar M, Walton KL, et al. 2-Phenyl and 2-heterocyclic-4-(3-(pyridin-2-yl)-1H-pyrazol-4-yl)pyridines as inhibitors of TGF-β1 and activin A signaling [J]. Bioorg Med Chem Lett, 2011, 21: 5642-5645. |
| [17] | Dewang PM, Kim DK. Synthesis and biological evaluation of 2-pyridyl-substituted pyrazoles and imidazoles as transforming growth factor-β type 1 receptor kinase inhibitors [J]. Bioorg Med Chem Lett, 2010, 20: 4228-4232. |
| [18] | Terashima H, Kato M, Ebisawa M, et al. R-268712, an orally active transforming growth factor-β type I receptor inhibitor, prevents glomerular sclerosis in a Thy1 nephritis model [J]. Eur J Pharmacol, 2014, 734: 60-66. |
| [19] | Wan X, Li ZG, Yingling JM, et al. Effect of transforming growth factor beta (TGF-β) receptor I kinase inhibitor on prostate cancer bone growth [J]. Bone, 2012, 50: 695-703. |
| [20] | Bueno L, Alwis DP, Pitou C, et al. Semi-mechanistic modelling of the tumour growth inhibitory effects of LY2157299, a new type I receptor TGF-β kinase antagonist, in mice [J]. Eur J Cancer, 2008, 44: 142-150. |
| [21] | Li H, Wang Y, Heap CR, et al. Dihydropyrrolopyrazole transforming growth factor-β type I receptor kinase domain inhibitors: a novel benzimidazole series with selectivity versus transforming growth factor-β type II receptor kinase and mixed lineage kinase-7 [J]. J Med Chem, 2006, 49: 2138-2142. |
| [22] | Kim DK, Choi JH, An YJ, et al. Synthesis and biological evaluation of 5-(pyridin-2-yl)thiazoles as transforming growth factor-β type 1 receptor kinase inhibitors [J]. Bioorg Med Chem Lett, 2008, 18: 2122-2127. |
| [23] | Patel HM, Sing B, Bhardwaj V, et al. Design, synthesis and evaluation of small molecule imidazo[2, 1-b][1, 3, 4] thiadiazoles as inhibitors of transforming growth factor-β type-I receptor kinase (ALK5) [J]. Eur J Med Chem, 2014, doi: 10.1016/j.ejmech.2014.09.002. |
| [24] | Zhang H, Jin J, Zhou W, et al. Nicousamide, a potent inhibitor of phosphorylation by TGF-β receptor II [J]. Acta Pharm Sin B, 2011, 1: 160-165. |
| [25] | Koelink PJ, Hawinkels LJAC, Wiercinska E, et al. 5-Aminosalicylic acid inhibits TGF-β1 signaling in colorectal cancer cells [J]. Cancer Lett, 2010, 287: 82-90. |
| [26] | Xu SP, Chen XG, Xu S, et al. The novel coumarin-amide derivaives and its preparation, said drug composition and its use: WO, 2004050082 A1 [P]. 2004-06-17. |
| [27] | Shao MX, Wang WT, Zhao ZY, et al. A new drug treating idiopathic pulmonary fibrosis: pirfenidone [J]. Drugs Clin (现代药物与临床), 2013, 28: 409-414. |
| [28] | Ma Z, Pan Y, Huang W, et al. Synthesis and biological evaluation of the pirfenidone derivatives as antifibrotic agents [J]. Bioorg Med Chem Lett, 2014, 24: 220-223. |
| [29] | Gellibert F, Fouchet MH, Nguyen VL, et al. Design of novel quinazoline derivatives and related analogues as potent and selective ALK5 inhibitors [J]. Bioorg Med Chem Lett, 2009, 19: 2277-2281. |
| [30] | Gellibert F, Woolven J, Fouchet MH, et al. Identification of 1, 5-naphthyridine derivatives as a novel series of potent and selective TGF-β type I receptor inhibitors [J]. J Med Chem, 2004, 47: 4494-4506. |
 2015, Vol. 50
2015, Vol. 50


