2. 山西大学化学化工学院, 山西 太原 030006;
3. 北京市中医研究所, 首都医科大学附属北京中医医院, 北京 100010
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Beijing Institute of Traditional Chinese Medicine, Beijing Hospital of Traditional Chinese Medicine Affiliated to Capital Medical University, Beijing 100010, China
远志是我国重要的大宗药材之一,同时也是我国85种传统出口药材之一和国家42种重点保护的 三级野生品种之一[1]; 始载于《神农本草经》,列为上品,四月采根叶 (叶名小草,另作药用)。2010版《中国药典》收载的远志药材分别来自远志科植物 细叶远志 (Polygala tenuifolia Willd.) 与卵叶远志 (P. sibirica L.) 的干燥根,具有安神益智、交通心肾、祛痰、消肿之功效[2]。由于远志用量非常大,加之野生资源的枯竭及再生能力的下降,从上世纪80年代起已经开始野生驯化及人工种植远志,而传统采收时间也相应调整为春、秋两季。目前已形成以细叶远志为主要商品药材的规模化种植基地[3],其中陕西合阳和山西新绛为远志的国家级种植基地[4]。
远志的活性成分主要为皂苷、口山酮、寡糖酯等化合物[5]。已有研究对不同生长年限远志药材的质量进行了高效液相色谱 (HPLC) 的活性指标成分比较和指纹图谱相似度评价[6, 7, 8],研究结果表明生长年限对远志药材的质量有较大影响。以上研究成果虽然对于远志药材的品质评价及质量控制起到了一定的作用,但质量评价所选取的活性指标成分较单一,而单一的指纹图谱研究又只能进行相似度评价,无法找出化学差异成分。因此,有关“生长年限究竟对远志药材中的哪些具体代谢物产生了影响,而这些物质的变化规律又是什么”的疑问仍尚未被阐明。
代谢组学是继基因组学和蛋白组学之后发展起来的一门学科,主要以各种代谢途径中的底物或产物中的低分子量代谢物为研究对象,特别适合于食品、传统中药等复杂体系的研究与分析[9]。目前,代谢组学技术已经成功地被应用于姜黄、郁金香、赤 芍、白芍、款冬花[10, 11, 12]等中药材的化学比较研究中。本课题组前期也曾采用核磁共振 (1H NMR) 代谢组学技术探讨了生长年限对远志药材质量的影响,发现虽然采用不同的提取方法 (如分别采用单项提取法、两项提取法及系统溶剂提取法等) 进行了NMR分析样品的制备,但以上方法所能指认的代谢物,除个别代谢物 (如3,6'-二芥子酰基蔗糖与1,3,5,8-四羟基口山酮等) 为次级代谢物外,其余代谢物仍多为初级代谢物 (数据未发表)。而单纯从初级代谢物中寻找出来的差异代谢物,其含量的变化仍无法全面反映出生长年限对远志药材质量的影响。因此,本文采用超高效液相色谱-四极杆-飞行时间质谱 (UPLC/ Q-TOF MS) 结合1H NMR代谢组学技术,对不同生长年限远志药材中的初级与次级代谢物进行比较,客观、全面地揭示生长年限对远志药材质量的影响,为现有中药材质量评价方法提供一种新的思路。
材料与方法 材料本实验所用远志样品 (1年、2年、3年) 分别于2012年秋季采自陕西合阳,经山西大学中 医药现代研究中心的秦雪梅教授鉴定为细叶远志(Polygala tenuifolia),凭证标本保存于山西大学中医药现代研究中心。样品经液氮研磨,过40目筛,-20 ℃保存,备用。
仪器与试剂重水 (Norell,Landisville,USA); 氘代甲醇 (99.8%,Merck,Darmstadt,德国); 纯净 水 (杭州娃哈哈集团有限公司); 分析纯甲醇、正丁 醇 (北京化工厂),色谱甲醇 (Tedia,USA)。色谱柱: ACQUITY UPLC BEH C18 (2.1 mm × 55 mm,1.7 μm),十八烷基键合硅胶为填充剂; ACQUITY UPLC I-Class/ Xevo G2 Q TOF (美国Waters公司)。Bruker 600-MHz AVANCE III NMR Spectrometer (600.13 MHz proton frequency,德国布鲁克公司)。
UPLC/Q-TOF MS分析的样品制备及测定[13] 样品制备精密称取远志样品1、2、3粉末各 500 mg置于具塞试管中,加入纯甲醇50 mL,称重,超声提取30 min,称重,补足减失重量,静置,过滤。取续滤液用0.22 μL微孔滤膜过滤,即得[12]。所有检测样品均平行备样3份,每份进样2针。
色谱条件流动相: A.乙腈,B.0.1% 甲酸水,梯度洗脱程序: 0~1 min,5% A; 1~3 min,5%~12% A; 3~6 min,12%~20% A; 6~10 min,20%~30% A; 10~10.5 min,30%~35% A; 10.5~13.5 min,35%~45% A; 13.5~15 min,45%~50% A; 15~18 min,50%~95% A; 18~19 min,95%~95% A; 19~20 min,95%~100% A; 流速为0.50 mL·min-1,柱温为40 ℃,样品池温度: 21 ℃,进样量为2 μL。
质谱条件采用电喷雾负离子检测的电离模式,雾化气体为高纯度氮气 (N2),碰撞气体为高纯度氦气 (He),质量扫描范围: 50~2 000 Da; 锥孔电压: 40 V; 毛细管电压: 2.5 kV; 离子源温度: 100 ℃; 脱溶剂气体温度: 500 ℃; 脱溶剂气体流速: 800 L·h-1; 锥孔气体流量50 L·h-1; 碰撞能量 (CE) 50~80 V; LockMass: 亮氨酸脑啡肽,m/z 554.261 5。
NMR分析的样品制备及测定[14] 样品制备精密称取远志样品1、2、3粉末各200 mg置于10 mL带盖玻璃离心管中,分别加纯净水3 mL及甲醇3 mL,加盖漩涡混匀1 min,超声提取25 min,3 500 r·min-1室温下离心25 min,取上清液,减压浓缩蒸干,用400 μL氘代甲醇与400 μL缓冲溶液 (Buffer: KH2PO4溶于D2O中,以1 mol·L-1氘代 氢氧化钠溶液调至pH 6.0,含0.1% TSP) 溶解,于室温13 000 r·min-1离心10 min,吸取上清液600 μL于5 mm核磁管中[13]。所有检测样品均平行备样6份。
样品测定样品在25 ℃下于600 MNMR仪上测定,测定频率1H NMR 600.13 MHz,扫描次数为 64,脉冲宽度为30 ℃,延迟时间为5.0 s; 傅里叶转换线性窗函数为0.3 Hz; 相调节、基线调节及峰校正均为手动。采用noesyppr1d序列抑制残余水信号; 内标为TSP (2,2,3,3-四甲基甲硅烷基丙酸); 以氘代甲醇锁场。
数据处理UPLC/Q-TOF MS数据预处理包括滤噪、峰识别、重叠峰分析、峰对齐、峰补齐、标准化、归一化等。所得质谱矩阵数据通过Waters公司自带软件TransOmicsTM生成。NMR数据导入MestReNova (version 8.0.1,Mestrelab Research,Santiago de Compostella,Spain) 进行处理。调整相位、基线,以δ0.04 为积分段对δ0.04~8.8 区间进行分段积分,其中δ4.70~5.00 (残余水峰) 和δ3.27~3.35 (溶剂峰) 不进行积分,进行数据归一化。
处理后的数据再分别导入SIMCA-P 13.0 (Umetrics,umeå,瑞典) 软件进行主成分分析 (PCA分析),再用偏最小二乘法 (PLS-DA) 的permutation test对模型的可靠性进行验证,最后用S-plot图确定对分类有显著贡献的变量,规格化方法为Par (VIP > 1)。根据分析结果,找出差异性代谢物,再运用Metabo Analyst (http://www.metaboanalyst.ca/MetaboAnalyst/ faces/Home.jsp) 进行差异代谢物间的含量及相关性分析。最后运用 Origin (8.0,OriginLab,美国) 软件对不同生长年限远志药材中皂苷的相对含量进行分析。
结果 1 UPLC/Q-TOF MS图谱分析由于远志皂苷在负离子模式下离子化效果好于正离子模式,因此本文采用负离子模式检测。结合文献[13, 15]、UPLC/Q-TOF MS矩阵中的保留时间、质荷比及碎片离子对远志中的代谢产物进行指认,共推断指认出34个次级代谢物,包括6个蔗糖酯 (No.1~6)、4个口山酮 (No.7~10)、16个低聚糖酯 (No.11~26)、8个三萜皂苷 (No.27~34) (表 1)。
|
|
Table 1 Compounds in P. tenuifolia identified by UPLC/Q-TOF MS |
对不同生长年限合阳远志的UPLC/Q-TOF MS数据进行数据处理,得3 745个变量,样品为3组 (每组样品数为6),得数据矩阵18×3745。从图 1A可看出,合阳1年生远志与2、3年生远志被t[1]轴 (PC1: 36.2%) 明显区分,1年位于正半轴,2、3年位于负半轴,而2、3年生远志则由t[2]轴 (PC2: 15.5%) 区分。由于合阳的1年与2、3年生远志的差异较大,因此以合阳1年生远志为一组,以合阳2、3年生远志为另一组,进行后续PLS-DA数据分析。
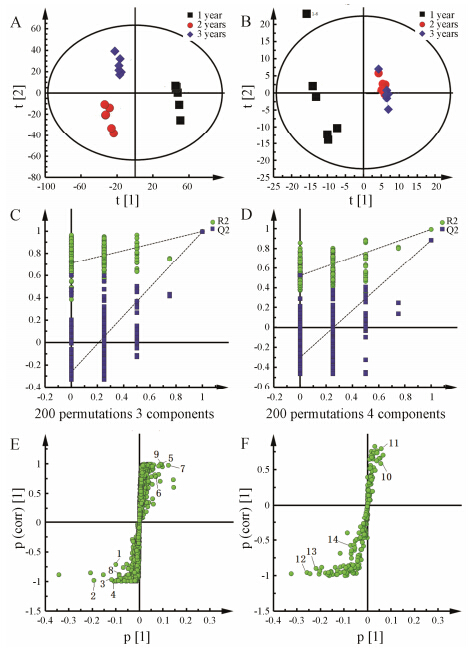
|
Figure 1 Multivariate statistical analysis charts. UPLC/Q-TOF MS: A,C,E; 1H NMR: B,D,F; PCA: A,B; Model validation: C,D; S-plot: E,F; 1-14 in E and F can be found in Table 3 |
PCA为无监督的分析方法,反映了数据的原始状态,但是无监督的分析方法同时反映了组内和组间的差异; 而为了突出组间差异,便于后续寻找差异代谢物,本研究继续采用了有监督的正交偏最小二乘法 (OPLS-DA) 对数据进行分析。OPLS-DA的使用必须以 PLS-DA模型通过验证为基础,而排列实验是一种外部模型验证方法,主要用于验证PLS-DA模型的拟合程度。PLS-DA模型排列实验 (n = 200) 中左端任何一次随机排列产生的R2、Q2 (R2X = 0.603,R2Y = 0.997,Q2 = 0.987) 值均小于右端的原始值,表明原始模型的预测能力大于任何一次随机排列y变量的预测能力,即模型有效,可以做后续的差异成分寻找[16]。从图 1C可见,左边的R2、Q2实验值均低于右边的原始值时,证明本研究所用模型有效,可用于进行后续组间差异成分的寻找及分析。
图 1E为UPLC/Q-TOF MS的OPLS-DA的S-plot图,对S-plot图分析并进行差异代谢物指认,共指认出9个差异代谢物,分别为: 口山酮 (polygalaxanthone III)、蔗糖酯 (tenuifoliose A、tenuifoliose C)、低聚糖酯 (tenuifoliose K、C2、I、B、H、A2)。
3 核磁图谱分析结合参考文献[14, 17, 18]、HMDB、chenomx NMR suit 7.0软件以及核磁图谱的化学位移、偶合常数和峰形等,对远志中的代谢产物进行指认,共指认出26个化合物 (表 2),其中24个为初级代谢物: ① 芳香区处于谱图的低场区 (δH 10.0~5.50),主要有苯丙氨酸 (phenylalanine) 等芳香氨基酸 (No.1~2); ② 糖区 (δH 5.50~3.10) 信号多且强,有很多重叠情况,根据文献及软件对比,鉴定出的化合物有: 果糖(4.16,d,J = 8)、α-葡萄糖 (5.2,d,J = 3.7 Hz)、蔗糖 (3.7) 等 (由于糖类结构复杂且相近,所以糖类重叠很严重,很难鉴定出更多糖类化合物) (No.3~6); ③ 脂肪区则位于高场区 (δH 3.10~0.00),主要包括氨基酸和有机酸,如亮氨酸 (leucine)、缬氨酸 (valine)、苏氨酸 (threonine)、丙氨酸 (alanine) 等(No.7~24)。2个为次级代谢产物 (No.25~26)。
|
|
Table 2 Compounds identified in P. tenuifolia by NMR. J in Hz |
化合物指认: No.26化合物为皂苷类,例如: 3-O- β-D-glucopyranosyl polygalacic acid及polygalacin D是两种不同构型的三萜皂苷,12位大多有双键,由于与11位亚甲基的偶合作用,12位氢通常在化学位移 δ 5.0~6.0处呈现宽单峰,本研究中远志的核磁共振指纹图谱在5.68处有一宽单峰,且在δ0.8~1.4之间出现大量的角甲基单峰信号,据此推断这些信号为远志中皂苷类化合物的信号,但由于皂苷类成分结构相似,故难以确定其具体结构。
4 基于NMR的不同生长年限远志中差异代谢物的寻找根据“数据处理”项下,对不同生长年限合阳远志的1H NMR图谱进行数据处理,得210个变量, 样品为3组 (每组样品数为6),得数据矩阵18×210。从图 1B可看出,合阳1年生远志与2、3年生远志被t[1]轴 (PC1: 36.4%) 明显区分,1年生位于t[1]负半轴,2、3年生位于t[1]轴正半轴,而2、3年生远志没有被t[2]轴 (PC2: 31.3%) 明显区分,与图 1A结果基本一致。由于合阳的1年生与2、3年生远志的化学差异较大,因此以合阳1年生远志为一组,以2、3年生远志为另一组,进行后续 PLS-DA数据分析。
图 1D为1H NMR排列实验 (n = 200) 的模型验证图,从图 1D可见,左边的R2、Q2 (R2X = 0.78,R2Y = 0.935,Q2 = 0.795) 实验值均低于右边的原始值时,证明本研究所用模型有效,可用于进行后续组间差异成分的寻找及分析。图 1F为1H NMR OPLS-DA的S-plot图,对S-plot图分析并进行差异代谢物指认,共指认出5个差异代谢物,分别为甘氨酸、棉籽糖、果糖、蔗糖以及胆碱 (表 3)。
|
|
Table 3 Metabolites in different samples. ↑ and ↓ represent higher and lower level in 2 and 3 years of P. tenuifolia. P < 0.05,**P < 0.01,***P < 0.001 vs 1 year |
为进一步明确上述差异代谢物 (表 3) 在1~3年生合阳远志药材中的含量变化,运用Metabo Analyst 2.0进行分析。可知,tenuifoliose K、I、B、A2、甘氨酸、棉籽糖的含量在1年生远志中较低,在2、3年生远志中则较高; 而tenuifoliose A、C、polygalaxanthoneIII、tenuifoliose C2、H、果糖、蔗糖、胆碱的含量在1年生远志中较高,在2、3年生远志中则较低。
6 差异代谢物的相关分析为明确上述差异代谢物 (表 3) 间的相关性,运用Metabo Analyst 2.0进行相关性分析。图 2A、2B、2C分别为1、2、3年生合阳远志中代谢物的相关性分析图,横坐标为9个次级代谢物,纵坐标为5个初级代谢物,红色表示正相关,蓝色表示负相关。图 2A中,红色多而蓝色少且红色的颜色较深,表明1年生远志中初级及次级代谢物间主要呈正相关,且相关性较大; 图 2B中,红色减少且变浅而蓝色增多,表明2年生远志中,初级及次级代谢物间的相关性多呈负相关; 图 2C中,红色持续减少而蓝色则继续增多且颜色变浅,表明3年生远志中初级及次级代谢物间主要呈负相关,且相关性较小。
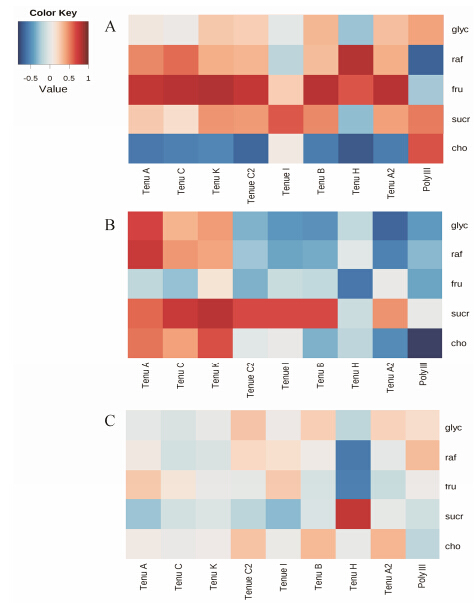
|
Figure 2 The correlation between the key primary metabolites with secondary metabolites. A: 1 year,B: 2 years,C: 3 years. Poly III: Polygalaxanthone III; Tenu: Tenuifoliose; glyc: Glycine; raf: Raffinose; fru: Fructose; sucr: Sucrose; cho: Choline |
皂苷作为远志药材中重要的活性成分,在不同生长年限远志药材中的含量多有不同。然而,本文在所寻找到的差异代谢物 (表 3) 中并没有发现皂苷类成分,故对皂苷的相对含量做重点分析。
本文通过UPLC/QTOF-MS指认的8个皂苷类 成分,其相对含量从大到小依次为 (按峰面积大小排序): onjisaponin Fg > polygalasaponin XXVIII > polygalasaponin XXXII > onjisaponin Sg> onjisaponin Gg > onjisaponin T > onjisaponin G > onjisaponin V; 其中onjisaponin Fg、onjisaponin Sg、onjisaponin Gg、polygalasaponin XXXII、polygalasaponin XXVIII在2、3年生远志中的相对含量略高于1年,而onjisaponin V、onjisaponin G、onjisaponin T则在1年生远志中的含量略高。
如图 3所示,与1年生远志相比,2年生远志 中的onjisaponin V (P < 0.05) 含量显著性降低,而onjisaponin Sg (P < 0.01)、polygalasaponin XXXII (P < 0.01) 含量则显著性升高; 3年生远志中的polygalasaponin XXVIII (P < 0.01)、polygalasaponin XXXII (P < 0.05)、onjisaponin Sg (P < 0.01) 含量 显著性升高,而onjisaponin V含量则显著性降低 (P < 0.05)。与2年生远志相比,3年生远志中的polygalasaponin XXVIII (P < 0.01) 含量显著性升高。
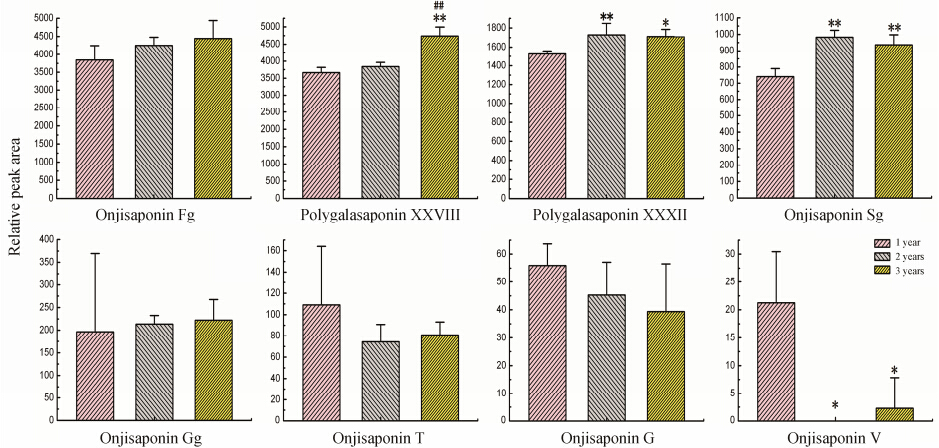
|
Figure 3 The area of saponins in different growth years of P. tenuifolia. P < 0.05,**P < 0.01 vs 1 year; ##P < 0.01 vs 2 years. Relative peak area expressed as relative intensity against the peak area of the internal standard leucine-enkephalin |
初级代谢物是指植物通过代谢活动所产生的供自身生长和繁殖所必需的物质,如糖类、脂类、维生素、氨基酸等。初级代谢自始至终存在于植物中,对环境条件的变化敏感性小[19]。在细胞的生命活动过程中,细胞壁参与植物细胞的生长与分化、细胞识别及植物体的形态建成,调节植物细胞之间以及植物细胞与外界环境之间的物质交流,同时也参与植物的抗病和抗逆反应。而在植物的某些组织中存在富含甘氨酸的蛋白质 (GRP),GRP主要在维管组织的木质部和韧皮部中表达,其合成往往具有严格的发育调控性,并且受环境的诱导; GRP在植物发育以及维管系统发挥功能的过程中具有一定的作用[20],并可能参与植物的防御反应[21]及修复过程[22]。故推断2、3年生远志药材中甘氨酸含量远高于1年生的原因,可能是由于甘氨酸参与了远志体内维管组织的构建以及参与远志的抗逆及抗病反应,因此甘氨酸的含量会随着远志生长年限的延长而增加。蔗糖是光合作用的主要产物,广泛分布于植物体内,是植物储藏、积累和运输糖分的主要形式。本文结果表明,蔗糖的含量随远志生长年限的延长而呈下降趋势,又因果糖是蔗糖分解的产物,且果糖的含量变化趋势与蔗糖相同也呈下降趋势,而较少作为能量供应者的三糖 (如本文中的棉籽糖)、戊糖等低聚糖[23],其含量则随生长年限的延长而增加,因此,推断2、3年生远志中蔗糖与果糖含量的减少,可能是为远志的继续生长提供了必要的能量。胆碱作为一种维生素类物质,是合成植物细胞膜脂质-磷脂酰胆碱的重要化合物[24],而随着生长年限的延长,远志药材体内需要合成的磷脂酰胆碱会增多,故推断2、3年生远志中胆碱含量降低的原因,是由于用于合成磷脂酰胆碱的胆碱用量增多所致。
次级代谢物是植物生长到一定时期内产生的,其与初级代谢物的不同之处在于其对环境条件的变化很敏感,其合成往往因环境条件的变化而停止,且同种植物在不同生长环境下所产生的次级代谢物也会不完全相同,可见次级代谢物的产生与积累和机体的生长不呈平行关系[21]。本文共指认了8个皂苷化合物,但所寻找到的差异代谢物中却没有包括皂苷,推断其原因可能是由于与1年生远志相比,2、3年生远志中所含的口山酮、糖酯等代谢物有极显著性差异 (P < 0.001),从而导致部分皂苷代谢物的显著性差异被掩盖。此外,从远志所含皂苷的相对含量来看,它们也是远志皂苷中的主要大类成分,其含量会随着远志生长年限的延长而增加,这与已有文献[6, 7, 8]所报道的结果相一致。口山酮及部分低聚糖酯的含量会随着远志生长年限的延长而降低 (机制不明)。
综上所述,生长年限对远志中的部分初级与次级代谢物的积累与消耗均有一定程度的影响,而商品远志现有的2、3年的生长年限比较合理[6, 7, 8],有其一定的科学意义。但从本文中也不难发现,一些相对含量较低的皂苷类物质和口山酮III以及一些低聚糖酯类物质等,反而会随着远志生长年限的延长而降低。因此,现行2010版《中国药典》中以细叶远志皂苷、远志口山酮III、3,6'-二芥子酰基蔗糖为检测指标进行含量测定,用该标准对远志药材整体质量进行评价是否充分,值得商榷,还需进行有关活性成分的药理学研究。由于本文只考察了不同生长年限 (1~3年生) 对陕西合阳产远志药材 (栽培) 质量的影响,未对全国的其余产地远志进行考察,因此还有待于后续的进一步研究。
| [1] | Li SQ. Chinese Herbal Medicine Procurement Technical Manual (中药采购技术手册) [M]. Xi'an: Shaanxi Science and Technology Press, 1998: 411-412. |
| [2] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. Part 1. 2010ed. Beijing: China Medical Science Press, 2010: 189. |
| [3] | Liu HZ, Zhang SJ. Studies on Polygala tenuifolia's domestication and cultivation technology [J]. Chin Wild Plant Resour (中国野生植物资源), 2003, 22: 55-57. |
| [4] | Han LL, Li Z, Guan RW, et al. Progress in studies on medicinal crop of Polygala [J]. Chin Wild Plant Resour (中国野生植物资源), 2010, 29: 1-4. |
| [5] | Jiang Y, Tu PF. Progress in studies on Polygala tenuifolia [J]. Chin Tradit Herb Drugs (中草药), 2001, 32: 759-761. |
| [6] | Li J, Dong XB, Jiang Y, et al. HPLC determination of total saponins in Radix Polygalae [J]. Chin J Pharm Anal (药物分析杂志), 2007, 27: 1329-1332. |
| [7] | Liu YF, Jiang Y, Tu PF, et al. Quantitative analysis of the effective components in Polygalae Radix from different resources [J]. Chin Pharm J (中国药学杂志), 2011, 46: 1879-1883. |
| [8] | Teng HM, Fang MF, Hu ZH, et al. Comparison of structure and senegenin content of roots in Polygala tenuifolia Willd and P. sibirica L [J]. Acta Bot Boreal-Occident Sin (西北植物学报), 2008, 28: 2359-2367. |
| [9] | Zu C, Hu P, Liang QL, et al. Integration of metabonomics technology and its application in modernization of traditional Chinese medicine [J]. Acta Pharm Sin (药学学报), 2008, 43: 683-689. |
| [10] | Wu HW. Studies on Warm and Cold Nature of Jianghuang and Yujin Based on Metabonomies (基于代谢组学的姜黄、郁金寒热药性差异研究) [D]. Beijing: China Acadey of Chinese Medical Sciences, 2011. |
| [11] | Yang QW, Yang L, Xiong AZ, et al. Metabolomics study of anti-inflammatory action of Radix Paeoniae Rubra and Radix Paeoniae Alba by ultraperformance liquid chromatography- mass spectrometry [J]. China J Chin Mater Med (中国中药杂志), 2011, 36: 694-697. |
| [12] | Xue SY, Wang XJ, Sun HF, et al. Metabolomic study of flower buds of Tussilago farfara in different development stages by GC-MS [J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 2863-2869. |
| [13] | Ling Y, Li ZX, Chen MC, et al. Analysis and detection of the chemical constituents of Radix Polygalae and their metabolites in rats after oral administration by ultra high-performance liquid chromatography coupled with electrospray ionization quadrupole time-of-flight tandem mass spectrometry [J]. J Pharm Biomed Anal, 2013, 85: 1-13. |
| [14] | Wang XJ, Li ZY, Xue SY, et al. Quality control over different processed products of Polygalae Radix based on plant metabolomics [J]. Chin Tradit Herb Drugs (中草药), 2012, 43: 1727-1737. |
| [15] | Tu PF, Jiang Y. Xanthone O-glycosides from Polygala tenuifolia [J]. Phytochemistry, 2002, 60: 813-816. |
| [16] | Mi X, Li ZY, Qin XM, et al. Monitoring of chemical components with different color traits of Tussilago farfara using NMR-based metabolomics [J]. Acta Pharm Sin (药学学报), 2013, 48: 1692-1697. |
| [17] | Xiao CN, Dai H, Liu HB, et al. Revealing the metabonomic variation of rosemary extracts using 1H NMR spectroscopy and multivariate data analysis [J]. Agric Food Chem, 2008, 56: 10142-10153. |
| [18] | Jung Y, Lee Y, Ji Y, et al. Metabolite profiling of Curcuma species grown in different regions using 1H NMR spectroscopy and multivariate analysis [J]. Analyst, 2012, 137: 5597-5606. |
| [19] | Wu ZQ. Comparison of the primary metabolisms and secondary metabolisms in microbial [J]. Biol Teach (生物学教学), 2006, 31: 79. |
| [20] | Condit CM, Mclean BG, Meagher RB. Characterization of the expression of the Petunia glycine-rich protein-1 gene product [J]. Plant Physiol, 1990, 93: 596-602. |
| [21] | Keller B, Heierli D. Vascular expression of grp1.8 promoter is controlled by three specific regulatory elements and one unspecific activating sequence [J]. Plant Mol Biol, 1994, 26: 747-756. |
| [22] | Ryser U, Schorderet M, Zhao GF. Structural cell-wall proteins in protoxylem development: evidence for a repair process mediated by a glycine-rich protein [J]. Plant J, 1997, 12: 97-111. |
| [23] | Ding SP, Yan JQ, Ji DP. Effect of sugar sources on plant tissue culture [J]. Chin Bull Bot (植物学通报), 1998, 15: 42-46. |
| [24] | Antonio F, Dominique M, Debora S, et al. Seasonal changes in the metabolic fingerprint of Juniperus communis L. berry extracts by 1H NMR-based metabolomics [J]. Metabolomics, 2014, 10: 165-174. |
 2015, Vol. 50
2015, Vol. 50


