2. 南京中医药大学附属医院临床药理科, 江苏 南京 210029;
3. 南京军区总医院临床药理科, 江苏 南京 210002
2. Department of Clinical Pharmacology, Affiliated Hospital of Nanjing University of Traditional Chinese Medicine, Nanjing 210029, China;
3. Department of Clinical Pharmacology, General Hospital of Nanjing Military Area Command, Nanjing 210002, China
抑郁症 (depression) 是一种情感障碍性精神疾病。以显著而持久的心境低落为主要特征,常伴有焦虑、躯体不适感、睡眠障碍、食欲及性欲减退等症 状[1]。抑郁症发病机制较为复杂,是一类与应激密切相关的精神疾病,单胺递质假说认为其发生可能与脑内单胺类神经递质功能失衡有关,近年来此假说得到证实和公认,去甲肾上腺素 (NE)、5-羟色胺(5-HT)、多巴胺 (DA) 被认为是与抑郁症的发生密切相关的单胺类神经递质。抑郁状态可导致中枢神经 系统组织形态结构、神经递质及其受体功能产生显著改变[2, 3, 4]。研究[5, 6, 7, 8, 9]表明,抑郁状态可以通过某些机制来调节机体内相关蛋白质的表达。体内的药物代谢酶也是一类重要的蛋白质,随着抑郁的发生发展,5-HT、C反应蛋白 (CRP) 等含量及活性均可发生显著改变。作者推测抑郁状态可能通过某些途径来影响肝脏中药物代谢酶的活性[10, 11, 12],进而使得药物的疗效改变及不良反应发生。慢性不可预见性温和应激 (chronic unpredictable mild stress,CUMS) 模型是至今为止较为理想的抑郁动物模型[13],很好地模拟了CUMS诱发抑郁的过程及生理生化改变[14]。行为学及代谢组学研究均显示CUMS造模较为成功[15]; 采用Cocktail法[16]观察抑郁状态对于肝脏药物代谢酶主要亚型的活性影响,进而选择适当的药物来调节抑郁状态所致的肝药酶活性失衡,为抑郁症的药物治疗提供新的思路。
材料与方法 药品与试剂奥美拉唑肠溶胶囊 (石药集团欧意药业有限公司,批号: 060131232,规格: 20 mg×21粒),咪达唑仑注射液 (江苏恩华药业股份有限公司,批号: 20130922,规格: 10 mg/2 mL/支); 甲苯磺丁脲 (tolbutamide,017K1025),氯唑沙宗 (chlorzoxazone,017K1385),茶碱 (theophylline,T1633) 和右美沙芬 (dextromethorphan,097K11348),购自Sigma公司; 咪达唑仑 (midazolam,批号: 171250-200401),奥美拉唑 (omeprazole,批号: 100367-201104),内标吡罗昔康 (piroxicam,批号: 100177-200603) 和替硝唑 (tinisazole,批号: 100336-200402) 购自中国食品药品检定研究院。
仪器Waters Quattro Micro液质联用仪 (美国Waters公司),色谱工作站: Masslynx4.1,Labconco梅特勒-托利多AE240型电子天平 (上海梅特勒-托利多有限公司),离心浓缩仪 (Labconco),游泳缸,自制敞箱。
给药方法雄性SD大鼠22只,体重 (200 ± 20) g,由南京中医药大学实验动物中心提供,合格证号: scxk-(苏)2014-0001。将大鼠随机分为对照组(10只) 和模型组 (12只),对照组5只/笼饲养,模型组每只单笼饲养,正常饮食、饮水。适应3天后,开始实验。采用Katz法[13]造模,使大鼠在21天内接受以下9种刺激因子: ① 潮湿垫料和倾斜45°; ② 禁食24 h; ③ 热刺激45 ℃环境 (5 min); ④ 夹尾 (用塑料夹子夹住距大鼠尾尖1 cm处,持续5 min后取下夹子); ⑤ 4 ℃冰水游泳 (5 min); ⑥ 束缚应激6 h; ⑦ 禁水24 h; ⑧ 触摸陌生异常物品 (塑料杯、木勺、碎布片等); ⑨ 昼夜颠倒24 h (于早9:00时将大鼠的笼子盖上黑色塑料袋,不开灯使大鼠处于黑暗状态; 至晚21:00时将笼子上的黑色塑料袋去掉,置于开灯的房间,使动物处于光照状态,直至次日早9:00时)。每日给予一种刺激,每种刺激累计使用2~3次,顺序随机,使动物不能预料刺激的发生,持续3周。造模21天并确认造模成功后,两组大鼠均灌胃给予混合探针药物10 mL·kg-1,于5、10、20、40 min和1、1.5、2、2.5、3、5、8、12和24 h从眼底静脉丛采血约200 μL,置于肝素钠浸泡过的1.5 mL EP管中。全血4 000 r·min-1离心10 min后,吸取上层血浆于 -80 ℃保存待用。整个实验过程尽量避光。
体重变化分别于造模前、造模21天后测定其体重。
旷场实验将大鼠放入高40 cm,长宽均为50 cm,内壁涂黑,底面平均分为25个10 cm× 10 cm的小方格的箱内底面中心,同时进行摄像和计时,以5 min内大鼠穿越箱底面的方格数为水平得分 (三爪以上跨入),穿越一格得1分; 以双前肢抬起次数为垂直得分 (两前肢离地1 cm以上),双前肢离地一次得1分。分别于造模前、造模21天后进行测定。
糖水消耗d1: 给予每只大鼠两瓶1% 蔗糖水,每瓶各200 mL; d2: 给予每只大鼠一瓶装有1% 蔗糖水,另一瓶装有纯净水,每瓶各200 mL; d3: 所有大鼠均禁食禁水; d4: 给予每只大鼠一瓶1% 蔗糖水,另一瓶纯净水,每瓶各200 mL,24 h后,取走两瓶并测量瓶中剩余液体体积,计算动物的糖水消耗量。分别于造模前、造模21天后进行测定。
混合探针的配制称取甲苯磺丁脲200 mg,氯唑沙宗600 mg,茶碱250 mg,右美沙芬300 mg,固体用0.5% CMC-Na研磨混匀后,全部转移至100 mL棕色量瓶中,加入咪达唑仑注射液30 mL (含咪达唑仑150 mg),奥美拉唑肠溶胶囊420 mg (含奥美拉唑401.2 mg),生理盐水定容。混合探针临用前配制。
混合标准溶液及质控溶液的配制精密称取茶碱、氯唑沙宗、甲苯磺丁脲、右美沙芬、奥美拉唑、咪达唑仑各对照品适量,分别溶于10 mL棕色容量瓶中,加甲醇定容即得各对照品储备液。
精密吸取各对照品储备液适量于5 mL量瓶中,加75% 乙腈定容至5 mL,分别得到250、125、250、5、10和5 μg·mL-1的混标作为最高点,后用75% 乙腈倍比稀释成125、62.5、125、2.5、5和2.5 μg·mL-1的质控高浓度混合标液,继续稀释得质控中浓度 (25、12.5、25、0.5、1和0.5 μg·mL-1) 和低浓度 (2.5、1.25、2.5、0.05、0.1和0.05 μg·mL-1) 混合标液,所有标液冷藏于4 ℃备用。
混合内标的配制精密称取替硝唑和吡罗昔康各对照品适量,分别溶于10 mL量瓶中,甲醇定容,摇匀,得各对照品储备液。另精密移取各储备液适量于同一10 mL量瓶中,75% 乙腈定容至刻度,摇匀,使得替硝唑和吡罗昔康的终浓度分别为10.21和14.24 μg·mL-1,冷藏于4 ℃备用。
血样处理取血浆50 μL,加入混合内标10 μL,涡旋30 s,混匀,加入乙酸乙酯800 μL,涡旋5 min,12 000 r·min-1离心5 min后,取上清液750 μL,氮气吹干,75% 乙腈100 μL复溶,涡旋5 min,取上清液80 μL置于进样小瓶中,进样5 μL。
色谱条件色谱柱: Agilent Zorbax SB-C18 (150 mm × 2.1 mm,5 μm),美国Agilent公司; 保护柱: Agilent Zorbax SB-C18 (12.5 mm × 2.1 mm,5 μm),美国Agilent公司; 流动相: 0.1% 甲酸水溶液 (含4.0 mmol·L-1甲酸铵)-乙腈 (25∶75); 流速: 0.2 mL·min-1,柱温: 35 ℃。
质谱条件多反应监测 (MRM); 电喷雾离子化 (ESI); 正负离子同时检测; 检测电压: 3.0 kV; 离子源温度: 120 ℃; 脱溶剂温度: 350 ℃; 脱溶剂气体流速: 450 mL·min-1,见表 1。
|
|
Table 1 MRM parameters of six analytes and internal standards (IS) |
取EP管数支,分别加入0.72、0.29、0.50、0.01、0.02和0.01 μg·mL-1; 7.24、2.88、5.16、0.12、0.22和0.10 μg·mL-1; 36.22、14.40、25.80、0.61、1.10和0.50 μg·mL-1的茶碱、氯唑沙宗、甲苯磺丁脲、右美沙芬、奥美拉唑、咪达唑仑质控标准溶液10 μL,再分别加入内标溶液 (10.21、14.24 μg·mL-1) 10 μL,加入75% 乙腈溶液80 μL,涡旋30 s,进样分析,记录峰面积A1。另按“血样处理”项下血浆处理方法操作提取空白血浆数管,挥干后同上相同操作,记录峰面积A2。A2和A1的比值 (A2/A1×100%) 即为介质效应ME (%)。
血浆标准曲线取空白血浆50 μL,加入不同浓度的混合对照溶液10 μL,再加入混合内标10 μL,配成含茶碱、氯唑沙宗、甲苯磺丁脲、右美沙芬、奥美拉唑、咪达唑仑质量浓度系列分别为0.145、0.724、1.449、2.898、7.245、14.49、36.22和72.45 μg·mL-1; 0.058、0.288、0.576、1.152、2.880、5.760、14.40和28.80 μg·mL-1; 0.103、0.516、1.032、2.064、5.160、10.32、25.80和51.60 μg·mL-1; 0.002、0.012、0.024、0.048、0.121、0.243、0.607和1.214 μg·mL-1; 0.004、0.022、0.044、0.088、0.220、0.440、1.100和2.200 μg·mL-1; 0.002、0.010、0.020、0.040、0.100、0.200、0.500和1.000 μg·mL-1的含药血浆,按“血样处理”项下方法处理。分别计算各成分的峰面积 (As) 与相应内标的峰面积 (Ai) 的比值Y,以比值Y对探针药物的进样质量浓度X进行线性回归,得回归方程。
精密度和准确度考察日内精密度和日间精密度 (3d)。按血浆标准曲线配制方法制备含茶碱、氯唑沙宗、甲苯磺丁脲、右美沙芬、奥美拉唑、咪达唑仑分别为0.72、0.29、0.50、0.01、0.02和0.01 μg·mL-1; 7.24、2.88、5.16、0.12、0.22和0.10 μg·mL-1; 36.22、14.40、25.80、0.61、1.10和0.50 μg·mL-1的含药血浆质控样品,按“血样处理”项下方法操作,根据随行标线求得实测浓度。实测浓度的RSD即为精密度,加入浓度和实测浓度的比值即为准确度。
提取回收率制备含茶碱、氯唑沙宗、甲苯磺 丁脲、右美沙芬、奥美拉唑和咪达唑仑分别为0.72、0.29、0.50、0.01、0.02和0.01 μg·mL-1; 7.24、2.88、5.16、0.12、0.22和0.10 μg·mL-1; 36.22、14.40、25.80、0.61、1.10和0.50 μg·mL-1的含药血浆质控样品,按“血样处理”项下方法操作,记录峰面积A3。提取回收率R% = A3/A1 × 16/15 × 100%。
稳定性考察6种探针药物对照品储备液及含药血浆在不同保存条件下的稳定性: 对照品的甲醇溶液可在4 ℃冰箱保存2个月以上; 含药血浆样品在 -20 ℃冰箱内冷冻保存一个月; 血浆样品在室温 (避光保存) 12 h内; 反复冻融3次。
统计学分析利用SPSS 17.0统计软件进行分析处理,组间比较采用单因素方差分析,统计结果用均数 ± 标准差 (x± s) 表示。
结果 1 造模确认造模21天后,与对照组相比,模型组大鼠体重显著降低 (P < 0.05),水平得分、垂直得分均显著降低 (P < 0.01),同时糖水消耗量显著降低 (P < 0.01)。模型组血浆中5-HT、NE、DA分别为3.99 ± 1.21、6.24 ± 1.94和6.07 ± 1.98 μg·L-1,与对照组相比均显著降低 (P < 0.01)。
2 色谱行为咪达唑仑、右美沙芬、奥美拉唑、甲苯磺丁脲、氯唑沙宗、茶碱和内标替硝唑、吡罗昔康的保留时间分别为3.14、2.85、2.23、2.49、2.36、1.99、2.07和2.62 min。6种探针药物与2种内标分离良好,互不 干扰,且血浆中内源性杂质不影响分析物的测定,基线平稳 (图 1)。本方法具有良好的特异性和分离度,能准确测定血浆中6个探针药物的浓度,重现性好。
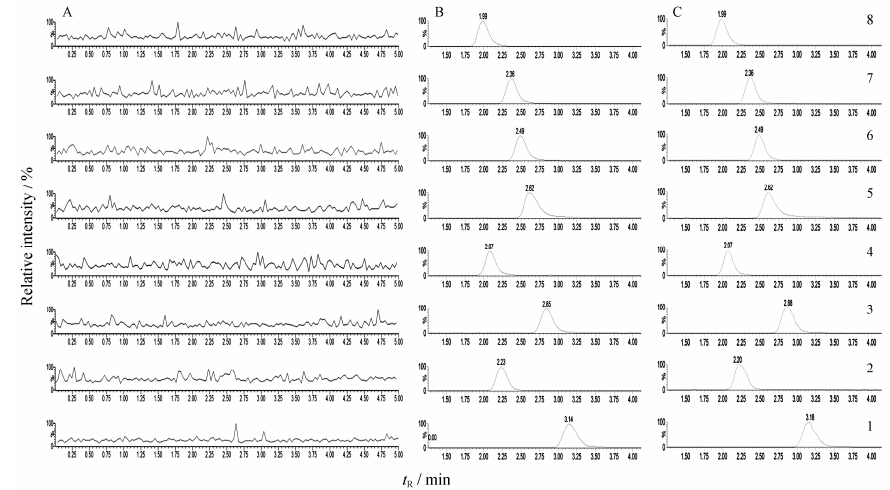
|
Figure 1 Representative MRM chromatograms of each analyte and internal standards. A: Blank plasma; B: Plasma added with reference standards; C: Plasma samples. 1: Midazolam; 2: Omeprazole; 3: Dextromethorphan; 4: Tinisazole (IS2); 5: Piroxicam (IS1); 6: Tolbutamide; 7: Chlorzoxazone; 8: Theophylline |
结果表明,茶碱、氯唑沙宗、甲苯磺丁脲、右美沙芬、奥美拉唑、咪达唑仑及内标吡罗昔康、替硝唑的介质效应分别在85.50%~91.74% (n = 5); 86.82%~93.27% (n = 5); 86.18%~96.05% (n = 5); 85.99%~90.79% (n = 5); 85.86%~90.19% (n = 5); 86.71%~106.15% (n = 5); 91.27%~112.43% (n = 15); 88.18%~105.18% (n = 15)。
3.2 血浆标准曲线
各成分回归方程见表 2。
|
|
Table 2 Standard curves of six analytes (n = 5) |
茶碱、氯唑沙宗、甲苯磺丁脲、右美沙芬、奥美拉唑、咪达唑仑的日内精密度RSD分别小于6.7%、6.4%、5.1%、3.4%、8.3%、4.8%,日间精密度RSD分别小于8.2%、6.9%、4.3%、6.7%、8.4%、6.6%,准确度均在85%~115% 之间,符合生物样品分析的要求,提示该方法准确、可靠、重现性好。
3.4 提取回收率结果茶碱、氯唑沙宗、甲苯磺丁脲、右美沙芬、奥美拉唑、咪达唑仑及内标吡罗昔康、替硝唑的提取回收率分别为89.26%~107.52% (n = 5); 61.50%~81.96% (n = 5); 79.71%~92.02% (n = 5); 83.33%~87.60% (n = 5); 91.06%~105.32% (n = 5); 63.78%~95.92% (n = 5); 92.81% (n = 15); 86.85% (n = 15)。
3.5 稳定性结果表明6种探针药物对照品储备液及含药血浆在4 ℃冰箱保存2个月以上和 -20 ℃冷 冻保存一个月样品稳定。血浆样品在室温 (避光保 存) 12 h内稳定。反复冻融3次后,经实测浓度与加入浓度进行比较,浓度变化在88.37%~107.01%,提示血浆样品反复冻融3次后测定结果稳定。
4 6种探针药物的药-时曲线茶碱、氯唑沙宗、甲苯磺丁脲、右美沙芬、奥美拉唑、咪达唑仑的药时曲线见图 2。
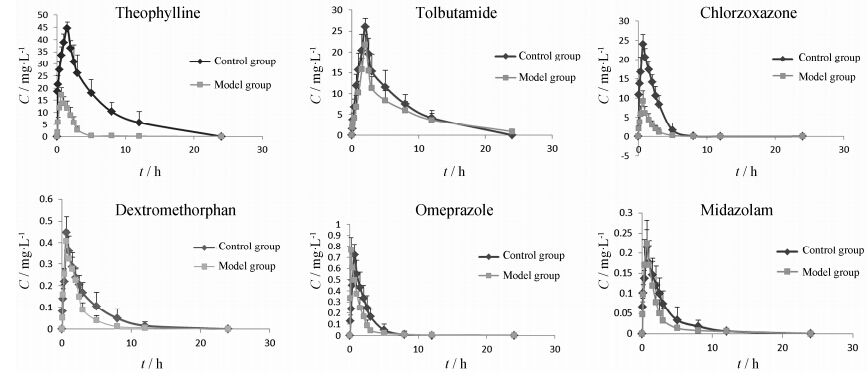
|
Figure 2 C-t curves of six kinds of drug probes (control group: n = 10; model group: n = 12,x± s) |
各成分的药代动力学数据经中国药理学会推荐的DAS2.0程序处理,分别按单室、二室、三室模型以最小二乘法拟合,结果表明奥美拉唑、咪达唑仑和右美沙芬符合一室模型,氯唑沙宗符合二室模型,其他均符合一室模型,6种探针药物的生物半衰期 (t1/2)、表观分布容积 (Vd/F)、机体总清除率 (CL/F)、达峰时间 (tmax)、最大血药浓度 (Cmax)、药时曲线下面积 (AUC) 见表 3。
|
|
Table 3 Pharmacokinetic parameters of six probe drugs in rats after administration (x± s). *P < 0.05,**P < 0.01 vs C; C: Control (n = 10); M: Model (n = 12) |
本实验采用“cocktail”法考察抑郁状态下大鼠体内CYP450酶6种亚型的活性变化情况,为临床合理用药提供参考。在实验中,采用组间对照的方法,同时参考文献[17, 18, 19]排除了6种探针药物: 甲苯磺丁脲 (CYP2C6)、氯唑沙宗 (CYP2E1)、茶碱 (CYP1A2)、咪达唑仑 (CYP3A2)、奥美拉唑 (CYP2D1)、右美沙芬 (CYP2D2) 在大鼠体内存在的潜在代谢性相互作用的可能性,并间接反映对人体内CYP2C9、CYP2E1、CYP1A2、CYP3A4、CYP2C19、CYP2D6等6个亚型酶的影响,实验设计基本符合“cocktail”法条件。
采用“cocktail”法,给予慢性不可预见性温和刺激造模3周后,主要药动学参数如下: 茶碱t1/2、tmax、Cmax、AUC0-t及AUC0-∞均显著降低 (P < 0.01),其中Cmax降低2.59倍,AUC0-t降低9.81倍。氯唑沙宗Cmax、AUC0-t及AUC0-∞均显著降低 (P < 0.01),CL/F升高 (P < 0.05),其中Cmax降低2.62倍,AUC0-t 降低3.29倍。甲苯磺丁脲Cmax无显著变化,AUC0-t
降低 (P < 0.05)。右美沙芬CL/F升高 (P < 0.05),AUC0-t降低 (P < 0.05),AUC0-∞降低 (P < 0.05)。奥美拉唑tmax、AUC0-t及AUC0-∞降低 (P < 0.05)。咪达唑仑CL/F升高 (P < 0.05),AUC0-t及AUC0-∞降低 (P < 0.05)。实验结果表明,连续造模21天后,茶碱、氯唑沙宗在 大鼠体内浓度显著降低,代谢加快,说明慢性不可预见性温和刺激造成的抑郁状态对CYP1A2有强诱导、对CYP2E1有中强诱导作用。甲苯磺丁脲、右美沙 芬、奥美拉唑和咪达唑仑的代谢变化不明显,本结果与文献[20]报道一致,CUMS抑郁模型大鼠和对照组大鼠肝微粒体中总蛋白浓度无显著性差异,而抑郁组大鼠CYP450酶的浓度明显高于对照组,且抑郁组大鼠CYP450酶活性显著升高,促使代谢加快,底物浓度降低。根据本实验结果,抑郁症患者使用的药物为CYP1A2、CYP2E1酶的底物时,需要关注临床药效变化,必要时做适当的剂量调整。
| [1] | Zhang FX, Zhang H, Jiang LF. Clinical study of depression [J]. Shandong J Tradit Chin Med (山东中医杂志), 2010, 29: 61-62. |
| [2] | Pav M, Kovaru H, Fiserova A, et al. Neurobiological aspects of depressive disorder and antidepressant treatment: role of glia [J]. Physiol Res, 2008, 57: 151-164. |
| [3] | Manos RC, Kanter JW, Busch AM. A critical review of assessment strategies to measure the behavioral activation model of depression [J]. Clin Psychol Rev, 2010, 30: 547- 561. |
| [4] | Slavich GM, O'Donovan A, Epel ES, et al. Black sheep get the blues: a psychobiological model of social rejection and depression [J]. Neurosci Biobehav Rev, 2010, 35: 39-45. |
| [5] | Yue HB, Ma SH, Cheng X. Application and evaluation of drug-induced animal model of depression [J]. Int J Psychiatry (国际精神病学杂志), 2009, 36: 33-36. |
| [6] | Willner P. Validity, realiability and utility of the chronic mild stress model of depression: a 10-year review and evaluation [J]. Psychopharmacology (Berl), 1997, 134: 319-329. |
| [7] | Duncan LE, Hutchison KE, Carey G, et al. Variation in brain-derived neurotrophic factor (BDNF) gene is associated with symptoms of depression [J]. J Affect Disord, 2009, 115: 215-219. |
| [8] | Brunoni AR, Lopes M, Fregni F. A system review and meta- analysis of clinical studies on major depression and BDNF levels: implication for the role of neuroplasticity in depression [J]. Int J Neuropsychopharmacol, 2008, 11: 1169-1180. |
| [9] | Hamani C, Machado DC, Hipolide DC, et al. Deep brain stimulation reverses anhedonic-like behavior in a chronic model of depression: role of serotonin and brain derived neurotrophic factor [J]. Biol Psychiatry, 2012, 71: 30-35. |
| [10] | Stephan PL, Jaquenoud Sirot E, Mueller B, et al. Adverse drug reactions following nonresponse in a depressed patient with CYP2D6 deficiency and low CYP3A4/5 activity [J]. Pharmacopsychiatry, 2006, 39: 150-152. |
| [11] | Shams ME, Arneth B, Hiemke C, et al. CYP2D6 polymorphism and clinical effect of the antidepressant venlafaxine [J]. J Clin Pharm Ther, 2006, 31: 493-502. |
| [12] | González I, Peñas-Lledó EM, Pérez B, et al. Relation between CYP2D6 phenotype and personality in healthy volunteers [J]. Pharmacogenomics, 2008, 9: 833-840. |
| [13] | Katz RJ, Roth KA, Carroll BJ. Acute and chronic stress effects on open field activity in the rat: implications for a model of depression [J]. Neurosci Biobehav Rev, 1981, 5: 247-251. |
| [14] | Isingrini E, Belzung C, Freslon JL, et al. Fluoxetine effect on aortic nitric oxide-dependent vasorelaxation in the unpredictable chronic mild stress model of depression in mice [J]. Psychosom Med, 2012, 74: 63-72. |
| [15] | Zheng XY, Gao XX, Liu XJ, et al. Evaluation of animal model of depression based on metabolomic technology [J]. Drug Eval Res (药物评价研究), 2010, 33: 175-179. |
| [16] | Breimer DD, Schellens JH. A ‘cocktail' strategy to assess in vivo ox-idative drug metabolism in humans [J]. Trends Pharmcol Sci, 1990, 11: 223-225. |
| [17] | Zhu B, Ou-Yang DS, Chen XP, et al. Assessment of cytochrome P450 activity by a five-drug cocktail approach [J]. Clin Pharmacol Ther, 2001, 70: 455- 461. |
| [18] | Liu SJ, Liu ZX, Zhou L, et al. Impact of tripterygium active ingredient on vivo activity of CYP450 in rat [J]. Chin Pharmacol Bull (中国药理学通报), 2011, 27: 276-280. |
| [19] | Wang D, Liu PX, Zhang ZQ, et al. Simultaneous determination of six kinds of probe drugs and rapid evaluation of CYP450 isoenzyme activity in mice by LC-MS/MS [J]. Bull Acad Mil Med Sci (军事医学科学院院刊), 2008, 32: 545-549. |
| [20] | Duan JJ. Pharmacokinetics of Methotrexate, 5-Fluorouracil and Cyclophosphamide and CYP450 Level and Activity in Depression Model Rats (抑郁大鼠甲氨蝶呤、5-氟尿嘧啶和环磷酰胺药动学及CYP450浓度和活性研究) [D]. Guangzhou: Southern Medical University, 2012. |
 2015, Vol. 50
2015, Vol. 50


