2. 南京中医药大学, 江苏省方剂高技术研究重点实验室, 江苏 南京 210023;
3. 青岛市第五十八中学, 山东 青岛 266100;
4. 南京中医药大学附属医院, 江苏 南京 210029
2. Jiangsu Key Laboratory for Traditional Chinese Medicine Formulae Research, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. Qingdao No.58 High School, Qingdao 266100, China;
4. Jiangsu Provincial Hospital of Traditional Chinese Medicine, Nanjing 210029, China
中药“十八反”是数千年来中医药实践中严格遵循的用药禁忌,“藻戟芫花俱战草”是十八反内容中的一个重要组成部分,一般认为相反是指中药共同使用后出现毒性或者毒副作用。然而,中医药临床上,海藻与甘草两味药同用可治疗颈部与乳房疾病,如瘿瘤、乳癖、瘰疬等[1]。虽然十八反明确指出海藻与甘草合用可能产生“反”作用,但临床也发现二者配合使用既可能产生不良的毒副作用,也可能不出现明显不良反应。例如,临床上曾经采用海藻与甘草配伍治疗急性乳腺炎、乳腺小叶增生等,获得良好疗效,未见明显不良反应[2]。另外,有患者在将海藻与甘草同服后确实出现了严重的头痛、头晕等反应[3]。目前,二者合用是否产生毒性作用或不良反应尚不明确。关天增等[4]报道,甘草与海藻合用后出现毒性与剂量和二者的配比有关。作者通过实验研究证实了在一定剂量范围内甘草可抑制海藻促进大鼠离体回肠运动功能、甘草可增加海藻的急性毒性[5,6,7]。
昆布与海藻都属软坚散结类中药,其基源相近、功效相似,可能存在着共同的配伍禁忌特征。因此,本研究采用代谢组学方法研究昆布与甘草合煎提取物对SD大鼠自身代谢的影响,通过与昆布、甘草单煎提取物组以及空白对照组进行比较,研究昆布与甘草合煎提取物对SD大鼠血清中内源性小分子的干扰作用,分析合煎提取物是否出现异常的代谢变化,为阐释“藻戟芫花俱战草”的科学内涵提供代谢组学依据。 材料与方法 试剂与仪器
甘草药材于2010年7月采自宁夏灵武市美康甘草基地,经鉴定为豆科植物乌拉尔甘草 (Glycyrrhiza uralensis Fisch.) 的干燥根及根茎。昆布药材于2012年9月采自山东省威海市荣成,经鉴定为海带科植物海带 (Laminaria japonica Aresch.) 的干燥叶状体。气相色谱测定用试剂1,2-13C2-肉寇酸 (同位素内标,Isotec,美国)、盐酸甲氧胺 (98%,Sigma- Aldrich,德国)、吡啶 (≥99.8% GC,Sigma-Aldrich,印度)、MSTFA含1% TMCS (SIGMA-ALDRICH,FLUKA69478-5ML-F) 均为气相色谱纯。甲醇 (Tedia,美国)、正庚烷 (Merck,德国) 为色谱纯。超纯水由Milli-Q (Millipore,美国) 系统制得。
使用的主要仪器设备有岛津AUW 120D型及岛津AW120型电子分析天平 (Kyoto,日本)、岛津气相色谱质谱 (Shimadzu GC/MS QP2010Ultra/SE,Kyoto,日本)。气相色谱柱为RTx-5MS熔凝石英毛细管柱 (30 m× 0.25 mm ID,J&W Scientific,美国)。 提取物制备方法
昆布提取物制备: 昆布14 kg置夹层锅内,加10倍量水浸泡1 h,煎煮1 h后,再 次加10倍量水,煎煮1 h,合并药液,静置过夜滤过 (100目滤网),滤液浓缩至12.5 L,得昆布提取物。8.6 L浓缩液煎煮浓缩至2 L浸膏。给药前,0.5% 的CMC-Na溶液配为0.24 mL·mL-1昆布浸膏混悬液。
甘草提取物制备: 甘草药材3 kg置夹层锅内,加10倍量水浸泡1 h,煎煮1 h后,再次加10倍量水,煎煮1 h,合并药液,静置过夜滤过 (100目滤网),滤液浓缩至3 L,得甘草提取物,经喷雾干燥制成粉末状,最终得干粉193 g,产率6.43%。经含量测定其中含有: 甘草苷2.23%、异甘草苷1.12%、甘草素0.32%、异甘草素0.11%、甘草酸12.08%。给药前,用0.5% 的CMC-Na溶液配为0.105 g·mL-1甘 草提取物混悬液。
昆布甘草合煎提取物制备: 甘草1 kg加昆布1 kg置夹层锅内,加10倍量水浸泡1 h,煎煮1 h后,再次加10倍量水,煎煮1 h,合并药液,静置过夜、滤过 (100目滤网),滤液浓缩至2 L,得甘草昆布提取物,经喷雾干燥制成粉末状,最终得到121 g,产率6.05%。经含量测定其中含有: 甘草苷0.81%、异甘草苷0.4%、甘草素0.12%、异甘草素0.05%、甘草酸6.88%。给药前,0.5% 的CMC-Na溶液配为0.20 g·mL-1昆布浸膏混悬液。 动物实验与采样
在取得中国药科大学动物伦理委员会试验批准后,购买24只8~9周龄Sprague- Dawley (SD,体重180~200 g) 雄性大鼠 (SPF级,许可证号: SCXK (辽) 2010-001-0009778),购买自辽宁长生生物技术有限公司,饲养在室温 (20 ± 2) ℃、湿度50% ± 20%、明暗周期设定为12 h昼夜切换。大鼠适应性饲养2周,按体重随机分成4组 (n = 6),即正常对照组 (C)、昆布组 (K)、甘草组 (L) 和甘草昆布合煎组 (H),准确称取昆布煎煮浸膏、甘草干粉及甘草昆布合煎干粉,分别分散于0.5% CMC-Na溶液中,并按10 mL·kg-1 (CMC-Na溶液) 混悬液体积灌胃给予大鼠,使得各给药组均给予等量药材 (相当于每公斤体重16.5 g药材)。正常组按10 mL·kg-1灌胃0.5% CMC-Na溶液,分别在给药3天和5天后 (即第4天和第6天早晨,取样前禁食、不禁水12 h) 眼后静脉丛取血500 μL置于凝胶管中,立即在6 000 r·min-1离心10 min,转移上层血清,-80 ℃冰箱保存,用于代谢组学的分析。另外,全部大鼠于第6天眼后静脉丛取血后1 h采用大鼠股动脉放血方法立即处死,迅速取出肝脏、肾脏,取每个样品 (肝脏边缘部分和肾脏髓质约5 mm内取约3 mm切片) 相同部位组织,置于福尔马林溶液中固定,进行病理切片及H-E染色,显微镜下观察病理形态学改变。 肝功能测定
分别按照试剂盒说明测定血清谷丙转氨酶 (ALT)、谷草转氨酶 (AST)、肌酐 (CR) 与总尿素氮 (BUN)。 代谢组学样品处理
取血清50 μL,加入含有内标1,2-13C2-肉寇酸的甲醇溶液 (2.5 µg·mL-1) 200 μL,涡旋振荡3 min,4 ℃冰箱静置1 h。20 000×g、4 ℃离心10 min。取上清液80 μL于GC进样瓶中,减压挥干,再加入甲氧胺吡啶溶液 (10 mg·mL-1) 30 μL,涡旋振荡3 min,室温静置16 h进行肟化。然后加入衍生化试剂MSTFA (含1% TMCS) 30 μL,涡旋振荡 3 min,室温静置1 h进行硅烷化,最后再加入外标甲基肉寇酸酯庚烷溶液 (15 µg·mL-1) 30 μL,混匀后进行GC-MS检测。 GC-MS数据采集
GC/MS操作条件: 进样量 0.5 μL,采用分流进样 (1∶10) 模式; 以氦气为载气,恒流速度1.5 mL·min-1,采用程序升温模式: 起始温度为80 ℃保持3.0 min,从80 ℃到300 ℃采用线性升温模式 (20 ℃·min-1),至300 ℃时保持5.0 min。设定气化衬管温度为250 ℃; 清排气体流速为20 mL·min-1,保持1 min。设定传输管温度220 ℃、离子源温度200 ℃。采用电子流轰击模式,能量为 -70 eV,检测器设定电压为 -950 V。质谱系统采用全扫描方式进行数据采集 (2 500 Hz),扫描范围为m/z 50~800,溶剂延迟时间300 s。 数据分析及处理
解析GC-MS谱图,取得色 谱峰保留时间、质谱碎片与强度等信息,对照NIST (2008) 标准化合物谱库 (REPLIB,MAINLIB,MAXPLANCKQ,NIST-SALTS,NIST-MSMS,NIST- RI,T-MORITZ,JIYE) 以及最新版Wiley标准化合 物谱图 (Wiley-VCH Verlag GmbH & Co. KGaA,Weinheim,德国) 对所采集谱图中的化合物进行鉴定。对比测定化合物和对照标准化合物质谱图,确定各色谱峰/化合物特征定量离子,取得各色谱峰/化合物峰面积的定量数据,以测定样品为第一列、以色谱峰保留时间 (或对应鉴定化合物) 为第一行,以对应峰面积数据为主体,组成一个数据矩阵。经转置后采用SIMCA-P13 (Umetrics,Umeå,瑞典) 软件对数据进行分析。同前述方法[8,9,10]进行多变量数据分析,PCA用来观察样品的聚集、离散程度及离群点,PLS- DA散点图、OPLS-DA等方法展示组间的差异。采用方差分析方法 (one-way ANOVA) 对模式识别鉴定出的差异化合物进行统计检验(P < 0.05,有显著性差异),确定在组间有明显差异的化合物。 结果 1 肝肾功能指数与组织切片
生化参数测定结果显示,甘草提取成分给药后ALT、AST、CR、BUN均未见明显改变 (只有第5天BUN升高),提示甘草肝肾毒性较小 (图 1)。单用昆布提取成分3天后,AST明显升高,CR与BUN有所降低,而第五天则无明显变化,提示昆布短期给药对肝脏功能有一定影响。昆布与甘草合煎提取物可以调节昆布提取物引起的CR、BUN下降。另外,肝组织切片结果显示分别单煎与合煎昆布、甘草均没有出现明显的组织异常改变 (图 2A~D)。肾脏H-E染色结果显示,甘草昆布合煎组出现明显病变,肾小球体积增大,呈现弥漫性病变,细胞核增多,可见明显细胞增生,提示肾功能受到损害。单煎给药组中,昆布组出现轻微病变,肾小球体积有所增大,可见细胞增生,而甘草组给药未见明显病变 (图 2 E~H)。
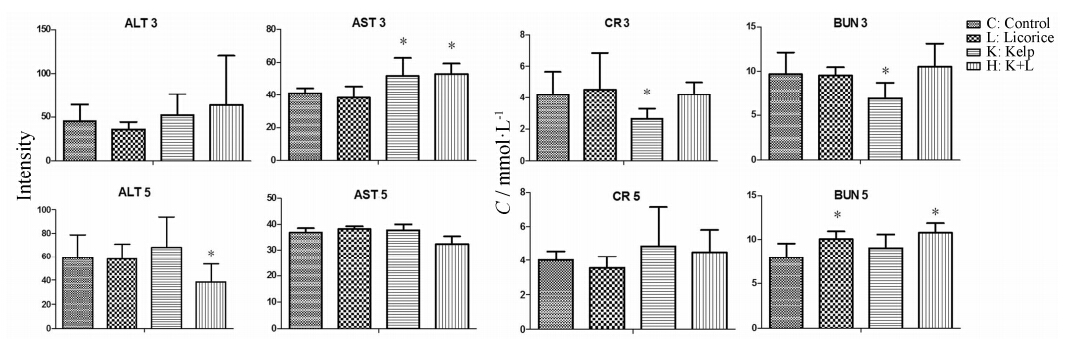 |
Figure 1 The effects on biochemical parameters of a single or mixed decoction of licorice and kelp. P < 0.05 vs control group (Student t Test). K: Kelp; L: Licorice; H: Licorice & kelp; C: Normal controls. AST: Alanine aminotransferase; ALT: Aspartate aminotransferase; CR: Serum creatinine; BUN: Serum urea nitrogen |
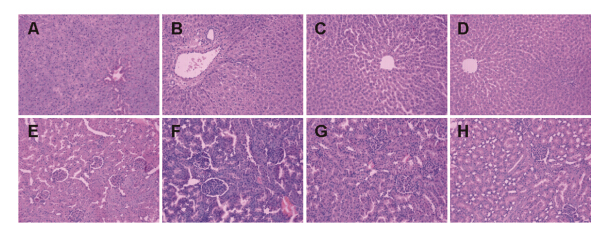 |
Figure 2 H-E staining of liver and kidney. Liver: A,Normal control; B,Mixed decoction of licorice and kelp; C,Kelp; D,Licorice. Kidney: E,Normal control; F,Mixed decoction of licorice and kelp; G,Kelp; H,Licorice |
采用GC-MS对各组大鼠血清提取物中内源性小分子进行检测(图 3,总离子流图),通过与标准化合物色谱保留时间与质谱图对比,对色谱图中出现的色谱峰 (滤去信噪比小于30的色谱峰) 进行鉴定,鉴定出包括氨基酸、脂肪酸、糖类、小分子有机酸、脂、糖醇等101个内源性化合物。总体看,与对照组
相比,昆布、甘草单独煎煮和合煎提取物给药后造成总离子流图谱中代谢物出现较为明显的变化,例如,给药造成部分氨基酸、丙酮酸、乳酸等水平的下降,而脂肪酸水平出现较明显的升高 (图 3)。
 |
Figure 3 The typical GC-MS profiles (TIC) of molecules in rats serum from four groups,respectively. A: Control; B: Kelp+ licorice; C: Kelp; D: Licorice. 1: Pyruvic acid; 2: Lactic acid; 3: Alanine; 4: Cystathionine; 5: 3-Hydroxybutyric acid; 6: Urea; 7: Valine; 8: Leucine; 9: Glycine; 10: Serine; 11: Threonine; 12: Methionine; 13: Pyroglutamic acid; 14: Glutamic acid; 15: Memy; 16: Glutamine; 17: L-Glutamine; 18: Citric acid; 19: Glucose; 20: L-Lysine; 21: Histidine; 22: L-Tyrosine; 23: Palmitic acid; 24: myo-Inositol; 25: Oleic acid; 26: Octadecanoic acid; 27: Tryptophan; 28: Arachidonic acid; 29: Cholesterol |
对取得的代谢组学数据进行了多变量数据分析,给药3天后血清代谢组学数据经PLSDA分析显示: 甘草昆布单煎提取物给药对代谢有明显影响,等剂量条件下,合煎提取物给药组介于单独给药的2组之间,并且从空间位置看,合煎提取物给药组靠近正常组,提示合煎提取物具有减弱对代谢影响的作用,图 4A。给药5天后血清代谢组学数据经PLSDA分析显示: 甘草昆布单煎提取物给药5天均对代谢有明显影响,等剂量条件下,合煎提取物对代谢也有明显影响,且比3天时影响较大。从空间位置看,合煎提取物给药组靠近昆布组,提示合煎提取物对大鼠代谢的影响可能主要来源于昆布,图 4E。
 |
Figure 4 The effects on the metabolic patterns of SD rats after administration with a single or mixed decoction of licorice and kelp. A,B,C,D: Three days; E,F,G,H: Five days. A,E: PLS-DA,groups of K,L,H,and normal control; B,F: OPLS,H and normal control; C,G: OPLS,K and normal control; D,H: OPLS,L and normal control). K: Kelp; L: Licorice; H: Licorice & kelp; C: Normal control |
为研究昆布、甘草单独煎煮浓缩成分给药和合 并煎煮浓缩成分给药对大鼠代谢功能的影响,采用OPLS结合S-plot方法对昆布、甘草影响的血清中小分子进行分析,分析和鉴定给药对血清中分子的影响。昆布、甘草单独煎煮浓缩成分给药和合并煎煮浓缩成分给药对大鼠血清中部分小分子均产生明显影响,见图 4。甘草昆布合煎组给药3天,引起三羧酸循环中间物水平 (图 5B)、支链氨基酸,如异亮氨酸、亮氨酸、缬氨酸 (图 5D) 水平明显降低。同时,引起脂肪酸水平上升,而脂肪酸及其共同代谢物3-羟基丁酸水平无明显变化 (图 5C),提示脂肪酸代谢受到抑制。另外,甘草昆布合煎液引起糖代谢中间物丙酮酸、乳酸浓度降低 (图 5A)。上述结果提示给药3天后能量代谢有减弱趋势。
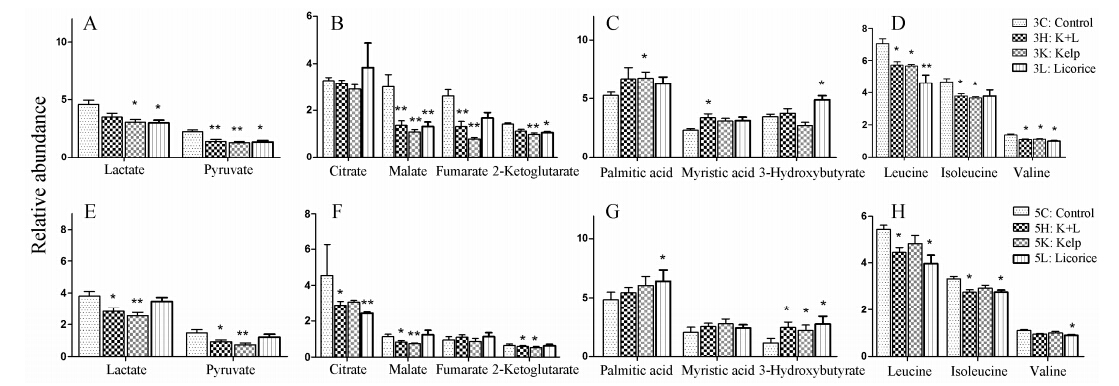 |
Figure 5 The typical molecules significantly perturbed in serum of rats treated with a single or mixed decoction of licorice and kelp for 3 days (A,B,C,D) and 5 days (E,F,G,H). P < 0.05,**P < 0.01 vs control group (one-way ANOVA). K: Kelp; L: Licorice; H: Licorice & kelp; C: Normal control |
从昆布、甘草单独煎煮浓缩成分给药和合并煎煮浓缩成分给药的对比结果看,单用昆布、甘草与二者合煎液用药对代谢的影响基本一致,主要表现在强弱有所不同。例如,昆布单煎液给药对三羧酸循环中间物水平影响更为明显 (图 5B),并造成脂肪酸水平上升和3-羟基丁酸水平较为明显的降低 (图 5C),提示昆布对脂肪酸分解代谢有较强抑制作用,甘草昆布合用后对三羧酸循环的抑制作用可能主要来源于昆布。相应地,虽然甘草单煎液给药组对三羧酸循环中间物以及脂肪酸水平影响较小,但更明显地降低了亮氨酸、丙氨酸和缬氨酸水平 (图 5D),同时升高了3-羟基丁酸水平,提示甘草具有增强脂肪酸氧化的作用。
对昆布、甘草分别单独煎煮和合煎组给药5天后数据分析发现: 合煎组对血清中小分子的影响与3天组基本一致。即: 给药5天后,三羧酸循环中间物水平 (图 5F)、支链氨基酸,如异亮氨酸、亮氨酸、缬氨酸 (图 5H) 水平降低。同时,糖代谢关键物质丙酮酸、乳酸浓度水平显著降低 (图 5E),提示与糖代谢相关的能量代谢水平下降。与3天组有所不同,合煎组给药5天后血清中脂肪酸水平未见明显升高,但脂肪酸共同代谢物3-羟基丁酸水平明显上升,提示连续5天给药后脂肪酸氧化有所加强 (图 5G)。上述结果提示给药5天后糖代谢、三羧酸循环代谢减弱,而脂肪酸代谢有加强趋势。
从昆布、甘草单独煎煮浓缩成分给药和合并煎煮浓缩成分给药5天的对比结果看,单用昆布、甘草与二者合煎液用药对代谢的影响仍然基本一致,但作用强弱不同。总体看昆布单煎液给药对糖代谢中间产物丙酮酸和乳酸,以及三羧酸循环中间物水平影响更加明显 (图 5E,F),提示甘草昆布合煎组对糖代谢和三羧酸循环抑制作用可能主要来源于昆布。相应地,虽然甘草单独给药组对丙酮酸、乳酸、三羧酸循环中间物影响较小,同3天时类似,甘草单独给药组更明显地降低了支链氨基酸水平 (图 5H)。 讨论
甘草、昆布中含有多类化学物质,其中甘草主要含有甘草酸、甘草次酸、甘草苷、甘草素、异甘草苷、异甘草素等成分,海藻主要包括藻胶素、海带聚糖、岩藻多糖等多种物质[11-14]。一些研究发现,这些成分不仅对CYP450酶代谢有影响[15,16],还对机体的糖脂代谢[17,18]、胰岛素分泌[19],以及NF-κb信号通路[20]产生影响,进而干扰体内正常代谢。现有给药剂量下,昆布、甘草分别单独煎煮和合煎提取物给药3、5天对SD大鼠系统代谢,特别是三羧酸循环、脂肪酸β氧化和糖代谢等能量代谢,产生了明显影响。组织切片染色观察发现: 在上述给药剂量下,三组提取物均未对肝组织与功能产生明显损害。但昆布与甘草合煎给药组肾脏出现病理异常,并较昆布给药组更为明显。提示一定剂量范围内甘草可加重昆布的肾脏毒性作用,可能与中药“相反”配伍禁忌的特征表现有关[21,22],其中机制有待于进一步研究。
昆布、甘草分别单独煎煮与合煎提取物给药对三羧酸循环、脂肪酸β氧化、支链氨基酸以及糖代谢中间物 (丙酮酸和乳酸) 均产生影响。给药3天与5天的总体影响基本一致。主要体现在支链氨基酸、三羧酸循环中间物和糖代谢中间物 (丙酮酸和乳酸) 水平的降低上 (图 5)。对比不同给药组 (昆布、甘草分别单独煎煮组和合煎组给药) 数据发现: 昆布降低三羧酸循环中间物和糖代谢中间物能力强于甘草以及合煎组,提示合煎组对大鼠血清糖代谢中间物、三羧酸循环中间物的影响可能主要来源于昆布。甘草给药组中支链氨基酸水平最低,提示甘草降低支链氨基酸水平较昆布与合煎组稍强。从给药时间 (3天与5天) 数据对比看,与对照组相比,3天时,昆布、甘草合煎组中脂肪酸水平较高 (3-羟基丁酸水平未见明显升高),而5天时脂肪酸水平虽未见明显升高,但脂肪酸共同代谢物-3-羟基丁酸水平明显升高,提示对脂肪酸β氧化代谢由抑制转向加强。
代谢组学研究发现昆布、甘草单煎与合煎提取 物给药均对SD大鼠代谢有明显影响,且合煎给药组与昆布组对机体代谢影响相似,提示合煎提取物对机体代谢的影响可能主要来源于昆布。病理切片观察发现昆布单煎及昆布-甘草合煎提取物连续给药均可造成肾脏损害,合煎给药较昆布单煎给药造成大鼠肾脏组织更明显的病理异常,说明一定剂量范围内甘草可加重昆布的肾脏毒性作用,可能是中药“相反”配伍禁忌的特征表现之一。
| [1] | Heng QQ, Xu L. Recent advances in toxicology studies on glycyrrhiza co-administered with Sargassum pallidum, Euphorbia pekinensis, Euphorbia kansui and Daphne genkwa [J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2013, 19: 348-352. |
| [2] | Xing SM, He XW. A combination usage of kelp and licorice in the management of clinic cases of mastopathy [J]. Chin J Pract Chin Mod Med (中华实用中西医杂志), 2000, 1: 2680. |
| [3] | Yang KW. A clinical case of the adverse reaction for a combination use of kelp and licorice [J]. J Tradit Chin Med (中医杂志), 1990, 6: 58. |
| [4] | Guan TZ. An experimental study on glycyrrhia co-administered with Sargassum pallidum, Euphorbia pekinensis, Euphorbia kansui and Daphne genkwa [J]. J Henan Coll Tradit Chin Med (河南中医药学刊), 1995, 10: 13-14. |
| [5] | Ding AH, Hua YQ, Hong M, et al. Effect of incompatible combination of Glycyrrhizae Radix et Rhizoma with Sargassum on rat isolated ileal contraction and small intestinal propulsion in mice [J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2014, 29 : 87-90. |
| [6] | Heng QQ, Bian Y, Li L, et al. Effect of Radix et Rhizoma Glycyrrhizae co-administered with Sargassum pallidum, Radix Euphorbiae Pekinensis, Euphorbiae Kansui Radix and Flos Genkwa on mouse intestinal function [J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2013, 27: 374-378. |
| [7] | Ji ML, Xu R, Wang M, et al. Acute toxicity studies of different compatibility ratio of Sargassum and Glycyrrhiza in Mice [J]. J Nanjing Univ Tradit Chin Med (南京中医药大学学报), 2012, 28: 452-456. |
| [8] | A JY, Trygg J, Gullberg J, et al. Extraction and GC/MS analysis of the human blood plasma metabolome [J]. Anal Chem, 2005, 77: 8086-8094. |
| [9] | Yan B, A JY, Hao H, et al. Metabonomic phenotype and identification of "heart blood stasis obstruction pattern" and "qi and yin deficiency pattern" of myocardial ischemia rat models [J]. Sci China Ser C Life Sci, 2009, 52: 1081-1090. |
| [10] | Yan B, A JY, Hao H, et al. Evaluation of myocardial ischemia rat model based on metabonomic method of small molecule metabolites of plasma and cardiac muscle [J]. Acta Pharm Sin (药学学报), 2013, 48: 104-112. |
| [11] | Liu YC, Chen YG, Wand D, et al. Studies on chemical constituents on roots of Glycyrrhiza uralensis [J]. Chin J Pharm Anal (药物分析杂志), 2011, 31: 1251-1255. |
| [12] | Zhu LQ, He W, Yuan WR. Advancement in research on the chemical components and pharmacological effects of Thallus Laminariae [J]. Food Drug (食品与药品), 2006, 8: 9-12. |
| [13] | Zeng L, Lou ZC, Zhang RY. Quality evaluation of Chinese licorice [J]. Acta Pharm Sin (药学学报), 1990, 26: 788-793. |
| [14] | Xu SH, Cen YZ, Liu MZ, et al. Isolation and edentification of two new constituents from Algae [J]. Acta Pharm Sin (药学学报), 2000, 35: 26-28. |
| [15] | Zhao K, Ding M, Cao H, et al. In-vitro metabolism of glycyrrhetinic acid by human and rat liver microsomes and its interactions with six CYP substrates [J]. J Pharm Pharmacol, 2012, 64: 1445-1451. |
| [16] | Huang YP, Cao YF, Fang ZZ, et al. Glycyrrhetinic acid exhibits strong inhibitory effects towards UDP-Glucuronosyltransferase (UGT) 1A3 and 2B7 [J]. Phytother Res, 2013, 27: 1358-1361. |
| [17] | Moon MH, Jeong JK, Lee YJ, et al. 18β-Glycyrrhetinic acid inhibits adipogenic differentiation and stimulates lipolysis [J]. Biochem Biophys Res Commun, 2012, 420: 805-810. |
| [18] | Liang XG, Du XX, Pan QX. Study on the mechanism of laminarin sulfate in the prevention of experimental atherosclerosis [J]. Chin J Marine Drugs (中国海洋药物), 2002, 21: 26-30. |
| [19] | Constantinidis I, Rask I, Long Jr R C, et al. Effects of alginate composition on the metabolic, secretory, and growth characteristics of entrapped βTC3 mouse insulinoma cells [J]. Biomaterials, 1999, 20: 2019-2027. |
| [20] | Chen HJ, Kang SP, Lee IJ, et al. Glycyrrhetinic acid suppressed NF-κB activation in TNF-α-induced hepatocytes [J]. J Agric Food Chem, 2014, 62: 618-625. |
| [21] | Duan JA, Su SL, Fan XS, et al. Explore the action patterns and mechanisms of traditional Chinese medicine incompatibility of Qi-Qing antagonism and mutual inhibition/restraint based on drug interaction [J]. World Sci Technol (Mod Tradit Chin Med Mater Med) (世界科学技术—中医药现代化), 2012, 14: 11-16. |
| [22] | Wang JB, Ma YG, Zhang P, et al. Effect of processing on the chemical contents and hepatic and renal toxicity of rhubarb studied by canonical correlation analysis [J]. Acta Pharm Sin (药学学报), 2009, 44: 885-890. |
 2015, Vol. 50
2015, Vol. 50


