Caspase家族为天冬氨酸蛋白酶家族,主要功能是参与细胞凋亡通路,是细胞凋亡的执行者[1,2]。在死亡受体介导的外源性凋亡通路中,Caspase-8发挥着重要作用[3,4]。Caspase-8酶原的显著特点是在其N端有2个70 aa左右的结构域,与Fas相关死亡结构域蛋白 (Fas-associated death domain protein,FADD) N端的死亡效应结构域 (death effector domain,DED) 同源,这种同源的死亡效应结构域之间可以发生相互聚合,提供了Caspase-8与FADD相互结合的一个部位[5]。Caspase-8酶原激活后能够激活细胞中其他Caspase家族成员,如Caspase-3和Caspse-7的活化过程都有Caspase-8参与。活化的Caspase-3又能进一步激活下游其他Caspase,从而导致细胞凋亡[6]。在凋亡过程中,Caspase-8通过其N端的DED结构域与FADD相互结合,间接与细胞膜受体发生联系,从而将细胞膜事件转化为细胞浆事件。因此,Caspase-8在外源性死亡受体介导的凋亡通路信号传导中以及细胞凋亡执行中都具有重要的作用 (图 1)。
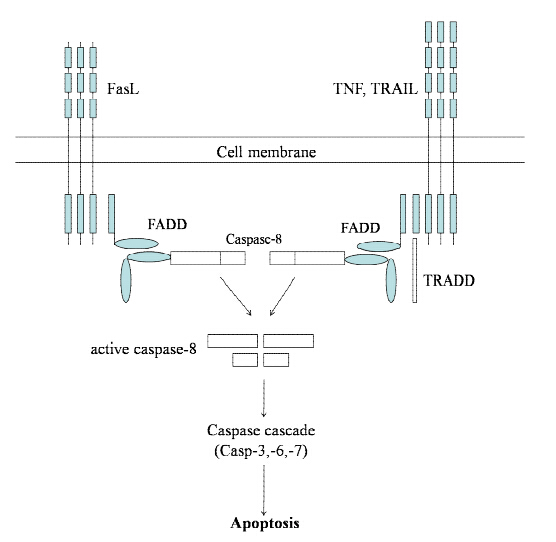 |
Figure 1 The role of Caspase-8 in the extrinsic cell apoptosis pathway mediated by death receptor |
荧光共振能量转移技术 (fluorescence resonance energy transfer,FRET) 是一种检测两个荧光分子之间非放射性的能量转移的技术[7,8],FRET的产生依赖于这两个荧光基团之间的物理距离。当发生FRET的两个荧光蛋白之间距离小于或等于10 nm时,发生高FRET效率; 当它们距离大于10 nm时,则不发生FRET。此技术的发现使得在生命科学研究中发展出一系列的相关技术[9,10,11]。例如,FRET能够用来检测分子内或分子间的相互作用[12,13,14]; 基于蛋白酶类的FRET能够用来测定蛋白酶的活性[15,16]: 即在两个能够发生FRET的荧光蛋白之间引入特定的蛋白酶识别酶切位点,通过蛋白酶的切割使得FRET从强到弱、甚至从有到无的变化,从而检测蛋白酶的活性。用于测定FRET效率的传统检测平台有荧光显微镜以及活细胞工作站,该检测方法对单细胞中FRET荧光效率变化具有很好的测定效果[17,18],但对于测定细胞群体FRET水平的变化则有一定的局限性。因此,基于流式细胞仪平台的荧光共振能量转移 (flow cytometric FRET,FCET) 应运而生[19,20],FCET能够在整体细胞水平测定细胞中FRET效率的变化,并进行定量分析,这为FRET技术的运用开辟了更广阔的前景[21,22]。
本文基于蛋白酶类FRET原理设计了一种在活细胞中检测Caspase-8活性的荧光探针EBFP2-C8- EGFP。在该探针的设计中,结合本实验室流式细胞仪的硬件条件,选用了常用的FRET发生荧光蛋白对蓝色荧光蛋白 (enhanced blue fluorescent protein,EBFP2) 和绿色荧光蛋白 (enhenced green fluorescent protein,EGFP) 分别作为FRET的供体和受体,EBFP2和EGFP之间插入Caspase-8的酶切识别切割位点IETDGGIETD (简称为C8位点)。当Caspase-8没有被激活时,FRET供受体荧光蛋白之间不发生切割,为一个完整的融合蛋白,表现为高FRET效率; 当Caspase-8被激活时,C8位点被切割,两个荧光蛋白分离,FRET效率急剧下降 (图 2)。利用流式细胞FRET检测系统对FRET效率进行测定,蛋白酶切割探针引起的FRET消失在细胞整体水平上表现为高FRET效率细胞群的比例下降。因此可以通过测定高FRET效率细胞群的变化来表征相应的蛋白酶是否被激活。
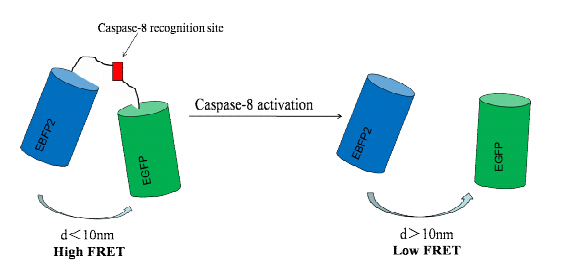 |
Figure 2 Schematic principle of Caspase-8 activity detection based on protease fluorescence resonance energy transfer (FRET) |
真核表达载体pEGFP-C1由本实验室保存,EBFP2基因由南京金斯瑞生物科技公司合成并保存于pUC57中; 克隆构建用菌株大肠杆菌Top10由本实验室保存,克隆构建所用分子生物学工具酶购于TAKARA公司; 引物合成和测序服务均由南京金斯瑞生物科技公司完成; 细胞凋亡诱导剂RGD-TRAIL[23] (the tumor-targeted TNF relate d apoptosis inducing ligand,TRAIL) 由本实验室提供; Caspase-8抑制剂z-IETD- FMK购于BD PharMingen (La Jolla,CA)。 探针克隆构建
以5'-CTAGCTAGCGCTACCGG TCGCCACCATGGTGAGCAAGGGC-3' 和5'-CCCAA GCTTGAGCTCGAGATCTGAGTCCGGACTTGTACA GCTCGTC-3' 为上下游引物,以pUC57-EBFP2为模板,经常规的PCR反应获得两端含NdeⅠ和Hind Ⅲ酶切位点的EBFP2基因片段。利用NdeⅠ/Hind Ⅲ双酶切PCR获得的EBFP2基因片段和pEGFP-C1载体,用T4 DNA连接酶连接回收的双酶切后的载体DNA和EBFP2基因片段。连接产物转化到大肠杆菌Top10感受态菌株,涂布卡那霉素抗性LB平板,37 ℃过 夜培养,经菌落PCR筛选出阳性克隆后进行DNA 测序分析鉴定。DNA序列分析完全正确的克隆即为将pEGFP-C1载体中EGFP基因置换为EBFP2的pEBFP2-C1真核表达质粒,该克隆构建中除了将EGFP置换成EBFP2外,表达载体的其他任何部分都没有发生改变 (图 3)。
 |
Figure 3 The cloning schematic of Caspase-8 activity detection probe |
以5'-GAAGATCTGGCGGCATCGAGACCGAC GGCGGCATCGAGACCGACGGCGGCTCTATGGTG AGCAAGGGC-3' 和5'-CCCAAGCTTGCTTGTACAG CTCGTC-3' 为上下游引物,以pEGFP-C1为模板,经PCR反应扩增出两端含Bgl Ⅱ和Hind Ⅲ酶切位点、N段带有Caspase-8酶切位点IETDGGIETD的EGFP基因片段。该基因片段经双酶切后,用T4 DNA连接酶连接到经同样双酶切过的pEBFP2-C1载体片段中,连接产物转化大肠杆菌TOP10感受态中,涂布卡那霉素LB平板,37 ℃过夜培养后,挑取单克隆进行菌落PCR鉴定,阳性克隆送测序鉴定。测序正确后提取重组质粒即可获得含有Caspase-8识别位点的荧光检测探针EBFP2-C8-EGFP的真核表达质粒 (图 3)。
以5'-GAAGATCTGGCGGCTCTGGCGGCTCTG GCGGCTCTGGCGGCTCTGGCGGCTCTATGGTGAGCAAGGGC-3' 和5'-CCCAAGCTTGCTTGTACAGC TCGTC-3' 为上下游引物,以pEGFP-C1为模板,经PCR反应扩增出两端含有Bgl Ⅱ和Hind Ⅲ酶切位点、但不含有Caspase-8识别位点的EGFP基因片段, 将该片段克隆到pEBFP2-C1载体中,获得FRET阳性探针EBFP2-EGFP的表达质粒 (图 3)。
将上述pEBFP2-C1、pEGFP-C1、EBFP2-EGFP和EBFP-C8-EGFP真核表达质粒进行大量制备以备后续的细胞转染实验。 用于FRET测定的流式细胞仪分析条件
采用搭载BD FACSDiva software控制软件的BD FACSAriaTM Ⅱ special order system型号的流式细胞仪平台,根据所用荧光蛋白的荧光特性,采用355 nm氪离子激发通道以及488 nm氩离子激发通道。在355 nm激发通道中,利用带通450/50和530/30分别检测EBFP2荧光信号和EBFP2到EGFP的FRET信号; 在488 nm激发通道中,用带通530/30检测EGFP荧光信号。 细胞凋亡诱导检测
采用Caspase-8特异激活的凋亡诱导剂RGD-TRAIL对目的细胞MCF-7进行凋亡诱导。利用Caspase-8特异活性抑制剂Z-IETD-FMK抑制RGD-TRAIL诱导的细胞凋亡。利用Annexin Ⅴ-EGFP/PI双标法进行凋亡效率的检测。
MCF-7细胞以适量细胞密度接种于12孔板中,过夜培养后,细胞均分为3组,分别用磷酸缓冲液(phosphate buffer solution,PBS,pH 7.4)、50 ng·µL-1 RGD-TRAIL及50 ng·µL-1 RGD-TRAIL + 20 µmol·L-1 Caspase-8抑制剂Z-IETD-FMK处理细胞,12 h后胰酶消化收集细胞,双标Annexin Ⅴ-EGFP和PI后,利用流式细胞仪进行常规凋亡检测。 FRET变化测定
为验证实验中设计的Caspase-8活性检测探针是否能够响应细胞中Caspase-8活性变化,利用RGD-TRAIL[24]诱导转染有真核表达质粒探针的细胞凋亡,测定细胞中FRET效率是否会发生变化。另外本文在RGD-TRAIL诱导细胞凋亡的同时加入Caspase-8的活性抑制剂Z-IETD-FMK,以此验证Caspase-8诱导的FRET变化是否能够被Caspase-8抑制剂Z-IETD-FMK所逆转或恢复,从而证明检测到FRET变化是依赖于Caspase-8的激活、即Caspase-8特异性切割引发的。
MCF-7细胞接种于6孔培养板,每孔3×105个 细胞,共12孔。培养过夜后,利用PolyJetTM体外 细胞转染试剂转染含有Caspase-8检测探针EBFP2- C8-EGFP的表达质粒。转染后的细胞平均分为3 组,每组4个复孔。转染24 h后,3组分别处理如 下: PBS处理、50 ng·µL-1 RGD-TRAIL及50 ng·µL-1 RGD-TRAIL + 20 µmol·L-1 Caspase-8抑制剂Z-IETD- FMK。12 h后胰酶消化、收集细胞制备单悬液,利用流式细胞仪FRET测定系统进行FRET测定。 数据分析和处理
流式细胞仪测定结果均用FlowJo 7.6.1流式分析软件进行后续分析,结果用GraphPad Prism 5统计软件作图分析,所有结果采用平均数 ± 标准误 (x± s),采用双尾t检验,P < 0.05认为有统计学显著性差异。采用相对FRET效率评价FRET效率: 利用阴性对照确定FRET阳性细胞群后,FRET效率表示在发生FRET的两个荧光蛋白的双阳性细胞群中FRET阳性细胞所占的比例。 结果 1 表达质粒的克隆构建
构建完成的Caspase-8检测FRET荧光探针EBFP2-C8-EGFP及其FRET阳性对照的真核表达质粒的开放阅读框如图 4所示,图中IETDGGITEG为Caspase-8的识别切割位点,而在FRET阳性对照探针中用柔性连接肽SGGSGGSGGS代替该酶切识别切割位点,使得荧光蛋白变为长度相同、但不能被切割的融合蛋白。整个融合蛋白基因片段大约为1 500 bp左右,在细胞中表达为60 KDa左右融合蛋白。
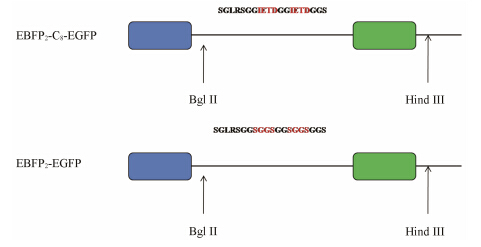 |
Figure 4 The molecular structure of Caspase-8 activity detection FRET probe and its FRET positive. IETD is the recognition sequence and cleavage site of Caspase-8,and SGGS is a flexible linker peptide sequence between the two fluorescent proteins |
从凋亡测定流式结果来看 (图 5),相对于PBS处理组,RGD-TRAIL组细胞凋亡率更高,而且在RGD- TRAIL诱导的同时加入Caspase-8活性抑制剂时,凋亡的诱导率又会降低。结果表明: MCF-7细胞对RGD- TRAIL的诱导敏感,并且RGD-TRAIL的凋亡诱导效率能够被Caspase-8活性抑制剂所逆转。
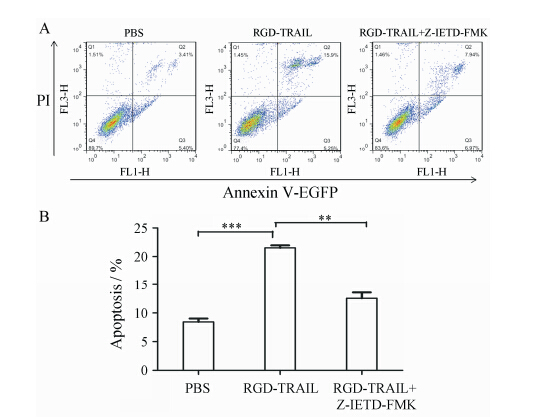 |
Figure 5 Apoptosis detection result by flow cytometry. A: Flow cytometric assay of MCF-7 cell treated with PBS,50 ng·µL-1 RGD-TRAIL and 50 ng·µL-1 RGD-TRAIL along with 20 µmol·L-1Z-IETD-FMK. B: Statistical analysis of MCF-7 treated with apoptosis inducer. n = 4,x± s. **P < 0.01,***P < 0.001. PBS: Blank group; RGD-TRAIL: Targeted TNF related apoptosis inducing ligand variant as the apoptosis inducer; Z-IETD-FMK: Inhibitor of Caspase-8 |
从实验测定结果 (图 6) 可知,在对转染有Caspase-8活性FRET检测探针的细胞进行细胞凋亡诱导时,相对于PBS处理组,RGD-TRAIL诱导细胞凋亡可导致FERT效率显著下降 (87.6% vs 33.5%); 当在RGD-TRAIL进行细胞凋亡诱导的同时加入Caspase-8活性抑制剂Z-IETD-FMK时,FRET效率的下降会受到明显的抑制,在抑制剂和凋亡诱导剂同时存在时,FRET效率为84.5%,基本恢复到PBS条件下的水平(87.6%),并且这些变化具有统计学差异。FRET检测Caspase-8活性的实验结果与直接检测细胞凋亡的结果一致,从而证明了FRET检测Caspase-8活性方法 的可信性。综上,FRET的变化是由RGD-TRAIL通过激活Caspase-8而作用于探针中Caspase-8的酶切位点引发的,而且这种作用能够被Caspase-8特异性抑制剂所逆转。因此,可以用FRET效率的高低来评价细胞内Caspase-8活性高低,它们之间呈负相关。
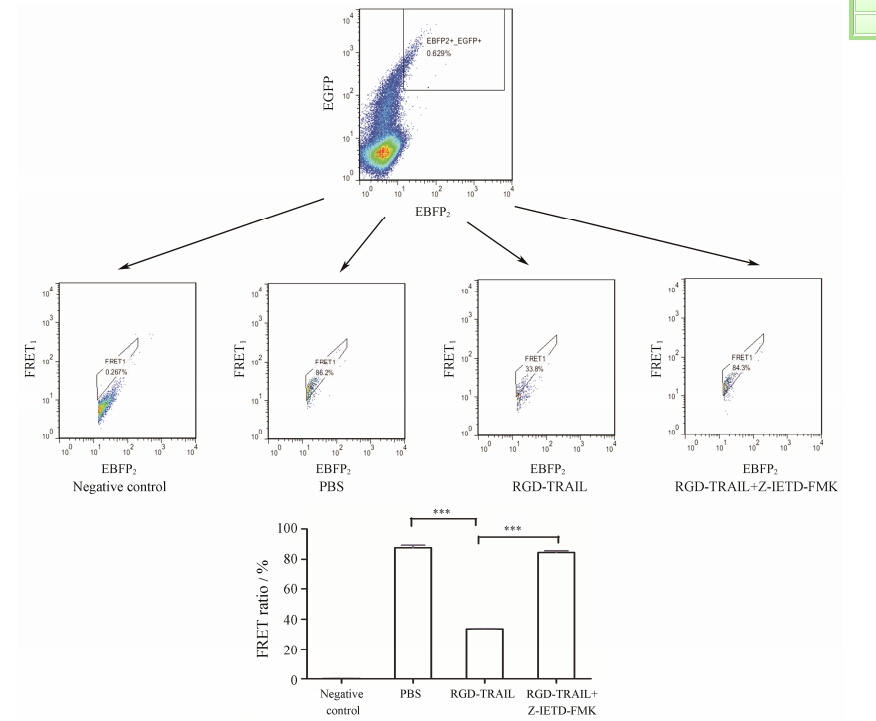 |
Figure 6 Result of FRET efficiency change in apoptosis induced cells by RGD-TRAIL and its inhibition by Caspase-8 activity inhibitor. All the date got from flow cytometer are analyzed by software FlowJo7.6.1. n = 4,x± s. ***P < 0.001 |
FRET是一种应用于活细胞生理条件下实时研究蛋白质之间相互作用的技术,根据FRET原理设计的荧光探针在生命科学研究中日益受到关注,具有广阔的运用前景,而流式细胞术因其高通量检测的特点在生命科学与医学研究中也发挥着重要作用。本文结合了荧光共振能量转移技术及流式细胞术,设计了一个能够检测活细胞中Caspase-8活性的FRET荧光探针,利用流式细胞仪平台在细胞群体水平上测定FRET效率的变化。流式细胞仪平台的运用一定程度上解除了FRET测定对荧光显微镜及活细胞工作站的依赖,使得FRET技术的运用更加广泛。
本文设计的Caspase-8活性检测探针结构为EBFP2-IETDGGIETD-EGFP,其中IETDGGIETD为Caspase-8的酶切识别切割位点。当细胞中转染含有该探针的真核表达质粒时,其表达为一个融合荧光蛋白。在细胞内Caspase-8没有被激活的情况下,融合荧光蛋白保持完整,细胞整体表现为高FRET荧光信号; 而当细胞中Caspase-8被激活、从而切割了荧光蛋白之间的C8酶切位点时,细胞则表现为低的FRET荧光信号。为了验证所构建的FRET探针在Caspase-8活性检测上的有效性,利用特异性激活死亡受体Caspase-8通路的细胞凋亡诱导药物RGD-TRAIL对细胞进行凋亡诱导,利用流式细胞仪可以检测到具有高FRET信号的FRET阳性细胞群是否会因为Caspase-8激活后切割荧光探针而数量减少; 为了进一步验证RGD-TRAIL诱导的FRET阳性细胞群数量减少是由于Caspase-8激活导致切割荧光探针而产生的,作者又利用Caspase-8酶抑制剂Z-IETD-FMK恢复RGD- TRAIL诱导的FRET阳性细胞群数量的降低。结果表明,相对于PBS处理组,RGD-TRAIL细胞凋亡诱导组中FRET阳性细胞群急剧减少,而在RGD-TRAIL诱导细胞凋亡的同时加入Caspase-8酶抑制剂Z- IETD-FMK则能够逆转这种变化。而且,这种利用FRET信号检测的结果与传统的直接检测细胞凋亡的结果相一致。综上所述,本文所设计的FRET探针对Caspase-8活性检测具有良好的有效性和特异性,能够对活细胞内Caspase-8活性变化进行有效测定。将该检测探针与流式细胞仪FRET测定平台相结合,可以实现死亡受体介导的细胞凋亡途径中Caspase-8活性的快速、简便、高通量化的检测,从而为Caspase-8抑制剂类药物提供了一个快速、高通量的筛选平台。
鉴于Caspase-8在细胞凋亡信号通路中的重要 性,已有多种常规的Caspase-8活性检测方法,如Western blotting、荧光底物检测技术等。但其检测过程繁琐,首先需要对细胞进行裂解、而且都不能在完整细胞水平进行实时、快速测定。因此,本文所设计的Caspase-8荧光检测探针为在活细胞水平上动态测定Caspase-8活性及其相关抑制剂药物的筛选提供了一个有效工具,将Caspase-8荧光检测探针与流式细胞仪平台相结合,使得该检测方法克服了常规的必须利用荧光显微镜进行FRET检测的局限,使得检测过程简单、易于操作,使高通量测定和筛选成为可能。并为设计其他相关的检测探针提供了一个可行 性思路。
| [1] | Cohen GM. Caspases: the executioners of apoptosis [J]. Biochem J, 1997, 326: 1-16. |
| [2] | Kumar S, Vaux DL. Apoptosis. A cinderella caspase takes center stage [J]. Science, 2002, 297: 1290-1291. |
| [3] | Siegmund D, Mauri D, Peters N, et al. Fas-associated death domain protein (FADD) and caspase-8 mediate up-regulation of c-Fos by Fas ligand and tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) via a FLICE inhibitory protein (FLIP)-regulated pathway [J]. J Biol Chem, 2001, 276: 32585-32590. |
| [4] | Shi Y. Mechanisms of caspase activation and inhibition during apoptosis [J]. Mol Cell, 2002, 9: 459-470. |
| [5] | Fesik SW, Shi Y. Structural biology. Controlling the caspases [J]. Science, 2001, 294: 1477-1478. |
| [6] | Siegel RM, Martin DA, Zheng L, et al. Death-effector filaments: novel cytoplasmic structures that recruit caspases and trigger apoptosis [J]. J Cell Biol, 1998, 141: 1243- 1253. |
| [7] | Periasamy A, Vogel SS, Clegg RM. FRET 65: a celebration of Forster [J]. J Biomed Opt, 2012, 17: 011001. |
| [8] | Sun Y, Wallrabe H, Seo SA, et al. FRET microscopy in 2010: the legacy of Theodor Forster on the 100th anniversary of his birth [J]. Chemphyschem, 2011, 12: 462-474. |
| [9] | Aoki K, Komatsu N, Hirata E, et al. Stable expression of FRET biosensors: a new light in cancer research [J]. Cancer Sci, 2012, 103: 614-619. |
| [10] | Day RN, Davidson MW. Fluorescent proteins for FRET microscopy: monitoring protein interactions in living cells [J]. Bioessays, 2012, 34: 341-350. |
| [11] | Bhabak KP, Hauser A, Redmer S, et al. Development of a novel FRET probe for the real-time determination of ceramidase activity [J]. Chembiochem, 2013, 14: 1049-1052. |
| [12] | Bogolyubova I, Stein G, Bogolyubov D. FRET analysis of interactions between actin and exon-exon-junction complex proteins in early mouse embryos [J]. Cell Tissue Res, 2013, 352: 277-285. |
| [13] | Chen WD, Gong WT, Ye ZQ, et al. FRET-based ratiometric fluorescent probes for selective Fe3+ sensing and their applications in mitochondria [J]. Dalton Trans, 2013, 42: 10093-10096. |
| [14] | Gau D, Ding Z, Baty C, et al. Fluorescence resonance energy transfer (FRET)-based detection of profilin-VASP interaction [J]. Cell Mol Bioeng, 2011, 4: 1-8. |
| [15] | Gorman AM, Hirt UA, Zhivotovsky B, et al. Application of a fluorometric assay to detect caspase activity in thymus tissue undergoing apoptosis in vivo [J]. J Immunol Methods, 1999, 226: 43-48. |
| [16] | Harbaugh SV, Chapleau ME, Chushak YG, et al. FRET-based optical assay for selection of artificial riboswitches [J]. Methods Mol Biol, 2014, 1111: 77-91. |
| [17] | Prasad S, Zeug A, Ponimaskin E. Analysis of receptor- receptor interaction by combined application of FRET and microscopy [J]. Methods Cell Biol, 2013, 117: 243-265. |
| [18] | Angres B, Steuer H, Weber P, et al. A membrane-bound FRET-based caspase sensor for detection of apoptosis using fluorescence lifetime and total internal reflection microscopy [J]. Cytometry A, 2009, 75: 420-427. |
| [19] | Nagy P, Vereb G, Damjanovich S, et al. Measuring FRET in flow cytometry and microscopy [J]. Curr Protoc Cytom, 2006, doi: 10.1002/0471142956.cy1208s38. |
| [20] | Szalóki N, Doan-Xuan QM, Szöllösi J, et al. High throughput FRET analysis of protein-protein interactions by slide-based imaging laser scanning cytometry [J]. Cytometry A, 2013, 83: 818-829. |
| [21] | Vereb G, Nagy P, Szollosi J. Flow cytometric FRET analysis of protein interaction [J]. Methods Mol Biol, 2011, 699: 371-392. |
| [22] | He L, Wu X, Meylan F, et al. Monitoring caspase activity in living cells using fluorescent proteins and flow cytometry [J]. Am J Pathol, 2004, 164: 1901-1913. |
| [23] | Cao L, Du P, Jiang SH, et al. Enhancement of antitumor properties of TRAIL by targeted delivery to the tumor neovasculature [J]. Mol Cancer Ther, 2008, 7: 851-861. |
| [24] | Cretney E, Takeda K, Smyth MJ. Cancer: novel therapeutic strategies that exploit the TNF-related apoptosis-inducing ligand (TRAIL)/TRAIL receptor pathway [J]. Int J Biochem Cell Biol, 2007, 39: 280-286. |
 2015, Vol. 50
2015, Vol. 50


