2. 沈阳药科大学药学院, 辽宁 沈阳 110016
2. School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China
聚乙二醇 (polyethylene glycol,PEG) 具有水溶性、柔顺性、无毒、免疫原性低和可生物降解等优点,20世纪90年代开始研究人员将PEG-脂质修饰于脂质体表面,称为PEG化脂质体 (PEGylated liposomes)。PEG可以在脂质体表面形成“构象云”和水化膜,为脂质体提供较大的空间位阻并掩盖其表面疏水性结合位点,使脂质体的理化稳定性得到改善,同时降低单核巨噬细胞系统 (mononuclear phagocyte system,MPS) 的识别和摄取,延长脂质体的体内循环时间[1, 2],并能针对肿瘤血管的特殊结构通过“增强的渗透与滞留” (enhanced permeability and retention,EPR) 效应将直径小于200 nm的脂质体被动蓄积于肿瘤组织中[3, 4]。
虽然PEG在修饰脂质体方面显示出诸多优点,但随着研究的深入,PEG化 (PEGylation) 产生了相应的问题: ① PEG链的空间位阻作用抑制靶细胞对脂质体的摄取[5, 6]; ② PEG妨碍携载基因、蛋白类药物的pH敏感脂质体 (pH-sensitive liposomes,PSL) 的“核内体逃逸” (endosomal escape),导致该类药物在溶酶体内降解失效[7, 8]; ③ 同一动物体内重复注射PEG化脂质体诱发“加速血液清除”(accelerated blood clearance,ABC) 现象[9, 10],这一系列负面影响被称之为PEG“窘境”(PEG dilemma)[11, 12, 13, 14]。PEG “窘境”为PEG化脂质体的发展带来了严峻的挑战。本文从PEG“窘境”产生的机制入手,介绍了几种克服PEG“窘境”的方法,希望在保证PEG化脂质体优势的同时减弱或克服PEG“窘境”。
众所周知,由配体或其他主动靶向因子修饰的脂质体通过内吞作用被摄取进入细胞[15, 16, 17],而肿瘤细胞却不能通过被动扩散摄取细胞内靶向的核酸、蛋白质和肽类等药物,因此脂质体有效的细胞摄取是保证该类药物制剂产生药效的前提条件,但是应用最多的修饰脂质体的常规PEG-脂质会对脂质体的细胞摄取产生阻碍作用,可能的原因如下: ① 常规PEG脂质如PEG-二硬脂酰磷脂酰乙醇胺 (PEG-distearoyl phosphatidyl ethanolamine,PEG-DSPE)、PEG-胆固醇 (PEG-CHOL),连接PEG与脂质之间的化学键为化学稳定性较高的酰胺键或醚键,不易降解[18]; ② PEG分子中存在长链极性基团乙氧基,能与水分子形成氢键,将其修饰在脂质体表面后,可以在脂质体表面形成一层水化膜[19, 20, 21]; ③ 由于PEG的链段较短,各链节可以自由内旋转使其具有较大的柔性,将一定密度的PEG-脂质修饰在脂质体表面后,可在其表面形成毛刷状、蘑菇状“构象云”[19, 20, 21]。稳定的连接键、水化膜和构象云在保证脂质体的长循环性和肿瘤蓄积量的同时,也阻碍了靶细胞对脂质体的内吞和摄取,从而降低药效[7, 8],引发PEG化脂质体细胞摄取困难。
核酸、蛋白质和肽类等新型抗癌药物在被肿瘤细胞摄取后,会在溶酶体发生消化代谢,失去抗癌活性,因此研究人员尝试采用PSL包封药物,期待在核内体的低pH (5.0~6.5) 条件下PSL可以与核内体膜融合,发生“核内体逃逸”,将生物活性分子直接释放至胞浆[22],避免溶酶体的降解。然而普通PSL稳定性较低,当以常规PEG脂质修饰PSL时,虽然PSL的稳定性得以提高,当其被内吞摄取进入细胞后,由于PEG的存在影响PSL与核内体膜的融合,从而阻碍药物释放到胞浆,无法实现“核内体逃逸”。
当向同一动物体内间隔一定时间重复注射PEG化脂质体时,二次注射的PEG化脂质体体内循环时间显著降低,肝、脾的聚集量增加,这种现象称为ABC现象[23]。ABC现象产生的机制可能为首次注射的PEG化脂质体刺激脾脏边缘区特异性B细胞分泌“抗-PEG IgM”,该特异性抗体与二次注射的脂质体表面的PEG结合,随后激活补体系统,加快MPS对二次注射脂质体的摄取,使其快速从血液中清 除[23, 24]。本课题组曾系统比较磷脂类型 (大豆磷脂、蛋黄磷脂、氢化磷脂和鞘磷脂) 和动物模型 (大鼠、小鼠、家兔、豚鼠) 对ABC现象的影响,发现不同磷脂类型制备的PEG化脂质体和不同的动物模型都可以产生ABC现象[25],研究人员发现恒河猴、比格犬重复注射PEG化脂质体也都会产生明显的ABC现象[26& #8722;29],因此PEG化脂质体的ABC现象可能是一种广泛存在于生物体中的免疫现象。在临床使用时,PEG化脂质体往往需要重复注射,因此ABC现象在其临床应用中是一个重大缺陷。
脂质体表面PEG的密度越高,空间位阻越大,细胞摄取量越低,“核内体逃逸”越困难。Kuai等[30]分别考察不同摩尔比例 (2%、4%、6%、8% 和10%) PEG化脂质体的细胞摄取量。结果显示,随着PEG-脂质比例的增加,脂质体的细胞摄取量逐渐降低,摩尔比2% 的PEG-脂质修饰脂质体细胞的摄取量最高。Song等[31]研究了PEG-脂质的比例对脂质体“核内体逃逸”的影响。结果表明,与摩尔比5%的PEG化载药脂质体相比,非PEG修饰的载药脂质体转染率明显提高。激光共聚焦显微镜 (laser scanning confocal microscope,LSCM) 结果显示,PEG化脂质体的荧光信号定位于溶酶体,细胞核无荧光信号,而非PEG修饰的载药脂质体荧光信号定位于细胞核,PEG的存在阻碍了脂质体的“核内体逃逸”。
Chan等[32]分别考察不同比例的不可断裂 (PEG2K) 和腙键可断裂PEG-脂质 (HPEG2K) 修饰脂质体的基因转染率,随着两种PEG-脂质摩尔比例的增加,脂质体的基因转染率均明显降低。作者认为,导致这一现象的原因是当PEG-脂质的摩尔比例增加到10% 时,PEG在脂质体表面形成“刷子状”空间位阻,有效屏蔽脂质体与细胞膜和核内体膜间的相互作用,成为限制基因转染率的主要障碍。由此可见,降低脂质体表面PEG的密度可以增加脂质体的细胞摄取量并提高其“核内体逃逸”的能力。近年来研究者通过在脂质体表面修饰可断裂PEG-脂质来达到此目的。
可断裂PEG-脂质[18]的作用机制是通过改变PEG与脂质之间的化学键,利用人的生理或病理条件使PEG链在循环过程中或到达靶部位后从脂质体表面脱落,降低脂质体表面PEG的密度和其产生的空间位阻,提高脂质体被摄取进入细胞的量。可断裂PEG-脂质间的化学键大多为腙键[32]、肽键[33, 34]、酯键[35, 36]和二硫键[30, 37]等,断裂方式有酸解、酶解和硫解等。
酸解 Chan等[32]合成对酸不稳定含酰腙基的PEG-脂质,并将其修饰在负载DNA复合物的阳离子脂质体上,构建酸敏可断裂PEG化脂质体。该脂质体在生理pH条件下稳定,内吞摄入细胞后,在晚期核内体中 (pH 4~5) 腙键断裂,PEG从脂质体表面脱落,同时以静电作用的方式促进脂质体膜与核内体膜融合,发生“核内体逃逸”,释放药物进入胞浆,提高基因转染率。国内也有研究者对酸敏感PEG脂质进行过研究[38],以磷酰胺键连接PEG和棕榈酰油酰甘油磷脂酸 (palmitoyl oleoyl glycerol phosphatidic acid,POPA),在酸性条件下,磷酰胺键不稳定、易水解,在发生键断裂后,游离出来的POPA使脂质体磷脂双分子层结构发生破坏,导致药 物的释放。
酶解 多种类型的肿瘤均会过度表达基质金属蛋白酶 (matrix metalloproteinase,MMP),因此Wan等[33]利用MMP与其底物肽反应,构建一种酶应答的可断裂脂质 [PEG/matrix metalloproteinase (MMP)- substrate peptide/cholesterol,PPC],将该PEG-脂质修饰于包封腺病毒的阴离子脂质体上,结果显示,在表达MMP-2的人纤维肉瘤HT1080细胞内可断裂PEG-脂质修饰脂质体的转染率高于不可断裂组,说明在MMP存在下该酶应答的可断裂键发生断裂,减弱了PEG产生的空间位阻,增加了细胞对脂质体的摄取量,一定程度克服了PEG化脂质体细胞摄取困难的问题。结果也显示,随着PEG-脂质比例增加,无论是可断裂还是不可断裂组的PEG化脂质体的转染率均显著降低,证明PEG的密度增加会影响脂质体的细胞摄取。酯酶普遍存在于哺乳动物血浆、器官和组织中,因此可以通过酯酶可断裂PEG-脂质解决常规PEG脂质使PSL酸敏性丧失的问题。Xu等[35, 36]合成一系列酯酶可催化裂解的PEG-脂质 (PEG-胆固醇半琥珀酸酯、PEG-胆固醇氯甲酸酯和PEG-α生育酚半琥珀酸酯),证明该可断裂PEG-脂质一方面能够增加pH-敏感制剂的稳定性,另一方面在血浆或组织中酯酶的作用下能够发生有效断裂,在低pH部位恢复pH-敏感制剂的酸敏性。
硫解 目前研究最多的可断裂PEG-脂质是在PEG与脂质之间引入二硫键,在体内半胱氨酸等还原剂的作用下二硫键容易发生断裂。Kuai等[30]通过二硫键连接PEG-脂质得到DSPE-S-S-PEG5000,与DSPE- PEG2000、DSPE-PEG2000-细胞穿透肽 (DSPE-PEG2000- TAT) 共同修饰脂质体 (C-TAT-SL)。不加还原剂半胱氨酸时,C-TAT-SL和不可断裂PEG-脂质、TAT肽修饰脂质体 (N-TAT-SL) 的细胞摄取量无明显差异。加入半胱氨酸后,C-TAT-SL的细胞摄取量显著高于N-TAT-SL。Fu等[37]利用二硫键连接的可断裂PEG脂质和细胞穿膜肽TAT共修饰脂质体 (C-TAT-Lipo) 包封紫杉醇,C-TAT-Lipo组断裂前细胞摄取较低,去屏蔽后细胞摄取增加了1.40倍,促细胞凋亡作用明显增强,并显著优于普通长循环脂质体组 (P < 0.01) 和不可断裂脂质体组 (P < 0.001)。可断裂PEG脂质越来越多地应用于脂质体的修饰[18],可以部分解决PEG存在的问题,但是,无论是可断裂还是不可断裂PEG脂质,仍会影响脂质体的细胞摄取效率。且可断裂PEG脂质能否如预期一样在有效的时间内、一定条件下使脂质体脱PEG化一直是技术上的难题。
近年来,许多研究者在PEG化脂质体表面修饰特异性配体构建主动靶向脂质体,通过配体-受体间相互作用增强PEG化脂质体与靶细胞的结合力来克服PEG“窘境”。常用的靶向配体有转铁蛋白、叶酸、单克隆抗体、通过噬菌体肽库筛选的小肽配体等,但特异性配体和靶向分子间的饱和现象一定程度上限制了PEG化脂质体的细胞摄取,因此单一的主动靶向脂质体在克服PEG“窘境”上存在着一定缺陷。细胞穿透肽 (cell- penetrating peptides,CPP) 是一种短肽序列,能够不依赖膜受体穿过细胞膜并将各种生物活性物质或纳米药物载体递送到细胞内,目前许多报道显示CPP被应用于药物或基因的递送[39, 40, 41]。然而由于CPP对肿瘤细胞没有靶向性且稳定性差,导致CPP修饰的药物递送系统给药后到达靶部位的药量极少。为了改善上述两种配体的缺点,研究人员将CPP和特异性配体共同修饰在脂质体表面构建双配体靶向PEG化脂质体,很大程度上克服了PEG“窘境”。
Kibria等[11]将整合蛋白αvβ3的特异性配体RGD肽和细胞穿透肽STR-R8共同修饰于PEG化脂质体表面构建双配体主动靶向脂质体 (R8/RGD-PEG-LP)。发现表达αvβ3受体的人脐静脉内皮细胞对R8/RGD- PEG-LP的摄取量是普通PEG化脂质体的5.1倍,而对于不表达αvβ3受体的皮肤血管内皮细胞,RGD肽并未明显提高脂质体的细胞摄取率。
Koren等[40]利用PEG-腙键-DSPE、肿瘤特异性抗体mAb2C5和TAT-PEG-PE共同修饰脂质体 (图 1),其设计理念是: 较长链的PEG2k-腙键-DSPE在最外层可以保护短链的TAT-PEG1k-PE,保持TAT肽的细胞穿透能力,同时使脂质体具有较长的血液循环时间和更多的寻靶机会,mAb 2C5可以选择性地使脂质体富集到肿瘤部位,肿瘤组织间隙的低pH使PEG2k-腙键-DSPE的腙键断裂,长链PEG脱落,暴露出TAT肽促使载药脂质体大量进入细胞。LSCM和流式细胞实验结果表明,双配体修饰脂质体在pH 7.0时,细胞摄取量并无明显提高。当以酸性环境预处理后,细胞摄取量显著增加,克服了常规PEG化脂质体以及单配体修饰脂质体细胞摄取量低的问题。
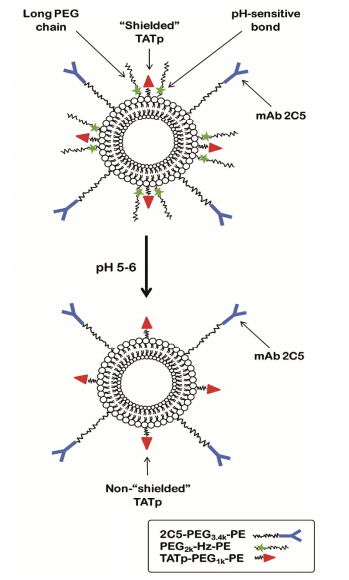
|
Figure 1 Schematic of the low pH effect on TATp-modified pH-sensitive immunoliposomes composed of a pH-degradable PEG2k-Hz-PE with long PEG blocks,TATp-PEG1k-PE with short PEG blocks,and mAb2C5-PEG3.4k-PE[40] |
研究人员制备含两性离子脂质的脂质体,该类脂质体能够随pH的改变 发生电荷转换,利用脂质体与细胞膜或细胞器膜间静电作用,增加脂质体的细胞摄取量和“核内体逃逸”。Mo等[42]以两性寡肽脂质1,5-双十八烷基-L-谷氨酰基-2-组氨酰-六氢苯甲酸 (1,5-dioctadecyl-L- glutamyl 2-histidyl-hexahydrobenzoic acid,HHG2C18) 和1,5-二硬脂N-(N-α-(4-mPEG2000)丁二酮)-组氨酰- L-谷氨酸 (1,5-distearyl N-(N-α-(4-mPEG2000) butanedione)-histidyl-L-glutamate,PEGHG2C18) 修饰脂质体 (HHG2C18-L和PEGHG2C18-L) (图 2),可赋予脂质体一定量的负电荷,能够避免脂质体与调理素的相互作用,增加脂质体的血液循环时间。在肿瘤组织pH 6.0~7.0条件下,脂质体表面的负电荷转变为正电 荷,然后通过静电吸附作用内吞进入细胞。在核内体和溶酶体内的低pH条件下,HHG2C18和PEGHG2C18组氨酸上的咪唑基通过质子海绵效应发生“核内体逃逸”,在细胞内六氢苯甲酸酰胺水解,使脂质体表面的正电性增加,靶向线粒体并诱导细胞凋亡,该制剂成功克服了常规PEG化脂质体产生的“窘境”。
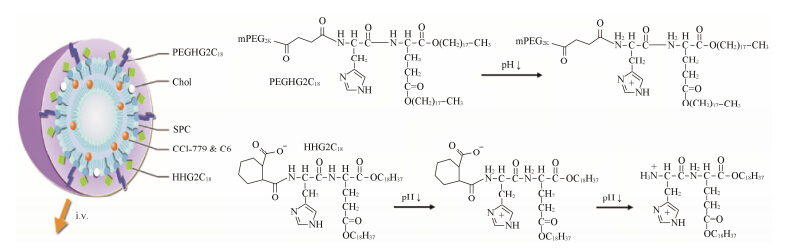
|
Figure 2 Structures of pH-sensitive liposomes based on zwitterionic oligopeptide lipids[42] |
Obata等[43]合成两种含谷氨酸的两性离子PSL (L1脂质体、L2脂质体),该脂质体在核内体的低pH下,zeta电位由负值转换为正值,增强脂质体与带负电荷的核内体膜的融合能力,释放药物进入胞浆。利用LSCM考察了HeLa细胞对常规脂质体和两性离子PSL的细胞内递送情况,发现普通脂质体大多数定位于核内体,两性离子PSL组的核内体周围出现很多红色荧光点,表明药物从核内体释放进入胞浆,发生“核内体逃逸”。
由于PEG化存在诸多问题,研究人员开始尝试寻找其替代物,保证脂质体具有较长循环时间的同时不妨碍脂质体的细胞摄取和“核内体逃逸”。聚 (2-乙基-2-噁唑啉) [poly(2-ethyl-2-oxazoline),PEtOz]是一种高分子长链聚合物,因其毒性低、亲水性好、具有柔顺性和生物相容性等优点[44, 45],已通过美国FDA认证。
Woodle等[44, 45]利用PEtOz-DSPE修饰脂质体,发现PEtOz与PEG一样可以赋予脂质体长循环性。在此基础上Xu等[46]合成PEtOz-脂质,利用其修饰脂质体构建pH敏感-长循环“双功能”脂质体。大鼠体内药代动力学实验证明PEtOz可以赋予脂质体长循环性,利用流式细胞仪和细胞毒实验验证了PEtOz不会阻碍细胞对脂质体的摄取,且pH越低,细胞摄取量越大。以LSCM考察PEtOz脂质体的细胞内分布情况,发现PEtOz-脂质体分布在整个细胞质中,说明PEtOz-脂质体成功实现了“核内体逃逸”,而普通脂质体最终都集中在溶酶体中。
Xia等[47]设计合成叶酸-PEtOz-DSPE,利用其修饰的脂质体对人卵巢癌细胞SKOV3表现出较高的亲和力,脂质体在pH 5.0时的释放率显著高于pH 7.4,且叶酸-PEtOz-DSPE修饰的空白脂质体基本无细胞毒作用,表明PEtOz作为药物载体修饰材料是安全可靠的。
由此可见,由于PEtOz长链具有类似PEG的亲水性、柔顺性,可以使脂质体避免被MPS吞噬,弥补了传统PSL在体内稳定差的缺点,同时PEtOz具有pH敏感性,不妨碍脂质体的细胞摄取并能在核内体低pH条件下促进脂质体与核内体膜的融合进而发生“核内体逃逸”,因此PEtOz有希望成为PEG的替代物,克服PEG化脂质体细胞摄取困难和不能发生“核内体逃逸”的问题。
ABC现象的发现迄今已有十余年的历史,研究人员详细考察了ABC现象的影响因素[23, 24],但是仍有很多影响因素尚未定论。研究人员对如何克服ABC现象也进行了系列相关研究,比如PEG化脂质体内装载细胞毒性药物、降低脂质体表面PEG的密度、适当调整注射时间间隔和注射次数、调整首次注射的磷脂剂量、改变PEG末端基团或者寻找PEG替代物在一定程度上都可能会消除或减弱ABC现象。
许多研究者发现在PEG化脂质体内包封细胞毒性药物,重复注射该类脂质体未引起ABC现象。Ishida等[48]的研究结果显示首次注射PEG化阿霉素脂质体不会引起二次注射PEG化脂质体的ABC现象。Cui等[49]对小鼠重复注射PEG化阿霉素脂质体或PEG化米托蒽醌脂质体,都未引起ABC现象。Lila等[50]发现重复注射PEG化奥沙利铂阳离子脂质体,即使在低磷脂剂量时也能有效抑制抗-PEG IgM的产生,米托蒽醌和奥沙利铂均为细胞毒性药物。
但是有研究人员[51, 52]通过对大鼠或犬重复注射拓扑替康PEG化脂质体时发现,具有细胞毒性的拓扑替康同样可以引起强烈的ABC现象。与阿霉素不同,拓扑替康是细胞分裂周期特异性药物,只能影响脾脏边缘细胞区S期的B淋巴细胞群。此外,注射24 h后,包封于脂质体中的拓扑替康和阿霉素保留在血液中的量分别低于10% 和超过40%。由于在循环过程中药物泄露,仅有少部分拓扑替康抑制B细胞增殖,不影响ABC现象的产生[51]。
Tian等[53]将米托蒽醌制成PEG化热敏脂质体重复注射于大鼠体内,同样诱导产生了典型的ABC现象,这与他们之前的研究PEG化米托蒽醌脂质体不产生ABC现象[49]的结论看似矛盾,该文作者认为米托蒽醌热敏脂质体在体内释放较快,从而产生的大量空白脂质体接触到免疫细胞时,由于它们没有携带能够抑制或杀死免疫细胞的药物,因此激发了机体的免疫应答,产生了抗PEG-IgM抗体,从而在第2次注射给药后产生ABC现象。因此,包封细胞毒类药物可能并不能绝对避免ABC现象,具体的药物需要进行相应的实验验证。
ABC现象是 首次注射的PEG化脂质体作为TI-2抗原诱导的获得性免疫反应,因此适当地改变脂质体表面PEG的修饰密度以改变脂质体表面抗原决定簇的密度,能够影响B细胞受体对脂质体的识别,有助于减弱ABC现象。
利用可断裂PEG脂质 Xu等[54]利用酯酶敏感的可断裂PEG胆固醇脂质对脂质体进行修饰,大鼠体内重复注射该脂质体未见明显的ABC 现象产生。Chen等[55]合成腙键连接的PEG胆固醇脂质,利用其修饰脂质体重复注射于大鼠,发现该可断裂PEG脂质可以减轻或消除ABC现象。
利用PEG-短链脂质修饰脂质体 有研究人员[56]采用较小的C14脂质锚定物增加PEG从粒子表面的解离,结果发现这会使ABC现象减弱。因此,应用可交换的PEG脂质替换牢固结合于脂质体双分子层的PEG脂质可能是一个比较好的策略[57]。
采用低浓度PEG-脂质修饰脂质体 Deng等[58]利用低含量PEG-脂质修饰脂质体,当PEG-脂质的摩尔百分比≤1.5% 时,经过重复注射仅引起轻微的或不引起ABC现象,且低浓度的PEG未降低制剂的体外抗肿瘤活性,加入低浓度PEG-脂质同样能够增加制剂稳定性。
但是降低脂质体表面的PEG密度势必会对脂质体的长循环性产生影响,特别是PEG-短链脂质的脂质交换有可能引起脂质体双分子层的膜缺陷。
Li等[52]对比格犬首次注射PEG化拓扑替康脂质体,分别在间隔时间7、21、28天进行二次注射,结果显示,随着二次注射时间间隔的延长,诱导产生的ABC现象逐渐减弱,当间隔28天进行二次注射时,未产生ABC现象。这可能因为接受PEG化脂质体的动物不能产生ABC作用的免疫记忆,二次注射时间的延长导致首次注射产生的IgM抗体被消耗,不能诱发ABC现 象。Deng等[59]也发现合理选择PEG化制剂的注射 间隔可以消除或避免ABC现象,当二次注射间隔为30、60、90或120天时,ABC现象有不同程度的减 弱或完全消失。因此,延长注射间隔是克服ABC现象较好的方法。
Ishida等[10, 60]对大鼠和小鼠静脉注射PEG化脂质体,在二次注射后4、7或14天,第三次注射的PEG化脂质体诱导的ABC现象微弱,说明多次重复注射并不能继续引发ABC现象,这可能是接受了PEG化脂质体的动物对注射的PEG化脂质体获得了免疫耐受性。
Ishida等[48]发现首次注射的PEG化脂质体中磷脂的剂量与ABC现 象的诱发程度呈反相关。首次分别注射磷脂剂量为 1 μmol·kg-1和超过5 μmol·kg-1的PEG化脂质体,结果表明二次注射PEG化脂质体产生的ABC现象随首次注射剂量的增加而减弱。他们使用免疫印迹分析 进一步测定IgM和脂质体的结合量,二者的结合与首次注射的PEG化脂质体量呈相反关系,可能是该剂量的PEG化脂质体使细胞产生了免疫耐受。Deng等[61]也证明了诱导ABC现象的强弱与首次注射的PEG化脂质体中磷脂的剂量呈反相关。因此,可以通过增加首次注射剂量避免ABC现象的发生。
一般常规PEG-脂质中PEG的末端为甲氧基,Deng等[62]发现不同端基的PEG-脂质修饰的制剂具有不同的循环时间,与蛋白的相互作用不同,激活补体系统能力也不同,推测其诱导ABC现象的强度可能不同。因此他们利用末端基团为羟基的PEG-脂质修饰纳米制剂,消除了ABC现象,同时载体表面同样可以形成致密的水化层,提高载体的物理稳定性和生物稳定性。
随着对ABC现象的深入考察,研究人员发现一些聚合物修饰脂质体能够消除或减弱ABC现象。Romberg等[63]发现在脂质剂量为0.25 μmol·kg-1或 更少时,聚羟乙基-L-天冬酰胺 [poly(hydroxyethyl-L- asparagine),PHEA] 修饰脂质体的血液循环时间长于PEG化脂质体。首次分别注射PHEA和PEG化脂质体,一周后二次注射的PHEA脂质体比PEG化脂质体消除得更慢。虽然这一发现的机制仍不明确,但是PHEA-脂质体表现出的长循环性和减弱ABC现象的作用优于PEG化脂质体。
Lila等[64]分别对大鼠重复注射PEG化脂质体和聚甘油 (polyglycerol,PG) 修饰脂质体,结果显示PEG化脂质体产生了ABC现象而PG修饰的脂质体无ABC现象。此外他们评估两种负载阿霉素的脂质体的抗肿瘤作用,发现重复注射后,PG修饰阿霉素脂质体对肿瘤的抑制作用优于游离阿霉素和PEG化阿霉素脂质体。
Deng等[65]利用含有唾液酸片段的脂质衍生物修饰脂质体,获得了较长的体内循环时间和肿瘤靶向性,同时含有唾液酸片段的脂质衍生物修饰制剂免疫原性较低,重复注射时不会产生ABC现象。聚唾液酸与PEG具有相似之处,如水溶性、柔顺性、易于工业化生产和分子量的可选择性等[66],寻找可替代PEG的聚合物是一个较好的解决ABC现象的策略。
PEG化脂质体自应用以来极大地改善了脂质体的稳定性和药动学特征,但随着研究的不断深入,PEG具有优越性能的同时也产生了相应的PEG“窘境”。近年来,除了本文介绍的方法外,也有人尝试采用多功能壳层纳米载体 (multifunctional envelope type nano device,MEND) 克服PEG“窘境”,浓缩的核酸内核或聚阳离子合成体以及其表面覆盖的各种功能性脂质膜成分。该结构的优点为: 复合内核将核酸尺寸最小化,提高了包封率。核/壳结构使核酸免于 DNA酶降解,同时可以在脂质膜上装备各种功能性修饰物 (如PEG、特异性靶配体、细胞穿透肽等) 以构建智能型纳米载体[67, 68, 69]。也有学者将碳纳米管与脂质体结合构建新型药物递送系统,既保证了药物递送系统的细胞摄取量又防止高浓度碳纳米管带来的细胞毒性[70]。随着科研人员的不断努力,更好地利用PEG的优势、克服PEG“窘境”对PEG化纳米制剂的发展至关重要。
| [1] | Dadashzadeh S, Vali AM, Rezaie M. The effect of PEG coating on in vitro cytotoxicity and in vivo disposition of topotecan loaded liposomes in rats [J]. Int J Pharm, 2008, 353: 251- 259. |
| [2] | Dos Santos N, Allen C, Doppen AM, et al. Influence of poly(ethylene glycol) grafting density and polymer length on liposomes: relating plasma circulation lifetimes to protein binding [J]. BBA-Biomembranes, 2007, 1768: 1367-1377. |
| [3] | Narang AS, Varia S. Role of tumor vascular architecture in drug delivery [J]. Adv Drug Deliv Rev, 2011, 63: 640-658. |
| [4] | Maeda H, Wu J, Sawa T, et al. Tumor vascular permeability and the EPR effect in macromolecular therapeutics: a review [J]. J Control Release, 2000, 65: 271-284. |
| [5] | Mishra S, Webster P, Davis ME. PEGylation significantly affects cellular uptake and intracellular trafficking of non-viral gene delivery particles [J]. Eur J Cell Biol, 2004, 839: 97- 111. |
| [6] | Hong RL, Huang CJ, Tseng YL, et al. Direct comparison of liposomal doxorubicin with or without polyethylene glycol coating in C-26 tumor-bearing mice: is surface coating with polyethylene glycol beneficial? [J]. Clin Cancer Res, 1999, 5: 3645-3652. |
| [7] | Wang T, Upponi JR, Torchilin VP. Design of multifunctional non-viral gene vectors to overcome physiological barriers: dilemmas and strategies [J]. Int J Pharm, 2012, 427: 3-20. |
| [8] | Tagalakis AD, Kenny GD, Bienemann AS, et al. PEGylation improves the receptor-mediated transfection efficiency of peptide-targeted, self-assembling, anionic nanocomplexes [J]. J Control Release, 2014, 174: 177-187. |
| [9] | Tagami T, Nakamura K, Shimizu T, et al. Effect of siRNA in PEG-coated siRNA-lipoplex on anti-PEG IgM production [J]. J Control Release, 2009, 137: 234-240. |
| [10] | Ishida T, Maeda R, Ichihara M, et al. Accelerated clearance of PEGylated liposomes in rats after repeated injections [J]. J Control Release, 2003, 88: 35-42. |
| [11] | Kibria G, Hatakeyama H, Ohga N, et al. Dual-ligand modification of PEGylated liposomes shows better cell selectivity and efficient gene delivery [J]. J Control Release, 2011, 153: 141-148. |
| [12] | Wei MY, Xu YH, Zou Q, et al. Hepatocellular carcinoma targeting effect of PEGylated liposomes modified with lactoferrin [J]. Eur J Pharm Sci, 2012, 46: 131-141. |
| [13] | Rabanel JM, Hildgen P, Banquy X. Assessment of PEG on polymeric particles surface, a key step in drug carrier translation [J]. J Control Release, 2014, 185: 71-87. |
| [14] | Hatakeyama H, Akita H, Harashima H. A multifunctional envelope type nano device (MEND) for gene delivery to tumours based on the EPR effect: a strategy for overcoming the PEG dilemma [J]. Adv Drug Deliv Rev, 2011, 63: 152- 160. |
| [15] | Un K, Sakai-Kato K, Oshima Y, et al. Intracellular trafficking mechanism, from intracellular uptake to extracellular efflux, for phospholipid/cholesterol liposomes [J]. Biomaterials, 2012, 33: 8131-8141. |
| [16] | Ziello JE, Huang Y, Jovin IS. Cellular endocytosis and gene delivery [J]. Mol Med, 2010, 16: 222-229. |
| [17] | Medina-Kauwe LK, Xie J, Hamm-Alvarez S. Intracellular trafficking of nonviral vectors [J]. Gene Ther, 2005, 12: 1734-1751. |
| [18] | Xu H, Deng YH, Chen DW. Recent advances in the study of cleavable PEG-lipid derivatives modifying liposomes [J]. Acta Pharm Sin (药学学报), 2008, 43: 18-22. |
| [19] | Yoshino K, Taguchi K, Mochizuki M, et al. Novel analytical method to evaluate the surface condition of polyethylene glycol- modified liposomes [J]. Colloid Surf A, 2012, 397: 73-79. |
| [20] | Basilea L, Passiranic C, Huynhc NT, et al. Serum-stable, long-circulating paclitaxel-loaded colloidal carriers decorated with a new amphiphilic PEG derivative [J]. Int J Pharm, 2012, 426: 231-238. |
| [21] | Kim JY, Kim JK, Park JS, et al. The use of PEGylated liposomes to prolong circulation lifetimes of tissue plasminogen activator [J]. Biomaterials, 2009, 30: 5751-5756. |
| [22] | Felber AE, Dufresne MH, Leroux JC. pH-sensitive vesicles, polymeric micelles, and nanospheres with polycarboxylates [J]. Adv Drug Deliv Rev, 2012, 64: 979-992. |
| [23] | Xu H, Wang KQ, Huang WW, et al. Recent advances in the study of accelerated blood clearance phenomenon of PEGylated liposomes [J]. Acta Pharm Sin (药学学报), 2010, 45: 677-683. |
| [24] | She ZN, Zhai WJ, Deng YH. Analysis of immune mechanism of accelerated blood clearance phenomenon [J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2011, 28: 78-86. |
| [25] | Xu H, Ye FF, Hu MN, et al. Influence of phospholipid types and animal models on the accelerated blood clearance phenomenon of PEGylated liposomes upon repeated injection [J]. Drug Deliv, 2014, DOI: 10.3109/10717544.2014.885998. |
| [26] | Laverman P, Carstens MG, Boerman OC, et al. Factors affecting the accelerated blood clearance of polyethylene glycol-liposomes upon repeated injection [J]. J Pharmacol Exp Ther, 2001, 298: 607-612. |
| [27] | Zhao YX, Wang L, Yan MN, et al. Repeated injection of PEGylated solid lipid nanoparticles induces accelerated blood clearance in mice and beagles [J]. Int J Nanomed, 2012, 7: 2891-2900. |
| [28] | Suzuki T, Ichihara M, Hyodo K, et al. Accelerated blood clearance of PEGylated liposomes containing doxorubicin upon repeated administration to dogs [J]. Int J Pharm, 2012, 436: 636-643. |
| [29] | Li CL, Cao JN, Wang YJ, et al. Accelerated blood clearance of PEGylated liposomal topotecan: influence of polyethylene glycol grafting density and animal species [J]. J Pharm Sci, 2012, 101: 3864-3876. |
| [30] | Kuai R, Yuan W, Li W, et al. Targeted delivery of cargoes into a murine solid tumor by a cell-penetrating peptide and cleavable poly (ethylene glycol) comodified liposomal delivery system via systemic administration [J]. Mol Pharmaceut, 2011, 8: 2151-2161. |
| [31] | Song LY, Ahkong QF, Rong Q, et al. Characterization of the inhibitory effect of PEG-lipid conjugates on the intracellular delivery of plasmid and antisense DNA mediated by cationic lipid liposomes [J]. Biochim Biophys Acta, 2002, 1558: 1-13. |
| [32] | Chan CL, Majzoub RN, Shirazi RS, et al. Endosomal escape and transfection efficiency of PEGylated cationic liposome- DNA complexes prepared with an acid-labile PEG-lipid [J]. Biomaterials, 2012, 33: 4928-4935. |
| [33] | Wan Y, Han JF, Fan GR, et al. Enzyme-responsive liposomes modified adenoviral vectors for enhanced tumor cell transduction and reduced immunogenicity [J]. Biomaterials, 2013, 34: 3020-3030. |
| [34] | Terada T, Iwai M, Kawakami S, et al. Novel PEG-matrix metalloproteinase-2 cleavable peptide-lipid containing galactosylated liposomes for hepatocellular carcinoma-selective targeting [J]. J Control Release, 2006, 111: 333-342. |
| [35] | Xu H, Deng YH, Chen DW, et al. Esterase-catalyzed dePEGylation of pH-sensitive vesicles modified with cleavable PEG-lipid derivatives [J]. J Control Release, 2008, 130: 238-245. |
| [36] | Xu H, Deng YH, Wang KQ, et al. Preparation and characterization of stable pH-sensitive vesicles composed of α-tocopherol hemisuccinate [J]. AAPS PharmSciTech, 2012, 13: 1377-1385. |
| [37] | Fu H, Hu GL, HE Q. Preparation of cell penetrating peptide TAT and cleavable PEG co-modified liposomes loaded with paclitaxel and its in vitro apoptosis assay [J]. Acta Pharm Sin (药学学报), 2014, 49: 1054-1061. |
| [38] | Wang Z, Wang RT, Liu Q, et al. Acid-sensitive liposomes prepared with poly(ethylene glycol)-POPA derivatives [J]. Acta Pharm Sin (药学学报), 2009, 44: 519-524. |
| [39] | Farkhani SM, Valizadeh A, Karami H, et al. Cell penetrating peptides: efficient vectors for delivery of nanoparticles, nanocarriers, therapeutic and diagnostic molecules [J]. Peptides, 2014, 57: 78-94. |
| [40] | Koren E, Apte A, Jani A, et al. Multifunctional PEGylated 2C5-immunoliposomes containing pH-sensitive bonds and TAT peptide for enhanced tumor cell internalization and cytotoxicity [J]. J Control Release, 2012, 160: 264-273. |
| [41] | El-Sayed A, Futaki S, Harashima H. Delivery of macromolecules using arginine-rich cell-penetrating peptides: ways to overcome endosomal entrapment [J]. AAPS J, 2009, 11: 13-22. |
| [42] | Mo R, Sun Q, Li N, et al. Intracellular delivery and antitumor effects of pH-sensitive liposomes based on zwitterionic oligopeptide lipids [J]. Biomaterials, 2013, 34: 2773-2786. |
| [43] | Obata Y, Tajima S, Takeoka S. Evaluation of pH-responsive liposomes containing amino acid-based zwitterionic lipids for improving intracellular drug delivery in vitro and in vivo [J]. J Control Release, 2009, 142: 267-276. |
| [44] | Woodle MC, Engbers CM, Zalipsky S. New amphipatic polymer-lipid conjugates forming long-circulating reticuloendothelial system-evading liposomes [J]. Bioconjug Chem, 1994, 5: 493-496. |
| [45] | Zalipsky S, Hansen CB, Oaks JM, et al. Evaluation of blood clearance rates and biodistribution of poly(2-oxazoline)- grafted liposomes [J]. J Pharm Sci, 1996, 85: 133-137. |
| [46] | Xu H, Zhang W, Li Y, et al. The bifunctional liposomes constructed by poly(2-ethyl-oxazoline)-cholesteryl methyl carbonate: an effectual approach to enhance liposomal circulation time, pH-sensitivity and endosomal escape [J]. Pharm Res, 2014, 31: 3038-3050. |
| [47] | Xia GM, An Z, Wang Y, et al. Synthesis of a novel polymeric material folate-poly(2-ethyl-2-oxazoline)-distearoyl phosphatidyl ethanolamine tri-block polymer for dual receptor and pH- sensitive targeting liposome [J]. Chem Pharm Bull, 2013, 61: 390-398. |
| [48] | Ishida T, Atobe K, Wang XY, et al. Accelerated blood clearance of PEGylated liposomes upon repeated injections: effect of doxorubicin-encapsulation and high-dose first injection [J]. J Control Release, 2006, 115: 251-258. |
| [49] | Cui XJ, Li CL, Wang CX, et al. Repeated injection of PEGylated liposomal antitumour drugs induces the disappearance of the rapid distribution phase [J]. J Pharm Pharmacol, 2008, 60: 1651-1657. |
| [50] | Lila ASA, Eldin NE, Ichihara M, et al. Multiple administration of PEG-coated liposomal oxaliplatin enhances its therapeutic efficacy: a possible mechanism and the potential for clinical application [J]. Int J Pharm, 2012, 438: 176-183. |
| [51] | Ma YL, Yang Q, Wang L, et al. Repeated injections of PEGylated liposomal topotecan induces accelerated blood clearance phenomenon in rats [J]. Eur J Pharm Sci, 2012, 45: 539-545. |
| [52] | Li CL, Zhao X, Wang YJ, et al. Prolongation of time interval between doses could eliminate accelerated blood clearance phenomenon induced by PEGylated liposomal topotecan [J]. Int J Pharm, 2013, 443: 17-25. |
| [53] | Tian W, Zhang L, Wei N, et al. Repeated injection of mitoxantrone containing thermosensitive liposomes in rat induced ABC phenomenon [J]. Acta Pharm Sin (药学学报), 2014, 49: 256-259. |
| [54] | Xu H, Wang KQ, Deng YH, et al. Effects of cleavable PEG-cholesterol derivatives on the accelerated blood clearance of PEGylated liposomes [J]. Biomaterials, 2010, 31: 4757- 4763. |
| [55] | Chen DQ, Liu WH, Shen Y, et al. Effects of a novel pH-sensitive liposome with cleavable esterase-catalyzed and pH-responsive double smart mPEG lipid derivative on ABC phenomenon [J]. Int J Nanomed, 2011, 6: 2053-2061. |
| [56] | Judge AD, McClintock K, Shaw JR, et al. Hypersensitivity and loss of disease site targeting caused by antibody responses to PEGylated liposomes [J]. Mol Ther, 2006, 13: 328-337. |
| [57] | Heyes J, Hall K, Tailor V, et al. Synthesis and characterization of novel poly(ethylene glycol)-lipid conjugates suitable for use in drug delivery PEG [J]. J Control Release, 2006, 112: 280- 290. |
| [58] | Deng YH, Wang L, Zhao YX, et al. Low-concentration polyethylene glycol-lipid (PEG-lipid) derivative and application thereof: CN, 102813929B [P]. 2012-12-12. |
| [59] | Deng YH, Yu ZN, Wang L, et al. A method to eliminate or reduce the accelerated blood clearance phenomenon: CN, 103169981A [P]. 2013-06-26. |
| [60] | Ishida T, Masuda K, Ichikawa T, et al. Accelerated clearance of a second injection of PEGylated liposomes in mice [J]. Int J Pharm, 2003, 255: 167-174. |
| [61] | Deng YH, Yang Q, Song YZ, et al. A method to avoid accelerated blood clearance phenomenon by successive injection of PEGylated epirubicin hydrochloride liposomes. CN, 103156871A [P]. 2011-12-19. |
| [62] | Deng YH, Wang CL, Cheng XB, et al. A method to eliminate ABC phenomenon of PEGylated nanocarrier: CN, 103800911A [P]. 2014-05-21. |
| [63] | Romberg B, Oussoren C, Snel CJ, et al. Pharmacokinetics of poly(hydroxyethyl-l-asparagine)-coated liposomes is superior over that of PEG-coated liposomes at low lipid dose and upon repeated administration [J]. Biochim Biophys Acta, 2007, 1768: 737-743. |
| [64] | Lila ASA, Nawata K, Shimizu T, et al. Use of polyglycerol (PG), instead of polyethylene glycol (PEG), prevents induction of the accelerated blood clearance phenomenon against long- circulating liposomes upon repeated administration [J]. Int J Pharm, 2013, 4561: 235-242. |
| [65] | Deng YH, She ZN, Zhang T, et al. Lipid derivative containing sialic acid fragment and application thereof: CN, 103509066A [P]. 2014-01-15. |
| [66] | Gregoriadis G, McCormack B, Wang Z, et al. Polysialic acids: potentialin drug delivery [J]. FEBS Lett, 1993, 315: 271-276. |
| [67] | Sakurai Y, Hatakeyama H, Sato Y, et al. RNAi-mediated gene knockdown and anti-angiogenic therapy of RCCs using a cyclic RGD-modified liposomal-siRNA system [J]. J Control Release, 2014, 173: 110-118. |
| [68] | Masuda T, Akita H, Nishio T, et al. Development of lipid particles targeted via sugar-lipid conjugates as novel nuclear gene delivery system [J]. Biomaterials, 2008, 29: 709-723. |
| [69] | Nakamura T, Moriguchi R, Kogure K, et al. Efficient MHC class I presentation by controlled intracellular trafficking of antigens in octaarginine-modified liposomes [J]. Mol Ther, 2008, 16: 1507-1514. |
| [70] | Karchemski F, Zucker D, Barenholz Y, et al. Carbon nanotubes-liposomes conjugate as a platform for drug delivery into cells [J]. J Control Release, 2012, 160: 339-345. |
 2015, Vol. 50
2015, Vol. 50


