2. 南京中医药大学, 江苏 南京 210046
2. Nanjing University of Chinese Medicine, Nanjing 210046, China
中药挥发油是一种特殊的中药组分,具开窍和引药上行的作用。现代药理学研究表明,其在抗肿瘤、抗菌以及心脑血管等疾病方面都具有作用[1, 2, 3]。然而,挥发油易挥发且不稳定,直接加入制剂中极易损失或发生变化而影响制剂的质量[4]。近年来,将β-环糊精包合技术用于固化挥发油的研究得到了广泛关注[5],但是存在包合工序繁琐、辅料用量大和包合率低等问题[6]。将纳米技术运用到中药挥发油的研究也日益增多,包括微乳及自微乳给药系统、脂质体给药系统等,但这些制剂受温度影响较大,且载药量低[7, 8, 9]。
氧化石墨烯 (GO) 是石墨烯经过氧化处理后的衍生物,具有单一的原子层结构,可以在横向尺寸上从十几纳米扩展到数十微米,因此,其结构跨越了一般化学和材料科学的典型尺度。GO呈二维平面结构,比表面积大,随机分布有羟基、环氧基和羧基等基团,具有良好的化学稳定性及较高的物理吸附能力和负载效率,并且GO在体内具有良好的生物相容性和生物安全性,其在生物医学领域的应用已被广泛探究,是一种极具应用价值和前途的生物材料[10, 11, 12]。因此,针对挥发油液态易挥发的特点,作者考虑以GO作为固化挥发油的载体,利用其高吸附能力,以期达到固化挥发油并提高其受热稳定性的目的。本实验对GO固化挥发油进行研究,选取丁香油和莪术油为模型药物,以GO对其进行固化,考察固化后所得粉末的流动性、物相特征、挥发油中有效成分的体外溶出度和受热稳定性,为GO固化中药挥发油提供理论和实践依据。
材料与方法 仪器与试药DSC204差示扫描量热仪 (德国Netzsch公司); 6390LV扫描电镜 (日本电子公司); Agilent 1100高效液相色谱仪; ZRS-8G型智能溶出试验仪 (天津大学无线电厂); AR402型多功能制剂试验机 (德国艾维卡有限公司); 药品稳定性试验箱 SYW-250B (宁波东南仪器有限公司); GO (南京先丰纳米材料科技有限公司,批号: XF002); 丁香油 (批号: 20130806),莪术油 (批号: 20131112) (江西吉安正大天然香料有限公司); 莪术醇对照品 (纯度≥98%,批号: MUST-13080211),丁香酚对照品 (纯度≥98%,批号: MUST-13022702) (成都曼思特生物科技有限公司); 甲醇、乙腈为色谱纯,水为高纯水,其余试剂均为分析纯。
挥发油固化粉末的制备 GO固化挥发油样品的制备按GO与药物质量比例0.5∶1、1∶1、2∶1,分别称取GO和两种挥发油适量,置于多功能制剂试验机搅拌槽中,于转速200r·min-1条件下搅拌5 min,即得固化粉末,备用。
挥发油-β-环糊精包合物的制备[13]取挥发油及8倍量的环糊精,根据包合温度下的溶解度加入计算量的水,制备β-环糊精饱和溶液,逐滴加入挥发油 (挥发油用无水乙醇等体积混合),在恒温条件下,搅拌一定时间,冷却至室温,4 ℃条件下静置24 h,减压滤过,沉淀水洗后再用石油醚洗涤3次,低温真空干燥,即得挥发油-β-环糊精包合物粉末,备用。
指标成分的含量测定 色谱条件[14, 15]色谱柱Hedera C18 (250 mm × 4.6 mm,5 μm); 流速1.0 mL·min-1; 柱温: 30 ℃; 进样量: 20 µL。丁香酚: 流动相为甲醇-水 (65∶35),检测波长: 280 nm; 莪术醇: 流动相为乙腈-水 (70∶30),检测波长: 210 nm。
线性关系考察丁香酚: 精密称取丁香酚对照品13.55 mg,置于10 mL量瓶中,甲醇溶解并稀释至刻度,摇匀,获得1 355.0 µg·mL-1对照品贮备液。精密移取丁香酚贮备液,分别加甲醇稀释成质量浓度为67.75、27.10、13.55、6.76和2.71 µg·mL-1的对照品溶液,备用。按上述丁香酚的色谱条件,采用HPLC测定其对应的峰面积,以对照品溶液的进样浓度 (C) 为横坐标,峰面积积分值 (A) 为纵坐标,绘制标准曲线: A = 6.391 6 C + 4.845 8,r = 0.999 7,结果显示,丁香酚在2.71~67.75 μg·mL-1内线性关系良好。莪术醇: 精密称取莪术醇对照品12.36 mg,置于10 mL 量瓶中,甲醇溶解并稀释至刻度,摇匀,获得1 236.0 µg·mL-1对照品贮备液。精密移取莪术醇贮备液,分别加甲醇稀释成质量浓度为61.80、24.70、12.35、6.18和2.47 µg·mL-1的对照品溶液,备用。按上述莪术醇的色谱条件,进行HPLC测定其对应的峰面积,绘制标准曲线: A = 5.948 3 C + 7.098 9,r = 0.999 9,结果显示,莪术醇在2.47~61.8 μg·mL-1内线性关系良好。
吸附率的测定分别取两种GO固化粉末约 10 mg及两种挥发油-β-环糊精包合物100 mg,精密 称定,于25 mL量瓶中,加甲醇适量,超声15 min使溶解,加甲醇至刻度,摇匀,精密吸取1 mL溶液于 10 mL量瓶,定容,用0.45 μm有机微孔滤膜滤过,取续滤液10 μL,进样,采用HPLC测定。指标成分吸附率 (%) = 固化粉末中指标成分含量/挥发油中指标成分投料量× 100%。
流动性考察 休止角采用固定漏斗法将3只漏斗串联并固定于水平放置的坐标纸上高度 (H) 为3 cm处,将固化粉末沿漏斗壁倒入最上一漏斗中直到最下面漏斗形成的药粉圆锥体尖端接触到漏斗口为止,由坐标纸测出圆锥体底部的直径 (D),代入公式计算出休止角: tgθ = 2H/D。
卡氏指数给予一定强度的振动,使固化粉末均匀流入一个10 mL杯子中,用刮片刮掉杯子上面多余的固化粉末,称重,重量除以10即得松密度。在固化粉末均匀流入杯子的同时,对杯子给予一定强度的撞击 (3 min,180次),刮掉杯子上面多余的固化粉末,称重,重量除以10即得轻敲密度,代入公式计算卡式指数: 卡氏指数 = (1-松密度/ 轻敲密度)×100%。
溶出度考察[16]分别以丁香油含量控制成分丁香酚和莪术油含量控制成分莪术醇为指标进行实验,考察GO对两种挥发油溶出度的影响。分别将不同比例制备的丁香油固化粉末、丁香油 (相当于含丁香酚15 mg)、莪术油固化粉末、莪术油(相当于含莪术醇20 mg) 填装胶囊,按溶出度测定方法测定 (中国药典2010年版二部附录XC桨法),以900 mL经脱胶处理的水为溶出介质,转速50 r·min-1,温度 (37 ± 0.5 ℃),分别于5、10、20、30、45、60和90 min定时定点取样2 mL (同时补加同温度等量溶出介质),以0.45 μm微孔滤膜过滤,取续滤液10 μL进行HPLC测定,其结果代入标准曲线计算浓度,并换算成累积溶出率,以横坐标为时间 (t),纵坐标为累积溶出百分率作图。
物相表征 扫描电镜分析(SEM) 将GO、两种固化粉末分别分散于盖玻片上,镀金、固定于铜板上,进行电镜扫描。
差示扫描量热分析(DSC)分别称取适量GO、丁香油及其固化粉末、莪术油及其固化粉末置样品池中。测试条件为铝坩埚; 气氛: 氮气; 升温速率: 10.00 ℃·min-1; 升温范围: 0~500 ℃,分别记录样品的差示热扫描曲线。
热稳定性考察取适量丁香油、莪术油及其固化粉末作为供试品,分别于40 ℃与60 ℃条件下放置8 h,定时分别取样,测定丁香酚和莪术醇的含量。
统计学方法测定结果均以x± s表示,采用SPSS16.0软件处理数据,单因素方差分析,P < 0.05为差异有统计学意义。
结果 1 指标成分丁香酚、莪术醇吸附率和包合率有效指标成分丁香酚、莪术醇吸附率和包合率结果见表 1。由结果可知,使用β-环糊精包合挥发油时,其包合率远低于挥发油的GO固化粉末中指标成分的被吸附率,且环糊精的用量为挥发油的8倍,高出GO用量的几倍。随着GO用量的增加,固化粉末中指标成分丁香酚和莪术醇的吸附率得到提高,相对于质量比0.5∶1的固体粉末,质量比1∶1和2∶1的固化粉末中指标成分的吸附率提高近1倍 (P < 0.01),但1∶1与2∶1相比,指标成分的吸附率并无显著性差异。综合考虑载药量和成本,确定GO与挥发油的比例为1∶1。
|
|
Table 1 Adsorption rateof active components of curing powder in different ratio between graphene oxide and volatile oil (n = 6,x± s). GO: Graphene oxide. ▲▲P < 0.01 vs volatile oil-β-cyclodextrin (8∶1); **P < 0.01 vs curing powder (0.5∶1) |
GO与两种固化粉末的休止角和卡式指数结果见表 2。综合两个指标可知,固化粉末的流动性和可压性均较好,适宜于填充胶囊或压制片剂等。与GO相比,固化粉末流动性较好,可能是由于GO与丁香油混合搅拌后粒径增大,成为固化粉末颗粒。
|
|
Table 2 Angle of repose and Carr’ index of GO and curing powder (n = 3,x± s) |
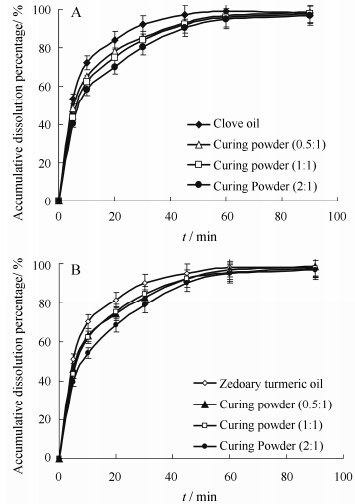
指标成分丁香酚与莪术醇的体外溶出结果如图 1A,B所示。结果显示,挥发油与GO以3种不同比例制备的固化粉末在60 min后溶出都能基本达到平衡; 在60 min内,固化粉末中指标成分的溶出速率略低于挥发油,推测可能是由于GO对其具有一定吸附作用,但这并未影响各指标成分本身的溶出度。从图 1中还可观察到,随着载体GO比例的增加,指标成分的溶出度有所减小,具体机制有待进一步研究。
|
Figure 1 Dissolution profiles of eugenol of clove oil and curing powder (A) and curcumol of zedoary turmeric oil and curing powder (B) (n = 6) |
GO与两种挥发油的固化粉末的扫描电镜结果如图 2所示。结果显示,GO在固化前后的形态存在一定的差异,在扫描电镜下观察到GO (图 2A) 呈片状,表面有褶皱,整体光滑,目测直径约为20 μm,而莪术油固化粉末 (图 2B) 和丁香油固化粉末 (图 2C) 表面粗糙,或有细小的颗粒分布,粒径略大,推测可能是在搅拌过程中,挥发油被吸附在GO的表面,二者之间发生了一定的物理作用。

|
Figure 2 SEM micrographs of graphene oxide (GO,A) and curing powder of zedoary turmeric oil (B) and clove oil (C) |
各样品的差示扫描量热分析结果见图 3。由图中可见,丁香油分别在151.23 ℃和250.04 ℃处有两个吸热峰,GO在214.56 ℃处有一个显著的放热峰,而固化粉末中未见丁香油和莪术油的特征峰,可能是由于挥发油与GO之间的相互作用导致,因为GO吸附机制一方面表现在其表面电荷作用所致的直接表面吸附,另一方面,由于GO的表面随机分布有羟基、环氧基和羧基等基团,能通过酰化反应和酯化反应将其他基团或生物分子修饰到其表面。由此,可以推测丁香油与莪术油在固化过程中可能与GO发生了物理作用和化学反应,导致挥发油的特征峰消失,而GO的特征峰位置也发生了变动。

|
Figure 3 DSC curves of GO (A),clove oil (B),curing powder of clove oil (C),zedoary turmeric oil (D),curing powder of zedoary turmeric oil (E) |
丁香油和莪术油固化前后的热稳定性差异结果 见表 3。结果显示,在固化粉末中指标成分丁香酚和莪术醇的损失率均大幅度减小,说明GO固化挥发油后能提高其受热稳定性,降低含挥发油固体制剂在干燥过程中有效指标成分的损失。
|
|
Table 3 Result of 40 ℃ and 60 ℃ thermal stability test (n = 3,x± s) |
石墨烯是目前发现的最薄的二维纳米材料,它的基本结构为有机材料中最稳定的苯六元环。GO作为一种功能化的石墨烯,在生物医学领域研究较多,它被认为是生物医学应用领域中最有前途的生物材料。其表面引入了羟基、羧基和环氧基等基团,使石墨烯的分散性、水溶性及稳定性等都得到一定的改善,GO不仅可以通过酰化反应和酯化反应将其他基团或生物分子修饰到其表面,也可以通过π-π键和氢键等非共价键作用对其进行修饰。同时,GO是由单层碳原子构成的,具有较大比表面积,可通过π-π键的叠加作用与药物进行物理吸附,具有较高的负载效率,这种吸附机制主要体现在直接的表面吸附和孔隙填充,并且随着对GO研究的不断深入以及应用领域的拓展,使得其表面改性技术也日趋成熟,可以满足各类需求[10]。通过化学气相沉积法合成的GO因其特殊的疏水性和灵活性,在细胞的生长和分化过程中起重要作用[17]。
针对中药挥发油易挥发、不稳定等特点,本研究采用GO固化挥发油,该固化方法简单,以吸附率为依据,发现载体用量与挥发油质量相等时即有较好的固化效果,固化后粉体流动性好,且未影响有效指标成分丁香酚和莪术醇的溶出速率,受热稳定性显著提高。将GO用于固化挥发油具有一定的应用前景,值得进一步研究。
| [1] | Dong FZ, Liu ZW, Le LT. Panax notoginseng in Yunnan (云南三七) [M]. Kunming:Yunnan Science and Technology Press, 1998: 103-144. |
| [2] | Chen YJ, Wang Y, Feng GQ. Control of Disease and Pest of Panax notoginseng (三七病虫害防治) [M]. Kunming: Yunnan Science and Technology Press, 2005: 15-20. |
| [3] | Yang JZ, Cui MX, Chen YJ, et al. Effects of continuous cropping soil treatment on controlling root rot of Panax notoginseng [J]. Special Wild Eco Animal Plant Res (特产研究), 2010, 32: 37-39. |
| [4] | Miao ZQ, Li SD, Liu SZ, et al. The causal microorganisms of Panax notoginseng root rot disease [J]. Sci Agric Sin (中国农业科学), 2006, 39: 1371-1378. |
| [5] | Mao ZS, Long YJ, Zhu SS, et al. Progress of study on root rot in Panax notoginseng [J]. J Chin Med Mater (中药材), 2013, 36: 2051-2054. |
| [6] | Wang CL, Chen ZJ, Sun YQ, et al. Study on induction of polyploidy in Panax notoginseng by colchicine treatment [J]. China J Chin Mater Med (中国中药杂志), 2007, 32: 1222- 1224. |
| [7] | Zhou SL, Xiong GM, Li ZY. Loss of genetic diversity of domesticated Panax notoginseng FH Chen as evidenced by ITS sequence and AFLP polymorphism: a comparative study with P. stipuleanatus HT Tsai et KM Feng [J]. J Integr Plant Biol, 2005, 47: 107-115. |
| [8] | Zhou J, Zhao RQ, Chen L, et al. Construction of expression vector of Panax notoginseng FPS and its expression in prokaryotic cells [J]. Biotechnol Bull (生物技术通报), 2009, 9: 130-133. |
| [9] | Guo S, Luo HM, Chen SL. Cloning and analysis of mevalonate kinase (PnMVK1) gene in Panax notoginseng [J]. Acta Pharm Sin (药学学报), 2012, 47: 1092-1097. |
| [10] | Li RB, Cui XM, Liu YZ, et al. Cloning and expression analysis of pathogenesis-related protein 1 gene of Panax notoginseng [J]. Acta Pharm Sin (药学学报), 2014, 49: 124- 130. |
| [11] | Loon LC, Strien EA. The families of pathogenesis-related proteins, their activities, and comparative analysis of PR-1 type proteins [J]. Physiol Mol Plant Pathol, 1999, 55: 85-97. |
| [12] | Sels J, Mathys J, De Coninck BM, et al. Plant pathogenesis - related (PR) proteins: a focus on PR peptides [J]. Plant Physiol Biochem, 2008, 46: 941-950. |
| [13] | Cheng P, Jiang LY, Jin LM, et al. Advances on class 10 pathogenesis-related proteins [J]. Soybean Sci (大豆科学), 2013, 32: 415-419. |
| [14] | Liu JJ, Ekramoddoullah AKM. The family 10 of plant pathogenesis-related proteins: their structure, regulation, and function in response to biotic and abiotic stresses [J]. Physiol Mol Plant Pathol, 2006, 68: 3-13. |
| [15] | Zhang G, Li YM, Zhang Y, et al. Cloning and characteriza-tion of a pathogenesis-related protein gene TaPR10 from wheat induced by stripe rust pathogen [J]. Agric Sci China, 2010, 9: 549-556. |
| [16] | Chen ZY, Brown RL, Rajasekaran K, et al. Identification of a maize kernel pathogensis-related protein and evidence for its involvement in resistance to Aspergillus flavus infection and aflatoxin production [J]. Phytopathology, 2006, 96: 87-95. |
| [17] | Lee OR, Pulla RK, Kim YJ, et al. Expression and stress tolerance of PR10 genes from Panax ginseng C.A.Meyer [J]. Mol Biol Reports, 2012, 39: 2365-2374. |
| [18] | Tamura K, Dudley J, Nei LM, et al. MEGA4: Molecular evolutionary genetics analysis (MEGA) software version 4.0 [J]. Mol Biol Evol, 2007, 24: 1596-1599. |
| [19] | MarkoVic-Housley Z, Degano M, Lamba D, et al. Crystal structure of a hypoallergenic isoform of the major birch pollen allergen Bet V 1 and its likely biological function as a plant steroid cafrier [J]. J Mol Biol, 2003, 325: 123-133. |
| [20] | Pasternak O, Bujacz GD, Fujimoto Y, et al. Crystal struc-ture of vigna radiate cytokinin-specific binding protein in complex with zeatin [J]. Plant Cell, 2006, 18: 2622-2634. |
| [21] | Koistinen KM, Soininen P, Venalainen TA, et al. Birch PR-10c interacts with several biologically important ligands [J]. Phytochemistry, 2005, 66: 2524-2533. |
| [22] | Mogensen JE, Wimmer R, Larsen JN, et al. The major birch allergen, Bet v l, shows affinity for a broad spectrum of physiological ligands [J]. J Biol Chem, 2002, 277: 23684- 23692. |
| [23] | Xie YR, Chen ZY, Brown RL, et al. Expression and func-tional characterization of two pathogenesis-related protein10 genes from Zea mays [J]. J Plant Physiol, 2010, 167: 121-130. |
| [24] | Srivastava S, Emery RJ, Kurepin LV, et al. Pea PR10.1 is a ribonuclease and its transgenic expression elevates cytokinin levels [J]. Plant Growth Regul, 2006, 49: 17-25. |
| [25] | Wen YJ, He HW, Huang QS, et al. Roles of pathogenesis-relative protein 10 in plant defense response [J]. Plant Physiol Commun (植物生理学通讯), 2008, 44: 585-592. |
| [26] | Saraste M, Sibbald PR, Wittinghofer A. The P-loop - a common motif in ATP-and GTP-binding proteins [J]. Trends Biochem Sci, 1990, 15: 430-434. |
| [27] | Hoffmann SK, Vanek KM, Radauer C, et al. Genomic characterization of members of the Bet v 1 family: genes coding for allergens and pathogenesis-related proteins share intron positions [J]. Gene, 1997, 197: 91-100. |
| [28] | Bantignies B, Seguin J, Muzac I, et al. Direct evidence for ribonucleolytic activity of a PR-10-like protein from white lupin roots [J]. Plant Mol Biol, 2000, 42: 871-881. |
 2015, Vol. 50
2015, Vol. 50


