白芍为毛莨科植物芍药 (Paeonia lactiflora Pall.) 的干燥根。性苦、微寒,归肝、脾经,具有养血敛阴、柔肝止痛、平抑肝阳的功能,主要用于头痛眩晕、胁痛、腹痛、四肢挛痛、血虚萎黄、月经不调、自汗、盗汗等症[1]。白芍炮制方法历史悠久,有“炒制”、“酒制”、“醋制”、“麸炒”等多种炮制方法。其中,白芍醋制后强于走肝经,可补血止血,柔肝止痛,因此醋制白芍常与养血补肝或止血药同用,治妇人肝急失柔、冲任不固等证[2]。现代药理研究表明,白芍炮制品的镇痛作用较生品明显,尤以醋制品作用最为明显[3, 4]。
近年来的化学研究表明,白芍中主要的功效成分是单萜苷及多元酚类化合物。单萜苷类主要包括芍药苷、芍药内酯苷、苯甲酰芍药苷、羟基芍药苷、苯甲酰羟基芍药苷等,多元酚类化合物则主要为多种没食子酰葡萄糖[5, 6]。有研究者以芍药苷、芍药内酯苷、苯甲酸、氨基酸[7, 8, 9]等为指标对白芍醋制前后的化学差异进行了比较研究。然而,白芍的化学组成复杂,醋制过程中发生的化学变化同样非常复杂。此外,《中国药典》规定醋制应选择米醋,但国内的米醋种类众多,其原料和生产工艺的不同,导致酸性和化学组成也不同,炮制用醋的种类对醋制白芍的化学影响程度目前尚不清楚。
植物代谢组学是一种可对植物提取物中代谢物进行无差别全面分析的技术,以高通量检测和数据处理为手段,特别适合于传统中草药等复杂体系分析[10]。基于核磁共振氢谱 (1H NMR) 的代谢组学分析技术重现性好、分析时间短、备样方法简单、可 以获得几乎全部含氢化合物的信息,目前已用于人参[11]、柴胡[12]、款冬花[13]等多种药材的化学分析比较。因此,本研究拟采用基于1H NMR的代谢组学技术从整体化学物质组成角度对白芍及其醋制品进行化学比较分析,并探讨炮制用醋对白芍醋制的影响,为醋白芍的炮制研究提供一定参考。 材料与方法
样品 本研究所用白芍生品购于太原市长城药店、新河药店以及荣华药店,共计3个不同批次的白芍饮片。样品经山西大学秦雪梅教授鉴定为毛茛科植物芍药 (Paeonia lactiflora Pall.) 的干燥根,标本保存在山西大学中医药现代研究中心; 炮制用醋包括米醋 (统万珍极食品有限公司) 和山西陈醋 (山西水塔醋业股份有限公司)。白芍的醋制参照2010版《中国药典》,取白芍饮片50 g,加食醋10 g拌匀,密封闷润1 h,然后用文火加热炒干,取出放冷,即得。
仪器与试剂 Bruker 600-MHz Avance III NMR Spectrometer (600.13 MHz质子频率,德国布鲁克公司600兆核磁仪),超声波清洗器 (KQ5200E,昆山市超声仪器有限公司),旋转蒸发仪 (RE-52A,上海亚荣生化仪器厂),SC-3610低速离心机 (安徽中科中佳科学仪器有限公司),TGL-16高速台式冷冻离心机 (湖南湘仪离心机仪器有限公司),pH计 (奥豪斯仪器有限公司); 分析纯甲醇,NaOH (北京北化精细化学品有限责任公司),娃哈哈纯净水,NMR试剂重水 (Norell,Landisville,USA),氘代甲醇 (99.8%,Merck,Germany),氘代氢氧化钠 (Armar,Switzerland),三甲基硅烷丙酸钠盐 (TSP,Cambridge Isotope Laboratories Inc.,MA)。
食醋的核磁共振分析 取食醋样品30 mL,用NaOH溶液 (1 mol·L -1) 调pH至7.0,置于超声中进行15 min的脱气处理。取脱气后的食醋样品600 μL,加入含0.05% TSP的重水溶液100 μL,转移到5 mm标准核磁管。将待测样品在25 ℃条件下于600 MHz NMR仪上测定,测定频率为1H NMR 600.13 MHz,扫描64次,其他参数设置如下: PW = 30 ℃ (12.7 μs),RD = 5.0 s,Fid转换LB = 0.3 Hz,采用由“noesypr1D” 脉冲序列组成的预饱和技术实现对水峰信号的完全抑制。
样品制备 参照本课题组建立的方法[14]进行核磁样品制备。分别称取粉碎后的白芍、陈醋制白芍、米醋制白芍样品粉末200 mg,置于10 mL离心管中,加入蒸馏水和甲醇各3 mL,加盖漩涡混匀1 min,超声提取25 min,室温下离心 (3 500 r·min-1) 25 min,移取上清液至25 mL圆底烧瓶中,减压浓缩蒸干。取氘代甲醇400 μL与重水缓冲液 (KH2PO4溶于D2O中,以1 mol·L-1氘代氢氧化钠溶液调节pH值至6.0,含0.05% TSP) 400 μL溶解,转移至1.5 mL离心管中,离心 (13 000 r·min-1) 10 min,取上清液600 μL于 5 mm核磁管中待测。每批样品平行备样2份。
1H NMR测定及条件 样品在25 ℃下于600 MHz NMR仪上测定,测定频率为600.13 MHz,扫描次数为64,谱宽12 345.679 Hz,傅里叶变换0.188 Hz,脉冲间隔D1为1 s,延迟时间为5.0 s。采用noesypr1D序列压制残余水信号,用氘代甲醇进行锁场,内标为TSP。
数据分析 核磁图谱采用MestReNova (version 8.0.1,Mestrelab Research,Santiago de Compostella,Spain) 进行处理。核磁图谱经过定标、手动相位、基线校准后,以δ 0.04步长对化学位移区间δ 0.74~9.50进行分段积分,其中δ 4.78~4.94 (残余水峰) 和δ 3.30~3.38 (残余甲醇峰) 不进行积分。将积分 数据导入SIMCA-P 13.0 (Umetrics,瑞典) 软件中进行主成分分析 (principal component analysis,PCA),再用偏最小二乘法判别分析 (partial least squares discriminant analysis,PLS-DA) 和正交偏最小二乘法判别分析 (orthogonal PLS-DA,OPLS-DA),找出样品间差异代谢产物,并对差异成分进行ANOVA分析。 结果 1 两种食醋的化学比较
本研究采用米醋和山西陈醋两种酿造食醋分别制备醋制白芍。为了分析炮制用醋对白芍醋制的影 响,首先对两种食醋进行初步的化学分析。pH测定结果显示,山西陈醋的pH值为3.69,米醋的pH值为2.52。然后对两种食醋分别进行1H NMR分析(图 1),通过化学位移、偶合常数、峰型等核磁数据分析,结合标准品和文献[15]数据对照,从两种食醋中指认鉴定出24个化合物,包括氨基酸、有机酸、糖类等 (表 1)。核磁图谱的积分面积可以反映物质的相对含量,因此以TSP为内标计算这些成分在两种食醋中的相对含量。由表 1可见,山西陈醋中含有较多的氨基酸成分,如缬氨酸、苏氨酸、丙氨酸、异亮氨酸等,说明两种食醋不仅pH不同,而且化学组成也存在差异。
 |
Figure 1 1H NMR spectra of Shanxi vinegar and Rice vinegar. The numbers of 1-24 corresponded with those in Table 1 |
|
|
Table 1 Assignments of1H NMR spectral peaks obtained from Shanxi vinegar and rice vinegar (J,Hz). S: Shanxi vinegar; R: Rice vinegar; A: Paeoniae Radix Alba. TSP: 3-(Trimethylsilyl) propionic-2,2,3,3-d4 acid sodium salt |
分别对白芍及其两种醋制品进行1H NMR分析 (图 2),通过与对照品比对、文献[16, 17]报道数据以及BMRB (www.bmrb.wisc.edu.com) 数据库中的标准物质对照,从白芍及其醋制品核磁图谱中共指认出31个代谢产物 (表 2)。白芍1H NMR图谱大致可以分为3个区域,高场端 (δ 3.10~0.00) 主要包括有机酸和氨基酸,如缬氨酸、丙氨酸、精氨酸、柠檬酸和丁二酸等,此外还有单萜苷类次生代谢产物的甲基信号,包括芍药苷 (1.41,s)、芍药内酯苷 (1.56,s)、苯甲酰芍药苷 (1.25,s)、芍药苷亚硫酸酯 (1.45,s)、6-O-没食子酰白芍苷 (1.37,s) 和4-O-没食子酰白芍苷 (1.60,s) 等。碳水化合物区 (δ 5.50~3.10) 主要为糖类物质,包括α-葡萄糖、β-葡萄糖以及蔗糖等。低场区 (δ 9.5~5.50) 指认的化合物主要包括甲酸、儿茶素、没食子酸、1,2,3,4,6-五没食子酰基葡萄糖、芍药苷类的苯甲酰基团 (7.53,t,J = 7.8 Hz; 7.68,t,J = 7.8 Hz; 8.05,dd,J = 8.4,1.2 Hz),以及白芍醋制后出现的成分5-羟甲基糠醛 (6.67,d,J = 3.6 Hz; 9.48,s)。由于芍药苷类大多含有苯甲酰基团,因此核磁图谱中的苯甲酰基团信号峰面积可反映芍药总苷的含量变化。
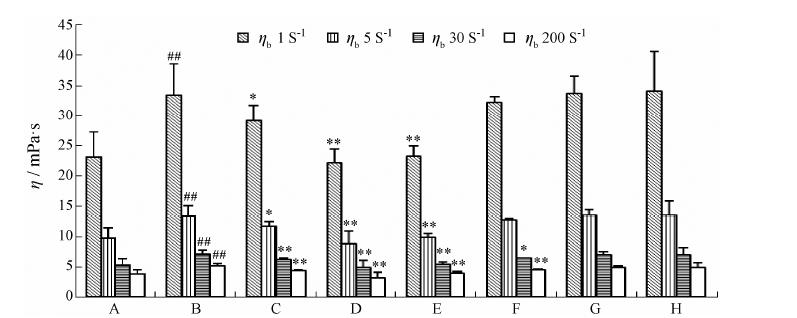 |
Figure 2 1H NMR spectra of rice vinegar-baked Paeoniae Radix Alba (A),Shanxi vinegar-baked Paeoniae Radix Alba (B) and Paeoniae Radix Alba (C). The numbers of 1-31 corresponded with those in Table 2 |
|
|
Table 2 1H NMR assignments of major metabolites in Paeoniae Radix Alba. J in Hz |
白芍中含有的化学成分复杂,其核磁图谱可以提供大量的化学指纹信息,直观分析仅能看到醋制白芍中出现了5-HMF信号。为了阐明白芍醋制前后的化学差异,进一步采用多元统计分析方法对白芍及其两种醋制品的核磁图谱进行分析,并对白芍生品中与食醋共同含有的初级代谢成分以TSP峰面积进行相对定量 (表 1)。 3 多元统计分析
PCA分析是通过降维技术把具有一定相关性的指标约化为几个综合指标的一种无监督的模式识别方法,它能反映数据的原始状态,但不能忽略与研究目的无关的组内误差和随机误差,因而不利于准确确定组间差异[18]。
图 3为白芍及其两种醋制品的PCA得分散点图,由主成分1 (t1: 42.3%) 和主成分2 (t2: 20.5%) 为坐标构建的二维得分散点图 (图 3A) 可见,白芍生品位于散点图的左上部,而大多醋制品位于散点图的右部,生品与炮制品具有明显的分离趋势。为了进一步分析生品与两种炮制品的化学组成差异,从有监督的PLS-DA分析散点图可见 (图 3B),陈醋制白芍距离生品较远,而米醋制白芍距离生品较近,说明陈醋制白芍的化学组成的变化大于米醋制白芍。3、4号白芍生品及其醋制品距离其他样本较远,说明该白芍生品与其他样品存在一定化学差异。通过核磁图谱分析发现,3、4号白芍生品中芍药苷信号低于其他样本,而芍药苷亚硫酸酯的信号高于其他样本,这可能是导致其在散点图中离群的原因。
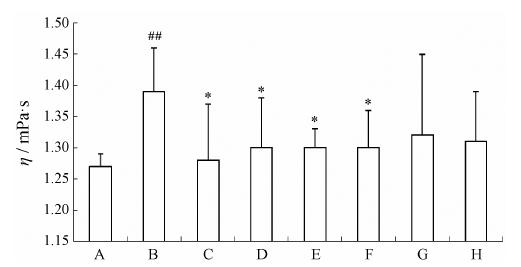 |
Figure 3 Score plot of Paeoniae Radix Alba,Shanxi vinegar-baked Paeoniae Radix Alba and Rice vinegar-baked Paeoniae Radix Alba |
采用有监督的模式识别分析方法OPLS-DA确定白芍醋制前后的化学成分变化,因此将生品和两种炮制品分别作为一组。OPLS-DA模型的使用必须以PLS-DA分析通过模型验证为基础,因此首先通过排列实验对模型的有效性进行验证。在排列实验中,回归线的斜率越大,随机化的R2、Q2差别越小,即原始模型的预测能力大 于任何一次随机排列y变量的预测能力,说明模型 可靠,可以继续后面差异成分的寻找[19]。本研究中白芍与醋白芍两者比较的PLS-DA模型验证成立,而且OPLS-DA模型CV-ANOVA验证的P值小于0.05 (P = 0.000 4),说明生品与炮制品差异具有统计学意义。图 4A为白芍醋制前后OPLS-DA得分散点图 (R2 = 0.955,Q2 = 0.942),可看出与PCA分析相比,组内差异显著降低,这样更有利于准确地确定组间差异。通过OPLS-DA分析的柱状Loading图 (图 4B) 与VIP值结合分析确定,白芍经过醋制后,亮氨酸、异亮氨酸、乳酸、丙氨酸、精氨酸、乙酸、谷氨酸、丁二酸、GABA、胆碱、β-葡萄糖、α-葡萄糖、芍药内酯苷、儿茶素以及5-HMF的含量增加,而蔗糖、芍药总苷(以苯甲酰基计) 和芍药苷的含量下降。
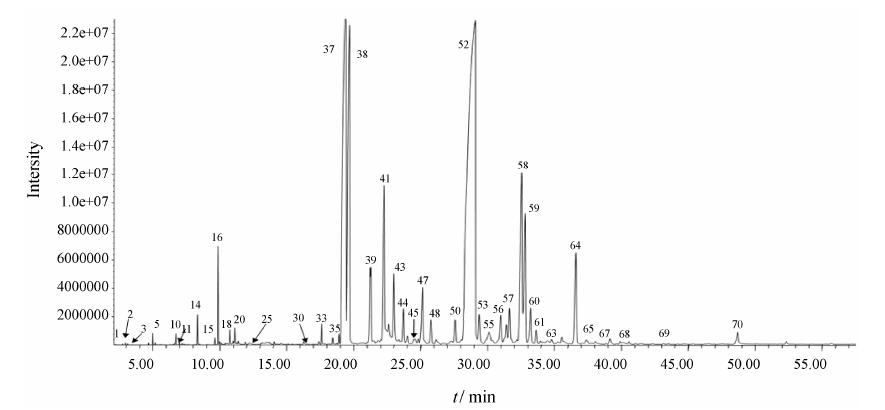 |
Figure 4 OPLS-DA score plots (A) and loading plots (B) between Paeoniae Radix Alba and vinegar-baked Paeoniae Radix Alba; OPLS-DA score plots (C) and loading plots (D) between Shanxi vinegar-baked Paeoniae Radix Alba and Rice vinegar-baked Paeoniae Radix Alba |
从图 3的二维PCA散点图中可见,陈醋制白芍与米醋制白芍能明显分开,排列实验显示PLS-DA分析模型成立。图 4C为陈醋制白芍与米醋制白芍OPLS-DA得分散点图 (R2 = 0.997,Q2 = 0.974,P = 0.005),Loading图 (图 4D) 与VIP值相结合分析显示陈醋制白芍中含有较多的亮氨酸、异亮氨酸、缬氨酸、乳酸、丙氨酸、精氨酸、谷氨酸、β-葡萄糖、α-葡萄糖、芍药内酯苷以及儿茶素,而米醋制白芍中蔗糖和芍药总苷 (以苯甲酰基计) 含量较高。
对上述差异成分采用SPSS16.0软件进行ANOVA分析,从图 5可见,醋制后成分变化的结果与多元统计分析基本一致,而且陈醋制白芍中成分的含量变化幅度大于米醋制白芍。由于样本中芍药苷的组内差异较大,因此醋制后仅有降低的趋势而无统计学意义。
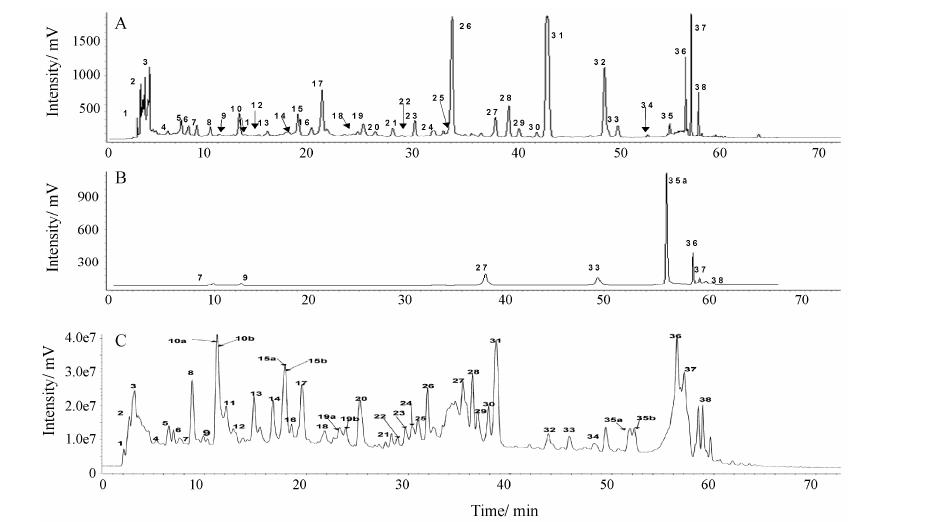 |
Figure 5 Box-plot of different metabolites in Paeoniae Radix Alba (1),rice vinegar-baked Paeoniae Radix Alba (2) and Shanxi vinegar-baked Paeoniae Radix Alba (3). P < 0.05,**P < 0.01 vs Paeoniae Radix Alba; △P < 0.05,△△P < 0.01 vs Rice vinegar-baked Paeoniae Radix Alba |
中药醋制过程中,药材的一些成分在酸性条件下会发生降解和转化,而且食醋中的部分成分也会被药材所吸收。因此,白芍醋制后,和食醋共有的氨基酸和有机酸类成分 (亮氨酸、异亮氨酸、乳酸、丙氨酸、乙酸、丁二酸、胆碱、精氨酸、谷氨酸、GABA) 含量增加的原因在于吸收了食醋中的成分; 本研究中所用山西陈醋氨基酸类含量高于米醋,因此这些成分在陈醋制白芍中的含量高于米醋制白芍。β-葡萄糖、α-葡萄糖含量增加、蔗糖含量降低,而且出现新的成分5-HMF,是因为蔗糖在炮制过程中发生了热降解反应 (蔗糖的焦化及还原糖的分解)[20]; 白芍中固有的成分芍药内酯苷、儿茶素的含量在醋制后增加,而芍药总苷 (以苯甲酰基计) 和芍药苷的含量下降,其中芍药苷和芍药内酯苷的变化与文献[7]报道一致。两种醋制品的芍药内酯苷、儿茶素、芍药总苷 (以苯甲酰基计) 存在较大差异,说明炮制用醋对白芍炮制的影响较大。在白芍醋制的酸性条件下,芍药苷发生水解而含量降低。虽然本研究所用米醋酸性强于山西陈醋,但米醋制白芍和陈醋制白芍的芍药苷无明显差异 (P > 0.05),说明pH值不是中药炮制用醋唯一的影响因素。 讨论
本研究采用基于核磁共振的代谢组学技术对白芍及其两种醋制品进行了化学比较,结果显示,白芍醋制后初级代谢产物和次级代谢产物均会发生较大变化。现代研究显示白芍醋制后芍药苷含量降低,但镇痛作用增强[3, 4],说明芍药苷与镇痛作用无明显关系。中医认为白芍醋制后入肝收敛,可敛血、止血,疏肝解郁[21]。然而,炮制后归经、功效的改变与本研究揭示的化学成分变化的关系目前尚不清楚,后续工作将对此进行深入研究。此外,以往的炮制研究仅仅关注次级代谢产物,但中药材中初级代谢产物的含
量远远高于次级代谢产物,而且醋制过程中还会进一步吸收食醋中的氨基酸、有机酸成分,因此这类成分的变化与炮制后功效改变的相关性也值得进一步深入研究。再者,两种醋制白芍存在显著化学差异,说明醋的种类对炮制的影响较大。醋制在中药临床用药和疗效发挥中有重要作用和意义,《中国药典》只规定醋制用米醋,但米醋种类较多,为了保证临床用药的安全有效,应对中药炮制用醋的种类及其影响进行深入研究。
中药炮制的化学转化研究不应仅仅局限于有限的几个成分,代谢组学技术能从整体上分析复杂体系样本间的化学差异,因此适合于中药炮制的化学研究,但全面的化学物质表征是准确揭示炮制化学变化的基础和前提。核磁共振技术可以同时表征药材中的初级和次级代谢物,但灵敏度较低,后续的工作中将通过多种分析技术的集成联用达到全面化学表征的目的。
| [1] | Tian L, Shao Z, Wang HL. Modern processing research of Radix Paeoniae Alba [J]. Lishizhen Med Mater Med Res (时珍国医国药), 2003, 14: 697-698. |
| [2] | Wang XR. On processing and function of Radix Paeoniae Alba [J]. China Pharm (中国药业), 2007, 16: 56. |
| [3] | Liu GY, Yan X, Li W, et al. Influence of different processing technique on the contents and analgesic effect in Radix Paeoniae Alba [J]. Pharm J Chin PLA (解放军药学学报), 2005, 21: 167-169. |
| [4] | Sun XM, Zhang ZW, Wang WL, et al. Analysis of different processing products in Radix Paeoniae Alba and the impact on the activities of isolated rabbit intestine [J]. China J Chin Mater Med (中国中药杂志), 1990, 15: 23-24. |
| [5] | Zhang XY. A Study on the Chemical Constituents of Paeonia lactiflora Pall (芍药的化学成分研究) [D]. Shenyang: Shenyang Pharmaceutical University, 2001. |
| [6] | Ren ML. Chemical Composition and Biological Activity of Paeonia lactiflora Pall (白芍的化学成分) [D]. Shenyang: Shenyang Pharmaceutical University, 2009. |
| [7] | Liu SX, Li Y, Feng J, et al. Influence of processing the content and paeoniflorin and albiflorin in Radix Paeoniae Alba [J]. Drug Eval Res (药物评价研究), 2010, 33: 125-128. |
| [8] | Xie JH, Xiao TH. Analysis of different processed products amino acid composition in Radix Paeoniae Alba [J]. China J Chin Mater Med (中国中药杂志), 1992, 17: 408-409. |
| [9] | Wu QF, Lai PF, Chen J, et al. Contrast analysis of paeoniflorin, benzoic acid and elemental in Hang Radix Paeoniae Alba raw products and processed products [J]. Chin J Tradit Med Sci Technol (中国中医药科技), 2005, 12: 299-300. |
| [10] | Li ZY, Li AP, Zhang FS, et al. Application of plant metabolomic technology in study on several Shanxi genuine medicinal materials [J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 785-789. |
| [11] | Yang SO, Shin YS, Hyun SH, et al. NMR-based metabolic profiling and differentiation of ginseng roots according to cultivation ages [J]. J Pharm Biomed Anal, 2012, 58: 19- 26. |
| [12] | Qin XM, Dai YT, Liu NQ, et al. Metabolic fingerprinting by 1H NMR for discrimination of the two species used as Radix Bupleuri [J]. Planta Med, 2012, 78: 926-933. |
| [13] | Mi X, Li ZY, Qin XM, et al. Monitoring of chemical components with different color traits of Tussilago farfara using NMR-based metabolomics [J]. Acta Pharm Sin (药学学报), 2013, 48: 1692-1697. |
| [14] | Wang XJ, Li ZY, Xie SY, et al. Quality control different processed products of Polygalae Radix based on plant metabolomics [J]. Chin Tradit Herb Drugs (中草药), 2012, 43: 1727-1737. |
| [15] | Li AP, Li ZY, Xing J, et al. Chemical characterization of different vinegars by NMR-based metabolomic approach [J]. Food Sci (食品科学), 2013, 34: 247-253. |
| [16] | Tan JJ, Zhao QC, Yang L, et al. Chemical constituents in roots of Paeonia lactiflora [J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 1245-1248. |
| [17] | Wang Q, Guo HZ, Huo CH, et al. Chemical constituents in roots of Paeonia lactiflora [J]. Chin Tradit Herb Drugs (中草药), 2007, 38: 972-976. |
| [18] | A JY. Metabolomics data processing methods-principal component analysis [J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2010, 15: 481-489. |
| [19] | Qi XQ, Wang YL, Chen XY. Plant Metabolomics: Methods and Applications (植物代谢组学——方法与应用) [M]. Beijing: Chemical Industry Press, 2011. |
| [20] | Fu ZQ, Wang MY, Cai BC. Discussion of 5-hydroxymethylfurfural (5-HMF) in Chinese native medicine research present situation [J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2008, 26: 508-510. |
| [21] | Li XL, Lai PF. Herbal studies and research advances about concocted Paeonia lactiflora Pall [J]. Asia-Pacific Tradit Med (亚太传统医药), 2008, 4: 42-44. |
 2015, Vol. 50
2015, Vol. 50


