小果博落回 (Macleaya microcarpa (Maxim.) Fedde) 为罂粟科 (Papaveraceae) 博落回属多年生大型草本植物,主要分布于我国甘肃、陕西、湖北北部、河南和江苏北部等地。据《中华本草》记载,该植物在民间药用中以全草入药,主治一切恶疮及皮肤病,有毒,只能外用[1]。目前,学术界对该植物开展了一些化学成分及药理活性的研究[2],但并不深入,其中,以本课题组为代表的研究工作所报道的该植物的化学成分主要为游离的二氢苯菲啶类、苯菲啶类和普罗托品类生物碱以及酰胺类等成分,且二氢苯菲啶类生物碱对一些肿瘤细胞株多表现出较显著的细胞毒性[3, 4]。为了更全面阐明小果博落回的化学成分和药用物质基础,本研究在已报道从小果博落回的根中分离并鉴定了15个苯菲啶型生物碱和1个酰胺类成分的基础上,进一步采用溶剂提取、萃取粗分离和硅胶柱色谱纯化等天然药物化学研究技术并结合现代有机化合物结构鉴定方法,对其开展了植物化学研究,从其85% 乙醇提取物中分离鉴定了8个非生物 碱类成分 (1~8),并完成了结构鉴定; 其中,1为新的何帕烷型三萜类化合物,2~8为已知的三萜类和有机酸类化合物,且均为首次从该植物中分离得到。鉴于本课题组以寻找具有抗溃疡性结肠炎作用的天然药物活性化合物及其类似物为研究方向,并考虑到
苯菲啶型生物碱可以由资源丰富的原小檗碱型生物碱经结构改造而获得,本研究以与肠道上皮细胞内非可控性内质网应激反应相关的下游关键转录因子X-box-binding protein 1 (xbp1) 为药物作用靶点,采用特异的体外靶向xbp1高通量药物筛选模型对已分离鉴定的主要成分进行了体外xbp1转录激活作用评价。研究结果首次阐明了小果博落回所含苯菲啶型 生物碱,即二氢血根碱 (9) 和二氢白屈菜红碱 (10),具有一定的xbp1基因启动子转录激活作用,其转录激活效应分别为空载体对照组的1.76倍和1.77倍。本文报道新化合物的分离纯化和结构鉴定,以及对小果博落回主要成分的xbp1基因启动子转录激活作用的评价研究。
结果与讨论采用85% 乙醇为溶剂进行提取,提取物再经多种溶剂萃取粗分离和硅胶柱色谱纯化,进一步从罂粟科植物小果博落回的根中分离得到化合物1~8。
化合物1 (图 1) 为白色粉末,与10% 硫酸乙醇溶液反应显紫色。其EI-MS和HR-EI-MS分别给出分子离子峰m/z 452 [M]+ 和452.328 8 [M]+,可确定分子式为C30H44O3 (计算值为452.329 0),不饱和度为9。IR光谱中的吸收峰3 197 cm-1和1 718 cm-1表明分子中存在羧基,而1 672 cm-1表明含α,β-不饱和羰基结构。其13C NMR谱给出30个碳信号,可进一步确定为三萜类化合物。1H NMR谱的低场区有一组顺式双键质子特征的AB型自旋系统信号δH 5.64 (1H,d,J = 10.0 Hz,H-2) 和6.26 (1H,d,J = 10.0 Hz,H-3),一组sp2杂化的亚甲基质子自旋系统 (AB型) 信号δH 6.33和5.73 (2H,2×br s,H-30a,30b)。高场区有6个甲基的单峰信号δH 1.18 (3H,s)、1.07 (3H,s)、1.05 (3H,s)、1.04 (3H,s)、0.95 (3H,s) 和0.71 (3H,s),其化学位移值和峰型表明均为叔甲基。化合物1的DEPT谱将30个碳分类为8个季碳、7个次甲基碳、9个亚甲基碳和6个甲基碳; 其中,8个季碳又可以根据化学位移值结合IR数据明确区分为1个酮羰基 (δC 207.4)、1个羧酸 (δ C 172.8)、1个双键季碳 (δC 142.8) 和5个sp3杂化的不连氧季碳。与上述氢谱数据对应,7个次甲基中包括了2个sp2杂化的碳信号。将上述化合物1的1H和13C NMR数据与文献报道的已知化合物22 (30)- hopen-29-oic acid[5]对比,发现二者非常相似,主要区别在于化合物1比后者少了3个亚甲基碳信号但多了1个酮羰基信号δC 207.4和两个sp2杂化的次甲基信号δC 124.4和154.3,且化学位移有显著变化的共振信号仅限于A环和B环的碳信号; 因此推测化合物 1为与22 (30)-hopen-29-oic acid同类型的何帕型五环三萜。在采用HSQC谱将各个甲基、亚甲基和次甲基的直接键连的碳氢共振信号关联后,通过HMBC谱中H-25 (δH 1.18) 与C-1 (δC 207.4)、C-5 (δC 51.1)、C-9 (δC 40.8) 和C-10 (δC 47.9) 的远程相关,H-23和H-24 (δH 1.04和1.07) 均与C-3 (δC 154.3)、C-4 (δC 36. 3) 和C-5的远程相关,H-2 (δH 5.64) 与C-4和C-10的远程相关以及H-3 (δH 6.26) 与C-1、C-4、C-5和C-23 (δC 31.0) 的远程相关可以确定A环中C-1为酮羰基,并与C-2和C-3构成了一个具有顺式双键构型的α,β-不饱和酮结构。其他关键的HMBC相关信息见图 2。因此确定化合物1的其余结构部分具有与22 (30)-hopen-29-oic acid完全相同的平面结构。在化合物1的NOE差谱实验中,当照射28-CH3 (δH 0.71) 时,δH 5.73 (H-30) 和0.95 (27-CH3) 出现增益,但H-13没有出现增益,说明27-CH3、28-CH3和C-30处于同侧,并进一步证实为何帕烷型三萜; 照射27-CH3(δH 0.95) 时, δH 0.71 (28-CH3) 和1.92 (H-9) 出现增益,H-13也没有出现增益,说明H-9和27-CH3处于同侧,而H-13和27-CH3处于异侧; 照射25-CH3 (δH 1.18) 时,δH 1.05 (26-CH3) 出现增益,说明25-CH3和26-CH3处于同侧。因此,确定化合物1为1-氧代-2,22 (30)-何帕二烯-29-羧酸。
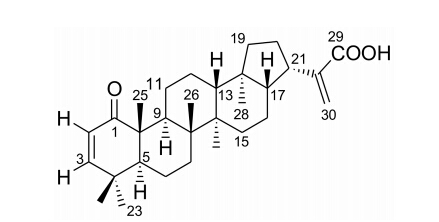 |
Figure 1 Structure of compound 1 |
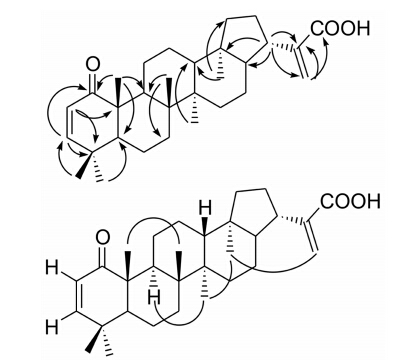 |
Figure 2 Key HMBC (H→C) and NOE (—) of compound 1 |
化合物2~8的1H NMR、13C NMR和MS等数据与文献对照一致,分别鉴定结构为3-氧代-12-齐墩果烯-30-羧酸(2)[6]、3α-羟基-12-齐墩果烯-30-羧酸 (3)[7]、3β-羟基-12-齐墩果烯-30-羧酸 (4)[8]、阿魏酸 (5)[9]、阿魏酸-4-O-β-D-葡萄糖苷 (6)[10]、3-O-阿魏酰奎尼酸 (7)[11]和3-O-阿魏酰奎尼酸甲酯 (8)[11]]。
采用特异的体外靶向xbp1高通量药物筛选模型对已分离鉴定的主要成分进行了体外xbp1激活作用评价。研究结果表明,部分二氢苯菲啶型生物碱对xbp1基因启动子具有一定的转录激活效应。特别是以无转染质粒细胞为对照组1 (Con1),以转染pGL3- pxbp1不加化合物细胞组为载体对照组2 (Con2) 进行对比实验,二氢血根碱 (9) 和二氢白屈菜红碱 (10) 均能不同程度激活xbp1的转录,具有一定的转录激活效应 (图 3),分别为对照组的1.76和1.77倍。但本文所分离的其他化合物对xbp1的转录未显示激活效应。鉴于所建立的xbp1靶向筛选模型是与溃疡性结肠炎的发病和治疗相关的一个新靶点,目前还没有阳性对照化合物的报道,因此,本文未设阳性对照组,数据是与转染pGL3-pxbp1组对照而获得。
 |
Figure 3 Activity of compound 9 and 10 on activating the transcription of x-box-binding protein 1 (xbp1). 1,2,5-10: Compounds 1,2,5-10; 2: 3-Oxoolean-12-en-30 oic acid; 5: Ferulic acid; 6: 4-O-glucoside of ferulic acid; 7: 3-O-feruloylquinic acid; 8: Methyl 3-O-feruloylquinate; 9: Dihydrosanguinarine; 10: Dihydrochelerythrine. Con1: Normal cells without transfection; Con2: Transfected cells with pGL3-pxbp1 plasmid |
Varian Mercury-400型核磁共振波谱仪,Shimadzu UV-260型紫外光谱仪,ZAB-2F型质谱仪,Nicolet 5700型傅立叶变换红外光谱仪,Perkin-Elmer 241型旋光测定仪。柱色谱硅胶 (200~300目) 和薄层色谱硅胶 (GF254) 均为青岛海洋化工厂产品,试剂均为分析纯。
实验用小果博落回为河南省辉县野生品,于2006年8月采集,经中国医学科学院药物研究所马林副研究员鉴定为罂粟科植物小果博落回 (Macleaya microcarpa (Maxim.) Fedde) 的根。
1 提取分离取干燥的小果博落回根8.0 kg,粉碎成粗粉,用85% 乙醇回流提取3次,每次用溶剂量均以浸没过药材为度。过滤、合并乙醇提取液并减压浓缩,将所得浸膏混悬于80% 乙醇溶液中,用石油醚萃取3次。将石油醚萃取后的醇溶液减压回收溶剂得浸膏; 将浸膏加适量水使成混悬状; 此混悬液分别用乙酸乙酯和正丁醇萃取,均以萃取液颜色变淡且非常澄明为度。将乙酸乙酯萃取液用5% NaHCO3水溶液萃取3次,再用纯净水洗涤至中性,减压浓缩有机层得到乙酸乙酯萃取物68 g。将上述碱溶液用稀盐酸酸化至 中性偏酸性后,再用乙酸乙酯萃取,乙酸乙酯萃取液经纯净水洗涤至中性后通过减压浓缩除去有机溶剂得到乙酸乙酯酸性部分6 g。将正丁醇萃取液用5% NaHCO3水溶液萃取3次,碱溶液用稀盐酸酸化至中性偏酸性后,再用正丁醇萃取,正丁醇萃取液经纯净水洗涤至中性后通过减压浓缩除去有机溶剂得到正丁醇酸性部分25 g。
取乙酸乙酯萃取物用硅胶柱色谱进行分离,首先用不同体积组成的氯仿-甲醇(100∶0-100∶1- 50∶1-25∶1-15∶1) 梯度洗脱,得到5个洗脱部分 (Fr.1-5)。Fr.1(氯仿-甲醇,100∶0) 部分再经硅胶柱色谱分离纯化,以石油醚-乙酸乙酯 (25∶1) 洗脱,得到化合物1(11 mg) 和2(28 mg); Fr.2部分 (氯 仿-甲醇,100∶1) 再经硅胶柱色谱分离纯化,以氯 仿-甲醇(100∶1) 洗脱,得到化合物3(365 mg) 和 4 (30 mg)。乙酸乙酯酸性部分经硅胶柱色谱,用不同体积组成的氯仿-甲醇梯度洗脱,由50∶1洗脱部分中得到化合物5(67 mg)。正丁醇酸性部分经硅胶柱色谱,用不同体积组成的氯仿-甲醇梯度洗脱,由10∶1洗脱部分中得到化合物6(120 mg)、7(40 mg) 和8(11 mg)。
化合物9和10,以及主要生物碱和酰胺类成分的提取分离与文献[4]一致。
2 结构鉴定化合物1 白色粉末,[α]D25+109.1 (c 0.20,CDCl3),IR (KBr) νmax cm-1: 3 197,2 942,2 866,1 718,1 672,1 626,1 190,1 175, 946,857,821 ,737; UV λmaxMeOHnm (log ε) 218 (4.0); EI-MS: m/z 452 [M]+; HR-EI-MS: m/z 452.328 8 [M]+ (calcd. for C30H44O3 452.329 0); 1H NMR (400 MHz,CDCl3): δ 6.33 (1H,s,Ha-30),6.26 (1H,d,J = 10.0 Hz,H-3),5.73 (1H,s,Hb-30),5.64 (1H,d,J = 10.0 Hz,H-2),3.36 (1H,m,H-21),1.18 (3H,s,25-CH3),1.07 (3H,s,24-CH3),1.05 (3H,s,26-CH3),1.04 (3H,s,23-CH3),0.95 (3H,s,27-CH3),0.71 (3H,s,28-CH3); 13C NMR (100 MHz,CDCl3):δ 207.4 (C-1),124.4 (C-2),154.3 (C-3),36.3 (C-4),51.1 (C-5),20.3 (C-6),32.2 (C-7),42.4 (C-8),40.8 (C-9),47.9 (C-10),19.2 (C-11),24.7 (C-12),50.0 (C-13),42.0 (C-14),33.4 (C-15),23.9 (C-16),54.6 (C-17),45.5 (C-18),41.8 (C-19),26.4 (C-20),39.3 (C-21),142.8 (C-22),31.0 (C-23),21.9 (C-24),15.7 (C-25),17.2 (C-26),16.7 (C-27),15.8 (C-28),172.8 (C-29),124.8 (C-30)。
3 生物活性评价将处于对数生长期的IEC-6细胞接种于48孔板中,每孔细胞数为5×104,使细胞在孔内均匀分散,放置于37 ℃、5% CO2细胞培养箱培养。待细胞生长汇和至70%~80%,对细胞进行相应质粒的转染 (0.6 μg/孔),4 h后加入1×10-5 mol·L-1各化合物与转染细胞共孵育 (n = 3)。于共培养48 h后收样,利用双荧光素酶报告基因检测试剂盒 (Promega,USA) 对实验样品进行报告基因荧光素酶活性检测。
| [1] | State Administration of Traditional Chinese Medicine of the People's Republic of China. Chinese Herb (中华本草. 第3卷) [M]. Shanghai: Shanghai Science and Technology Press, 1999: 656. |
| [2] | Yang XJ, Miao F, Zheng F, et al. Isolation and identifica-tion of alkaloids from Macleaya microcarpa (Maxim.) Fedde [J]. Acta Bot Boreal-Occident Sin, 2010, 30: 405-411. |
| [3] | Qin HL, Wang P, Li ZH, et al. The establishment of the control substance and 1H nuclear magnetic resonance fingerprint of Macleaya microcarpa (Maxim.) Fedde [J]. Chin J Anal Chem (分析化学), 2004, 32: 1165-1170. |
| [4] | Deng AJ, Qin HL. Cytotoxic dihydrobenzophenanthridine alkaloids from the roots of Macleaya microcarpa [J]. Phytochemistry, 2010, 71: 816-822. |
| [5] | Grammes C, Burkhardt G, Becker H. Triterpenes from Fossombronia liverworts [J]. Phytochemistry, 1994, 35: 1293- 1296. |
| [6] | Nick A, Wright AD, Rali T, et al. Antibacterial triterpenoids from Dillenia papuana and their structure-activity relation-ships [J]. Phytochemistry, 1995, 40: 1691-1695. |
| [7] | Chávez M I, Julián A, Delgado G. Structure elucidation and 13C NMR spectral assignments of 3α-hydroxyolean-12-en-30-oic acid, a new triterpene from Bocconia arborea [J]. Magn Reson Chem, 2003, 41: 143-144. |
| [8] | Um SJ, Park MS, Park SH, et al. Synthesis of new glycyr-rhetinic acid (GA) derivatives and their effects on tyrosinase activity [J]. Bioorg Med Chem, 2003, 11: 5345-5352. |
| [9] | Xiao H, Parkin K. Isolation and identification of phase Ⅱ enzyme-inducing agents from nonpolar extracts of Green onion (Allium spp.) [J]. J Agric Food Chem, 2006, 54: 8417-8424. |
| [10] | Baderschneider B, Winterhalter P. Isolation and characterization of novel benzoates, cinnamates, flavonoids and lignans from Riesling wine and screening for antioxidant activity [J]. J Agric Food Chem, 2001, 49: 2788-2798. |
| [11] | Ida Y, Satoh Y, Ohtsuka M, et al. Phenolic constituents of Phellodendron amurense bark [J]. Phytochemistry, 1994, 35: 209-215. |
 2015, Vol. 50
2015, Vol. 50


