阿尔茨海默症 (Alzheimer’s disease,AD),是一种以渐进性记忆障碍和认知功能下降为特征的神经退化性疾病[1]。AD严重危害着老年人的身心健康,已成为严重的社会问题[2, 3, 4]。
目前,临床上用于治疗AD的药物主要是乙酰胆碱酯酶 (acetylcholinesterase,AChE) 抑制剂,如他克林、多奈哌齐、利斯的明、加兰他敏和石杉碱甲等[5],它们通过抑制AChE的活性,提高患者脑内的乙酰胆碱在突触间隙的浓度而达到治疗AD的效果[6]。然而临床上证实这些药物只能用于轻度至中度AD患者,只能改善AD病人的症状,改善作用仅能持续约6~12个月,且病人对这些药物的响应率也只有50% 左右,同时伴有外周胆碱能毒副作用等问题[7, 8]。面对这些问题,许多研究者积极尝试对上市AChE抑制剂药物进行结构改造,期望设计得到新型AChE抑制剂[9]。
多奈哌齐是第二个获美国FDA批准用于治疗AD的乙酰胆碱酯酶 (acetylcholinesterase,AChE) 抑制剂。它与TcAChE蛋白复合物的X-衍射晶体结构 (Protein Data Bank,代码为1EVE) (图 1) 显示[9, 10]: 苄基部分作用于AChE的活性中心,与Trp84的吲 哚环产生π-π堆积作用,哌啶环质子化的氮原子与中央部位的Phe330的苯环产生阳离子-π作用,茚酮部分延伸至外周阴离子位点,与Trp279形成π-π堆积 作用。因此,对多奈哌齐的结构改造主要集中在对茚酮环[11, 12, 13, 14]、引入卤素[15,16]、苄基哌啶环[14,17]等部位。本文尝试对多奈哌齐进行结构改造 (图 2),将A部分的邻二酚醚通过亚甲基连接起来变成 [1,3] 二氧杂环戊烯,将B部分茚酮换成了异吲哚啉酮结构,同时将C部分延长了碳链,将D部分苄基变换成取代苄基,从而得到20个全新结构类型的[1,3]二氧杂环戊烯并[4,5-f]异吲哚酮衍生物。
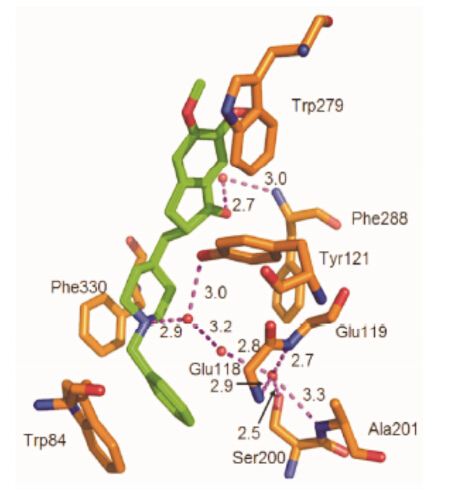 |
Figure 1 Interaction of donepezil with some selected residues of the AChE gorge |
 |
Figure 2 Rational design of target compounds |
目标化合物的合成见合成路线1和2,其中,原料1参照文献[18, 19]方法合成,原料2参照文献[20]方法合成。
 |
Scheme 1 Synthentic route of compounds 3-7. Reagents and conditions: i) KOH,DMSO; ii) a. NaBH4,MeOH/THF; b. Ac2O,Et3N; c. H2,Pd/C; iii,iv) MeI,LDA/THF; v) a. MeMgI,HCl; b. Et2Zn/TFA/CH2I2 |
 |
Scheme 2 Synthetic routes of target compounds (I1-I4,II1-II4,III1-III4,IV1-IV4,V1-V4) |
目标化合物活性测定,首先采用改良的Ellman法[21]对其进行了体外乙酰胆碱酯酶抑制活性筛选,然后采用避暗实验进一步考察具有较好AChE抑制活性的化合物对东莨菪碱所致小鼠学习记忆障碍的改善作用。 结果与讨论 1 目标化合物的合成
中间体3的合成以1和2为起始原料,碱性条件下加热反应得到。中间体4的合成由3经过三步反应生成,先将3用硼氢化钠还原成醇,然后醇与乙酸酐发生酯化、再用钯炭还原得到。4与碘甲烷单取代得产物5,5进一步取代得双取代产物6。中间体3与甲基碘化镁发生格氏加成同时脱水得烯,然后与卡宾 (Et2Zn/THF/CH2I2) 发生环丙烷化反应得到中间体7。中间体3~7在酸性条件下脱除氨基保护基 (Boc) 得到8~12。化合物8~12再与不同的苄氯反应得到目标化合物。目标化合物I~V的结构经1H NMR、ESI-MS及元素分析得以确证,产物的结构、收率和熔点见表 1,波谱数据见表 2。
|
|
Table 1 Structures and physical properties of target compounds I-V |
|
|
Table 2 Spectral data of target compounds I-V |
体外乙酰胆碱酯酶抑制活性实验表明,制备的20个化合物对乙酰胆碱酯酶 (AChE) 均有一定的抑制作用 (表 3),IC50值在微摩尔级。其中化合物I1 (IC50 = 0.086 µmol·L-1) 和I2(IC50 = 0.080 µmol·L-1) 对AChE的抑制活性较好,与对照药 (donepezil,IC50 = 0.094 µmol·L-1) 相当; 化合物III4和IV1~IV4活性弱 (IC50值均大于2.0 µmol·L-1); 其他化合物对AChE的抑制活性接近 (IC50值在0.1~0.9 µmol·L-1之间)。
|
|
Table 3 Inhibitory activities on AChE of target compounds I-V |
由表 3数据可知,B处取代基 (R1,R2) (图 2) 对活性的影响: IV系列双甲基取代 (CH3,CH3) 活性最弱,III系列单甲基取代 (H,CH3)、II系列未被取代 (H,H) 活性较弱,V系列三元螺环 (-(CH2)2-) 取代较强,I系列羰基 (=O) 取代的活性最强,例如表 1化 合物的IC50值: IV1 > III1 > II1 > V1 > I1、IV2 > II2 > III2 > V2 > I2、IV3 > III3 > II3 > V3 > I3; D处(图 2) 苯环上R3取代基对活性的影响: 2-氟取代较未被取代化合物活性增强 (IC50值: I1 > I2、II1 > II2、III1 > III2、V1 > V2); 除II系列化合物外,3-或4-氟取代化合物较未被取代化合物活性减弱 (IC50值: I3 > I4 > I1、III4 > III3 > III1、V4 > V3 > V1); D处 (图 2) 苯环氟取代 (R3=F) 的位置对活性影响: 2-氟取代较3-或4-氟取代化合物活性增强 (IC50值: I3 > I4 > I2、II4 > II3 > II2、III4 > III3 > III2、V4 > V3 > V2)。 3 动物避暗实验测试
为了进一步研究化合物对动物学习记忆功能的影响,选择对乙酰胆碱酯酶抑制活性较好的I系列化合物 (I1~I4) 进行了小鼠避暗实验测试,结果如图 3所示。结果表明与模型组相比,除I3 5 mg·kg-1组外,其余各组均可显著延长进入暗室的潜伏期,且与阳性药多奈哌齐无明显差异; 同时在减少进入暗室的错误次数方面,除I1~I3 (5 mg·kg-1) 组外,其余各组与模型组均有显著性差异,且与阳性药多奈哌齐无明显差异。可见,在避暗实验中I1~I4均具有改善由东莨菪碱引起的小鼠记忆障碍的作用。
 |
Figure 3 The effects of compounds I1-I4 on memory impairment induced by scopolamine in step-through test. A: Latency; B: Error number. *P < 0.05 vs model group,**P < 0.01 vs model group,***P < 0.001 vs model group |
乙酰胆碱酯酶 (AChE)、多奈哌齐、碘化硫代乙酰胆碱 (ATCH)、5,5'-二硫代双 (2-硝基苯甲酸) (DTNB) 和东莨菪碱购于Sigma公司; 小鼠避暗实验记录仪为大正制药株式会社产品 (型号PA M5,日本); 实验用小鼠购于中国医学科学院实验动物研究所; NMR使用Bruker Avance 400型核磁共振仪测定 (TMS为内标,DMSO-d6、CDCl3、D2O为溶剂); ESI- MS采用Agilent-1100-LCQ-Advantage质谱仪; 薄层色谱硅胶GF254、硅胶H为青岛海洋化工有限公司生产; 其他试剂均为市售AR或CP级。 1 化学合成 1.1 4-[2-(5,7-二氧代-[1,3]二氧杂环戊烯并[4,5-f]异吲哚-6-基)乙基]哌啶-1-羧酸叔丁酯 (3) 的合成
将1 (130 g,0.68 mol) 加入到800 mL DMSO中,60 ℃加热溶解,加入溶有KOH (58.5 g,1.05 mol) 的乙醇溶液250 mL,再加入溶有2 (292.5 g,0.78 mol) 的DMSO溶液400 mL,60 ℃反应5 h。加入1.25 L乙酸乙酯和750 mL水萃取,无水硫酸钠干燥,蒸除溶剂,柱色谱分离得180 g化合物3,收率65.8%; 1H NMR (DMSO-d6): 0.90~1.00 (m,2H),1.36 (s,10H),1.46 (q,2H,J = 7.0 Hz),1.66 (d,2H,J = 11.9 Hz),2.62 (br s,2H),3.51 (t,2H,J = 7.0 Hz),3.88 (d,2H,J = 11.5 Hz),6.24 (s,2H),7.32 (s,2H); MS (ESI): m/z 425 [M+Na]+。 1.2 4-[2-(7-氧代-5H-[1,3]二氧杂环戊烯并[4,5-f]异吲哚-6-基)乙基]哌啶-1-羧酸叔丁酯 (4) 的合成
将3(92 g,0.23 mol) 溶于250 mL CH3OH和250 mL THF,搅拌,在0~10 ℃加入NaBH4 (10 g,0.26 mol),保温反应20~30 min,加入100 mL水,减压浓缩至干,加入500 mL乙酸乙酯和300 mL水萃取,无水硫酸钠干燥,蒸除溶剂至少量,加入300 mL石油醚,析出固体,过滤,烘干得64.7 g产物,收率70%。
将制备所得产物 (55 g,0.136 mol)、385 mL CH2Cl2、Et3N (43 mL,0.31 mol) 和4-二甲氨基吡啶 (1.8 g,0.015 mol) 加入500 mL反应瓶中,搅拌,加入乙酸酐 (31 mL,0.33 mol),室温反应1 h,加入200 mL水,萃取,无水硫酸钠干燥,蒸除溶剂,剩余物溶于400 mL乙酸乙酯,加入17 g5%钯炭 (50% 水),于60 ℃常压氢化7~8 h,过滤,蒸除溶剂至少量,滴加石油醚,冷却析出固体,过滤,得33 g化合物4,收率: 62.5%; 1H NMR (DMSO-d6): 0.94~1.04 (m,2H),1.39 (s,10H),1.47~1.54 (m,2H),1.69 (d,2H,J = 11.6 Hz),2.64 (br s,2H),3.50 (t,2H,J = 7.0 Hz),3.90 (d,2H,J = 11.3 Hz),4.32 (s,2H),6.12 (s,2H),7.08 (s,1H),7.11 (s,1H); MS (ESI): m/z 411 [M+Na]+。 1.3 4-[2-(5-甲基-7-氧代-5H-[1,3]二氧杂环戊烯并[4,5-f]异吲哚-6-基)乙基]哌啶-1-羧酸叔丁酯 (5) 的合成
将4(30 g,0.077 mol) 溶于300 mL THF,氮气保护,在-15~-10 ℃滴加二异丙基氨基锂 (2 mol·L-1) 的正庚烷溶液 (78 mL,0.16 mol) (30 min滴完),保温反应30 min,再滴加CH3I (4.8 mL,0.077 mol),室温反应2 h,加入600 mL& lt; span style='font-family:宋体;color:black'>乙酸乙酯和300 mL水萃取,无水硫酸钠干燥,蒸除溶剂,柱色谱分离得14.5 g化合物5,收率: 46.7%; 1H NMR (CDCl3): 1.07~1.21 (m,2H),1.41 (d,3H,J = 6.7 Hz),1.45 (s,10H),1.55 (q,2H,J = 7.4 Hz),1.66~1.69 (m,1H),1.80~1.83 (m,1H),2.64~2.71 (m,2H),3.17~3.24 (m,1H),3.92~4.00 (m,1H),4.06~4.09 (m,2H),4.41 (q,1H,J = 6.7 Hz),6.05 (s,2H),6.82 (s,1H),7.20 (s,1H); MS (ESI): m/z 403 [M+H]+。 1.4 4-[2-(7,7-二甲基-5-氧代-[1,3]二氧杂环戊烯并[4,5-f]异吲哚-6-基)乙基]哌啶-1-羧酸叔丁酯 (6) 的合成
以5为原料,按照1.3的方法进一步合成化合物6,收率: 54.2%; MS (ESI): m/z 417 [M+H]+。 1.5 4-[2-(5-氧代螺环[[1,3]二氧杂环戊烯并[4,5-f]异吲哚-7,1'-环丙烷]-6-基)乙基]哌啶-1-羧酸叔丁酯 (7) 的合成
将3 (75 g,0.19 mol) 溶于500 mL THF中,氮气保护,在0~10 ℃缓慢滴加400 mL CH3MgI的乙醚溶液 (1.2 mol·L-1),反应1 h,加入少量水至无气泡产生,滴加浓盐酸,调pH至酸性,加入500 mL乙酸乙酯和300 mL水萃取,无水硫酸钠干 燥,蒸除溶剂至少量,滴加石油醚,析出固体,过滤,烘干得47.6 g产物,收率: 63.8%。
将210 mL (1 mol·L-1) 二乙基锌的己烷溶液和210 mL CH2Cl2加入到反应瓶中,氮气保护,在0~ 10 ℃滴加含有 (16.2 mL,0.22 mol) CF3COOH的二氯甲烷溶液150 mL,反应20 min,滴加含有CH2I2 (16.8 mL,0.21 mol) 的二氯甲烷溶液200 mL,反应20 min,再滴加溶有42 g(0.11 mol) 以上新制备产物的二氯甲烷溶液200 mL,升温至30 ℃反应3~4 h,加入350 mL水,以1 mol·L-1盐酸调至中性,萃取,无水硫酸钠干燥,蒸除溶剂得化合物7。1H NMR (CDCl3): 1.08~1.19 (m,2H),1.28 (dd,2H,J = 6.2,7.4 Hz),1.45 (s,9H),1.48~1.57 (m,5H),1.72 (d,2H,J = 12.7 Hz),2.69 (t,2H,J = 11.6 Hz),3.20 (t,2H,J = 7.6 Hz),4.07 (d,2H,J = 13.1 Hz),6.03 (s,2H),6.43 (s,1H),7.23 (s,1H); MS (ESI): m/z 437 [M+Na]+。 1.6 中间体8~12的合成通法
向反应瓶中加入3~7 (0.03 mol) 和240 mL含10% 氯化氢的乙酸乙酯溶液,室温反应2 h,过滤,洗涤,烘干得化合物8~12。
8: 1H NMR (D2O): 1.40~1.64 (m,5H),2.02 (d,2H,J = 13.4 Hz),2.96~3.03 (m,2H),3.45~3.50 (m,4H),6.12 (s,2H),6.79 (s,2H)。
9: 1H NMR (D2O): 1.38~1.49 (m,2H),1.59~1.61 (m,3H),1.98 (d,2H,J = 13.5 Hz),2.91~2.98 (m,2H),3.42 (d,2H,J = 12.8 Hz),3.49 (t,2H,J = 7.0 Hz),4.13 (s,2H),5.97 (s,2H),6.72 (s,1H),6.76 (s,1H); MS (ESI): m/z 289 [M-Cl]+。
10: 1H NMR (D2O): 1.24 (d,3H,J = 7.0 Hz),1.44~1.58 (m,5H),1.98 (m,2H),2.96 (m,2H),3.21~3.25 (m,1H),3.44 (d,2H,J = 12.4 Hz),3.64~3.72 (m,1H),4.34 (q,1H,J = 6.6 Hz),5.94 (s,2H),6.72 (s,1H),6.79 (s,1H); MS (ESI): m/z 303 [M+H]+。
11: 1H NMR (D2O): 1.27 (s,6H),1.45 (m,2H),1.56 (q,2H,J = 6.9 Hz),1.69 (br s,1H),2.00 (d,2H,J = 13.9 Hz),3.00 (t,2H,J = 12.6 Hz),3.37 (t,2H,J = 7.6 Hz),3.45 (d,2H,J = 12.3 Hz),5.96 (s,2H),6.79 (s,1H),6.86 (s,1H); MS (ESI): m/z 317 [M-Cl]+。
12: 1H NMR (D2O): 1.06 (t,2H,J = 6.7 Hz),1.32~1.46 (m,6H),1.60 (m,1H),1.91 (d,2H,J = 13.5 Hz),2.91~3.03 (m,4H),3.39 (d,2H,J = 12.8 Hz),5.90 (s,2H),6.18 (s,1H),6.68 (s,1H); MS (ESI): m/z 315 [M-Cl]+。 1.7 化合物I~V的合成通法 (以I1~I4为例<)
将新制备的8 (5 g,0.015 mol)、K2CO3 (1.4 g,0.01 mol)、100 mL乙腈和相应的苄氯 (0.02 mol) 加入到反应瓶中,加热至50 ℃反应3~4 h,加入200 mL乙酸乙酯和100 mL水萃取,无水硫酸钠干燥,蒸除溶剂,柱色谱分离得化合物I1~I4。分别以9、10、11、12为原料,类似方法合成II1~II4、III1~III4、IV1~IV4、V1~V4,化合物波谱数据见表 2。 2 乙酰胆碱酯酶活性测定
采用改良的Ellman法[21]在体外考察化合物I~V对乙酰胆碱酯酶的抑制作用,同时用空白组、多奈哌齐为阳性对照组进行实验。配制磷酸缓冲液PBS的pH为7.2,以碘化硫代乙酰胆碱 (ATCH) 为底物 (浓度为0.01 mol·L-1),以5,5'-二硫代双 (2-硝基苯甲酸) [5,5'-dithiobis-(2-nitrobenzoic acid),DTNB] 为显色剂 (浓度为0.01 mol·L-1),乙酰胆碱酯酶 (AChE) 为0.006 U (PBS缓冲液配制),待测样品用DMSO溶解。
分别取40 µL PBS缓冲液、10 µL AChE、20 µL显色剂DTNB、10 µL各浓度的待测化合物于96孔板中,37 ℃孵育10 min,然后再加入20 µL底物ATCH,充分混匀。37 ℃保温15 min后,加入30 µL 1% 十二烷基磺酸钠 (SDS) 终止反应,使用全功能检测仪在412 nm处读取每孔吸光度 (A)。空白组用10 µL PBS缓冲液分别代替底物和待测化合物,标准组用10 µL PBS缓冲液代替待测样品,每个化合物在不同浓度均实验3次,然后以抑制率I[I = 100×(A测 - A空) / (A标 - A空)%] 对抑制剂浓度C作图,根据抑制曲线求得各种化合物的IC50值。 3 动物避暗实验
实验装置为一条件反射箱,分为明暗两部分,两室中有一小孔洞使小鼠可自由通行,箱底有铜栅,其中暗室底部的铜栅通以36 V电压。实验时将小鼠放入明室并背向暗室,因小鼠有喜暗及钻洞的习性,所以在实验训练期间会多次钻入暗室 (此行为即为错误反应)。当小鼠一走入暗室四足接触铜栅时就会受到电击,它会马上设法退出暗室。第一次训练时,记录小鼠在2 min内进入暗室的次数及第一次进入暗箱的时间 (即为潜伏期)。24 h后再进行记忆检测,观察5分钟内小鼠首次进入暗箱的时间 (即潜伏期latency) 和小鼠进入暗箱的次数 (即错误次数error number)。
雄性昆明种小鼠 (20 ± 2 g),饲养于明暗交替 (12 h/12 h) 清洁级动物房中,自由进食饮水,在动物房中适应环境一周后开始进行实验。采用东莨菪碱 所致学习记忆障碍模型,多奈哌齐 (donepezil) 为阳性对照药。将小鼠随机分成对照组 (control)、东莨菪碱模型组 (model)、I1 (5 mg·kg-1组、10 mg·kg-1组)、I2 (5 mg·kg-1组、10 mg·kg-1组)、I3 (5 mg·kg-1组、10 mg·kg-1组)、I4(5 m g·kg-1组、10 mg·kg-1组) 和多奈哌齐组 (donepezil,5 mg·kg-1)。每组16只小鼠,其中对照组、模型组每天早上固定时间灌胃给予蒸馏水,I1~I4组分别按体重给予相应剂量的药物,共给药4天。第3天模型组、I1~I4组分别在训练前20 min给予东莨菪碱 (1 mg·kg-1) 造成记忆障碍模型,然后进行避暗实验训练,24 h后 (即给药第4天) 进行正式测试,分别记录各组各只小鼠潜伏期和错误次数。所有数值均采用均数和标准误差来表示 (Mean ± SEM), 分析方法采用t检验。
| [1] | Perry DP. Advancing Alzheimer's disease drug review as a national priority [J]. Alzheimers Dement, 2009, 5: 180-181. |
| [2] | Chen S, Zhang XJ, Li L, et al. Current experimental therapy for Alzheimer's disease [J]. Curr Neuropharmacol, 2007, 5: 127-134. |
| [3] | Clark CM, Karlawish JH. Alzheimer disease: current concepts and emerging diagnostic and therapeutic strategies [J]. Ann Intern Med, 2003, 138: 400-410. |
| [4] | Zhang JT. Pathogenesis and therapeutic strategies of senior dementia [J]. Acta Pharm Sin (药学学报), 2000, 35: 635- 640. |
| [5] | Ma ZY, Zhang YG, Yang Q, et al. Design, synthesis and evaluation of new acetylcholinesterase inhibitors [J]. Acta Pharm Sin (药学学报), 2014, 49: 346-351. |
| [6] | Tumiatti V, Milelli A, Minarini A, et al. Structure-activity relationships of acetylcholinesterase noncovalent inhibitors based on a polyamine backbone. 4. Further investigation on the inner spacer [J]. J Med Chem, 2008, 51: 7308-7312. |
| [7] | Alzheimer's Association. Alzheimer's association report 2011 Alzheimer' disease facts and figures [J]. Alzheimers Dement, 2011, 7: 208-244. |
| [8] | Fang L, Kraus B, Lehmann J, et al. Design and synthesis of tacrine-ferulic acid hybrids as multi-potent anti-Alzheimer drug candidates [J]. Bioorg Med Chem Lett, 2008, 18: 2905- 2909. |
| [9] | Yang WC, Sun Q, Yu NX, et al. Design of acetylcholi-nesterase inhibitor for Alzheimer's disease therapy: from multi-binding site inhibitors to multi-target directed ligands [J]. Acta Pharm Sin (药学学报), 2012, 47: 313-321. |
| [10] | Kryger G, Silman I, Sussman JL. Structure of acetylcholi-nesterase complexed with E2020 (Aricept): implications for the design of new anti-Alzheimer drugs [J]. Structure, 1999, 7: 297-307. |
| [11] | Andreani A, Cavalli A, Granaiola M, et al. Synthesis and screening for antiacetylcholinesterase activity of (1-benzyl-4-oxopiperidin-3-ylidene)methylindoles and -pyrroles related to donepezil [J]. J Med Chem, 2001, 44: 4011-4014. |
| [12] | Contreras JM, Parrot I, Sippl W, et al. Design, synthesis, and structure-activity relationships of a series of 3-[2-(1-benzylpiperdin-4-yl)ethylamino]pyridazine derivatives as acetyl-cholinesterase inhibitors [J]. J Med Chem, 2001, 44: 2707- 2718. |
| [13] | Samadi A, Revenga MF, Perea C, et al. Synthesis, pharma-cological assessment, and molecular modeling of 6-chloro-pyridonepezils: new dual AChE inhibitors as potential drugs for the treatment of Alzheimer's disease [J]. Eur J Med Chem, 2013, 67: 64-74. |
| [14] | Akrami H, Mirjalili BF, Khoobi M, et al. Indolinone-based acetylcholinesterase inhibitors: synthesis, biological activity and molecular modeling [J]. Eur J Med Chem, 2014, 84: 375-381. |
| [15] | Takeuchi Y, Shibata T, Suzuki E, et al. 1-Benzyl-4-[(5,6-dimethoxy-2-fluoro-1-indanon)-2-yl] methylpiperidine: WO, 0220482 [P]. 2002-03-14. |
| [16] | Iimura Y, Kosasa T. Preparation of 4-substituted piperidine derivatives as acetylcholinesterase inhibiting remedies for senile dementia: WO, 2001016105 [P]. 2001-03-08. |
| [17] | Rizzo S, Bartolini M, Ceccarini L, et al. Targeting Alz-heimer's disease: novel indanone hybrids bearing a pharmacophoric fragment of AP2238 [J]. Bioorg Med Chem, 2010, 18: 1749- 1760. |
| [18] | Reeve W, Myers H. The synthesis of hydrastic acid [J]. J Am Chem Soc, 1951, 73: 1371-1372. |
| [19] | Leete E. Biosynthesis of the alkaloids of Chelidonium majus. I. The incorporation of tyrosine into chelidonine [J]. J Am Chem Soc, 1963, 85: 473-475. |
| [20] | Hendrick B, Renza R, Iolanda M, et al. Modulators of alpha7 nicotinic acetylcholine receptors and therapeutic uses thereof: WO 2007082731 [P]. 2007-07-26. |
| [21] | Terry AV, Buccafusco JJ, Herman EJ, et al. The prototypical ranitidine analog JWS-USC-75-IX improves information processing and cognitive function in animal models [J]. J Pharmacol Exp Ther, 2011, 336: 751-766. |
 2015, Vol. 50
2015, Vol. 50


